名校
1 . 根据题目信息,完成有关方程式的书写。
(1)制备氢氧化铁胶体的离子方程式为_______ 。
(2) 与石灰乳反应的化学方程式:
与石灰乳反应的化学方程式:_______ 。
(3)用单线桥分析 与水反应中电子转移的方向和数目:
与水反应中电子转移的方向和数目:_______ 。
(4)将 固体(黄色,微溶)加入
固体(黄色,微溶)加入 和
和 的混合溶液里,加热,溶液显紫色(
的混合溶液里,加热,溶液显紫色( 无色)。写出该反应的离子方程式:
无色)。写出该反应的离子方程式:_______ 。
(1)制备氢氧化铁胶体的离子方程式为
(2)
 与石灰乳反应的化学方程式:
与石灰乳反应的化学方程式:(3)用单线桥分析
 与水反应中电子转移的方向和数目:
与水反应中电子转移的方向和数目:(4)将
 固体(黄色,微溶)加入
固体(黄色,微溶)加入 和
和 的混合溶液里,加热,溶液显紫色(
的混合溶液里,加热,溶液显紫色( 无色)。写出该反应的离子方程式:
无色)。写出该反应的离子方程式:
您最近一年使用:0次
2 . 氯是重要的非金属元素,研究它的性质及用途对生产, 生活、科研具有重要意义。
(1)一氯胺(NH2Cl)是一种长效缓释水消毒剂,在中性或酸性环境中会发生反应,生成一种具有强烈杀菌作用的物质,该物质为_______ 。工业上可利用NH3和Cl2反应制备一氯胺; 生成1molNH2Cl时,转移的电子数目为_______ 。
(2)Cl2 与NaOH溶液反应可制取“84消毒液。
用过量的冷NaOH溶液吸收氯气,制得NaClO溶液(不含NaClO3), 此时ClO-的浓度为c0mol/L;加热时NaClO能转化为NaClO3,测得t时刻溶液中ClO-的浓度为c1 mol/L (不考虑加热前后溶液体积的变化)。
①用24gNaOH配成250mL溶液时,c(NaOH)=_______ mol/L。
②写出溶液中NaClO分解生成NaClO3的化学方程式:_______ 。
③t时刻溶液中c(Cl-)=_______ mol/L(用含c0、c1的代数式表示)。
(1)一氯胺(NH2Cl)是一种长效缓释水消毒剂,在中性或酸性环境中会发生反应,生成一种具有强烈杀菌作用的物质,该物质为
(2)Cl2 与NaOH溶液反应可制取“84消毒液。
用过量的冷NaOH溶液吸收氯气,制得NaClO溶液(不含NaClO3), 此时ClO-的浓度为c0mol/L;加热时NaClO能转化为NaClO3,测得t时刻溶液中ClO-的浓度为c1 mol/L (不考虑加热前后溶液体积的变化)。
①用24gNaOH配成250mL溶液时,c(NaOH)=
②写出溶液中NaClO分解生成NaClO3的化学方程式:
③t时刻溶液中c(Cl-)=
您最近一年使用:0次
3 . 下列各组物质:①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与FeCl3溶液 ⑤Cl2与NaOH溶液 ⑥Fe与HNO3溶液 ⑦Fe与H2SO4溶液 ⑧Na与O2
(1)由于浓度不同而发生不同氧化还原反应的是_______ (填序号,下同)。
(2)由于温度不同而发生不同氧化还原反应的是_______ 。
(3)氧化还原反应不受浓度、温度影响的是_______ 。
(1)由于浓度不同而发生不同氧化还原反应的是
(2)由于温度不同而发生不同氧化还原反应的是
(3)氧化还原反应不受浓度、温度影响的是
您最近一年使用:0次
4 . NaCl是一种化工原料,可以制备多种物质,如图所示:
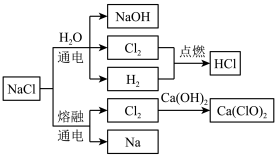
请根据以上转化关系填写下列空白。
(1)实验室用浓盐酸和MnO2制取氯气,其反应的化学方程式为___________ 。该反应中盐酸表现的性质有___________ 。
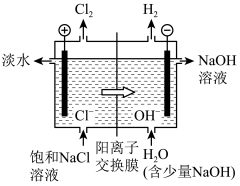
(2)饱NaCl溶液通电后发生反应的离子方程式为___________ 。电解饱和NaCl溶液的装置如图所示,在装置中间添加阳离子交换膜(只允许阳离子通过,不允许气体和阴离子通过),其作用是___________ 。
(3)将氯气溶于水配成饱和溶液,用胶头滴管将饱和氯水慢慢滴入含有酚酞的氢氧化钠稀溶液中,当滴到一定量时,红色突然褪去。产生上述现象的原因可能有两种:①氢氧化钠完全反应,反应后溶液碱性减弱,酚酞变无色;②过量饱和氯水中的次氯酸利用漂白性使溶液红色褪去。设计实验证明红色褪去的原因是①或②,简述实验方案和结论:___________ 。

请根据以上转化关系填写下列空白。
(1)实验室用浓盐酸和MnO2制取氯气,其反应的化学方程式为
(2)饱NaCl溶液通电后发生反应的离子方程式为

(3)将氯气溶于水配成饱和溶液,用胶头滴管将饱和氯水慢慢滴入含有酚酞的氢氧化钠稀溶液中,当滴到一定量时,红色突然褪去。产生上述现象的原因可能有两种:①氢氧化钠完全反应,反应后溶液碱性减弱,酚酞变无色;②过量饱和氯水中的次氯酸利用漂白性使溶液红色褪去。设计实验证明红色褪去的原因是①或②,简述实验方案和结论:
您最近一年使用:0次
5 . 某校化学小组同学将氯气通入NaOH溶液中,制得一种消毒液,运用下列实验,检测该消毒液的性质:
①将少量消毒液滴入含有淀粉的KI溶液中,溶液中出现蓝色;
②用pH试纸检测消毒液,试纸边缘为蓝紫色(pH=13),中间部分为白色;
③向消毒液中加入少量稀硫酸,溶液变为黄绿色,产生使湿润的淀粉KI试纸变蓝的气体。请回答以下问题:
(1)用离子方程式表示制备该消毒液的原理___________ 。
(2)该消毒液中大量存在的阴离子有OH-、___________ 、___________ 。
(3)实验①表现出该消毒液具有___________ 性。
(4)实验②用pH试纸检测消毒液的操作是___________ 。
(5)实验③中涉及反应的离子方程式为___________ 。
①将少量消毒液滴入含有淀粉的KI溶液中,溶液中出现蓝色;
②用pH试纸检测消毒液,试纸边缘为蓝紫色(pH=13),中间部分为白色;
③向消毒液中加入少量稀硫酸,溶液变为黄绿色,产生使湿润的淀粉KI试纸变蓝的气体。请回答以下问题:
(1)用离子方程式表示制备该消毒液的原理
(2)该消毒液中大量存在的阴离子有OH-、
(3)实验①表现出该消毒液具有
(4)实验②用pH试纸检测消毒液的操作是
(5)实验③中涉及反应的离子方程式为
您最近一年使用:0次
名校
6 . “84消毒液”是日常生活中常用的消毒液,有效成分是NaClO。在抗击新冠肺炎中广泛应用。
(1)用“84”消毒液漂白衣物时,在空气中放置一段时间漂白效果更好,结合离子方程式解释原因_ ;(已知酸性:H2CO3>HClO> )
)
(2)“84消毒液”与适量醋酸混合使用可增强消毒能力,某消毒组成员欲用盐酸代替醋酸,是否可行__ (填“是”或“否”),原因是________ ;
(3)Cl2是最早用于饮用水消毒的物质,ClO2是一种广谱消毒剂,Cl2和ClO2消毒效率(消毒效率是指单位质量的氧化剂转移电子数,转移电子数越多,消毒效率越高)高的是___ (填化学式),工业上ClO2常用NaClO3和Na2SO3溶液混合酸化反应制得,请写出此过程的离子方程式_____ ;
(4)实验室常用烧碱溶液吸收Cl2,若将Cl2通入热的烧碱溶液中,可以得到NaCl、NaClO和NaClO3的混合液。当NaCl和NaClO3的物质的量之比为15:2时,混合液中NaClO和NaClO3的物质的量之比为_ ;
(5)已知:3Cl2+8NH3=6NH4Cl+N2,化工厂可用浓氨水来检验Cl2是否泄漏,该反应中被氧化和未被氧化的NH3的物质的量之比为______ 。
(1)用“84”消毒液漂白衣物时,在空气中放置一段时间漂白效果更好,结合离子方程式解释原因
 )
)(2)“84消毒液”与适量醋酸混合使用可增强消毒能力,某消毒组成员欲用盐酸代替醋酸,是否可行
(3)Cl2是最早用于饮用水消毒的物质,ClO2是一种广谱消毒剂,Cl2和ClO2消毒效率(消毒效率是指单位质量的氧化剂转移电子数,转移电子数越多,消毒效率越高)高的是
(4)实验室常用烧碱溶液吸收Cl2,若将Cl2通入热的烧碱溶液中,可以得到NaCl、NaClO和NaClO3的混合液。当NaCl和NaClO3的物质的量之比为15:2时,混合液中NaClO和NaClO3的物质的量之比为
(5)已知:3Cl2+8NH3=6NH4Cl+N2,化工厂可用浓氨水来检验Cl2是否泄漏,该反应中被氧化和未被氧化的NH3的物质的量之比为
您最近一年使用:0次
名校
7 . Ⅰ.在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应)。生成物中含有Cl-、ClO-、ClO 三种含氯元素的离子,其中ClO-、ClO
三种含氯元素的离子,其中ClO-、ClO 两种离子的物质的量(n)与反应时间(t)的曲线如图所示。
两种离子的物质的量(n)与反应时间(t)的曲线如图所示。
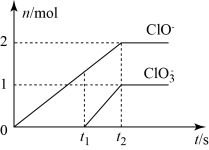
(1)t1时刻之前发生的反应是:___________
(2)t2时,Ca(OH)2与Cl2发生反应的总化学方程式为10Ca(OH)2+10Cl2=2Ca(ClO)2+Ca(ClO3)2+7CaCl2+10H2O,则该石灰乳中含有Ca(OH)2的物质的量是___________ mol。
(3)据分析,生成Ca(ClO3)2的反应是由温度升高引起的,通入Cl2的速度不同,ClO-和ClO 的比例也不同。若在原石灰乳中通入氯气的速度加快,则反应后
的比例也不同。若在原石灰乳中通入氯气的速度加快,则反应后
___________ 2(填“>”、“<”或“=”);氯酸钙(Ca(ClO3)2)为有毒化学品,其粉尘对呼吸道、眼及皮肤有刺激性,吸入氯酸钙粉尘,会因积累在体内而引起中毒。为了防止使用漂白粉时出现意外,制备漂白粉时可以采取的措施___________ (写一条即可)。
(4)请配平化学方程式:KClO3+HCl--KCl+Cl2↑+H2O___________ 。若反应过程中转移2mol e-,则生成标准状况下Cl2的体积为___________ L。
Ⅱ.有下列三个在溶液中发生的氧化还原反应:
①3FeCl3+2KI=2FeCl2+2KCl+I2;
②2FeCl2+Cl2=2FeCl3;
③K2Cr2O7+14HCl=2KCl+2CrCl3+7H2O+3Cl2↑
请根据上述反应分析推断后回答下列问题:
(5)FeCl3、I2、Cl2、K2Cr2O7的氧化性由强到弱依次是___________ 。
(6)在酸性溶液中存在大量的I-,则Cr2O 、Fe3+、Fe2+、Cl-中能与I-大量共存的离子是
、Fe3+、Fe2+、Cl-中能与I-大量共存的离子是___________ 。
 三种含氯元素的离子,其中ClO-、ClO
三种含氯元素的离子,其中ClO-、ClO 两种离子的物质的量(n)与反应时间(t)的曲线如图所示。
两种离子的物质的量(n)与反应时间(t)的曲线如图所示。
(1)t1时刻之前发生的反应是:
(2)t2时,Ca(OH)2与Cl2发生反应的总化学方程式为10Ca(OH)2+10Cl2=2Ca(ClO)2+Ca(ClO3)2+7CaCl2+10H2O,则该石灰乳中含有Ca(OH)2的物质的量是
(3)据分析,生成Ca(ClO3)2的反应是由温度升高引起的,通入Cl2的速度不同,ClO-和ClO
 的比例也不同。若在原石灰乳中通入氯气的速度加快,则反应后
的比例也不同。若在原石灰乳中通入氯气的速度加快,则反应后
(4)请配平化学方程式:KClO3+HCl--KCl+Cl2↑+H2O
Ⅱ.有下列三个在溶液中发生的氧化还原反应:
①3FeCl3+2KI=2FeCl2+2KCl+I2;
②2FeCl2+Cl2=2FeCl3;
③K2Cr2O7+14HCl=2KCl+2CrCl3+7H2O+3Cl2↑
请根据上述反应分析推断后回答下列问题:
(5)FeCl3、I2、Cl2、K2Cr2O7的氧化性由强到弱依次是
(6)在酸性溶液中存在大量的I-,则Cr2O
 、Fe3+、Fe2+、Cl-中能与I-大量共存的离子是
、Fe3+、Fe2+、Cl-中能与I-大量共存的离子是
您最近一年使用:0次
解题方法
8 . 生产生活中常用的干燥剂、净水剂有:
①固体氢氧化钠,②变色硅胶(主要成分是二氧化硅,添加少量的无水CoCl2作指示剂),③P2O5(五氧化二磷),④氯化钙,⑤浓硫酸,⑥碱石灰(主要成分是氢氧化钠、氧化钙),⑦明矾,⑧Fe(OH)3胶体。
(1)上述物质中,属于电解质的是_______ 。
(2)下列气体中,能用碱石灰干燥的是_______ 。
a.CO2 b.HCl c.H2 d.Cl2
(3)固体氢氧化钠不能干燥CO2,原因为_______ (用化学方程式表示)。
(4)往胶粒带有正电荷的Fe(OH)3胶体中加入电解质能使胶体凝聚。使一定量的胶体在一定时间内开始凝聚所需电解质的浓度(mmol·L-1),称作“聚沉值”,电解质的“聚沉值”越小,则表示其凝聚能力_______ (填“越强”或“越弱”),实验证明,凝聚能力主要取决于与胶粒带相反电荷的离子所带的电荷数,电荷数越大,凝聚能力越强,则向Fe(OH)3胶体中加入下列电解质时,其“聚沉值”最小的为_______ 。
a.NaCl b.MgCl2 c.K2SO4 d.Na3PO4
①固体氢氧化钠,②变色硅胶(主要成分是二氧化硅,添加少量的无水CoCl2作指示剂),③P2O5(五氧化二磷),④氯化钙,⑤浓硫酸,⑥碱石灰(主要成分是氢氧化钠、氧化钙),⑦明矾,⑧Fe(OH)3胶体。
(1)上述物质中,属于电解质的是
(2)下列气体中,能用碱石灰干燥的是
a.CO2 b.HCl c.H2 d.Cl2
(3)固体氢氧化钠不能干燥CO2,原因为
(4)往胶粒带有正电荷的Fe(OH)3胶体中加入电解质能使胶体凝聚。使一定量的胶体在一定时间内开始凝聚所需电解质的浓度(mmol·L-1),称作“聚沉值”,电解质的“聚沉值”越小,则表示其凝聚能力
a.NaCl b.MgCl2 c.K2SO4 d.Na3PO4
您最近一年使用:0次
解题方法
9 . 新冠疫情的发生,消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一,而氯气是制取消毒液的重要原料之一。
请回答下列问题:
(1)请写出舍勒发现氯气的化学反应方程式___________________________________ ,若收集到标准状况下3.36LCl2,则被氧化的HCl的物质的量为_____________ mol。
(2)84消毒液(主要成分是NaClO)是常用的消毒剂,工业上将氯气通入烧碱溶液中制取84消毒液,写出此反应的离子方程式_______________________________________ ,若要制取1.5L 2 mol/L的84消毒液,则需要标准状况下___________ L 氯气。
(3)新冠疫情下,人们对杀菌消毒特别重视,曾有报道某居民将84消毒液与洁厕灵(主要成分是浓盐酸)混合使用而中毒,请解释原因__________________________________ (用化学方程式表示), 该反应中氧化剂是______________ 。
请回答下列问题:
(1)请写出舍勒发现氯气的化学反应方程式
(2)84消毒液(主要成分是NaClO)是常用的消毒剂,工业上将氯气通入烧碱溶液中制取84消毒液,写出此反应的离子方程式
(3)新冠疫情下,人们对杀菌消毒特别重视,曾有报道某居民将84消毒液与洁厕灵(主要成分是浓盐酸)混合使用而中毒,请解释原因
您最近一年使用:0次
名校
10 . 氯是海水中含量最丰富的元素,氯的单质及其化合物在生成、生活领域应用广泛。
(1)自来水厂常用液氯进行杀菌消毒。氯气溶于水发生的可逆反应为_____________ (用离子方程式表示)。
(2)用液氯消毒会产生微量有机氯代物,危害人体健康,可以使用二氧化氯(ClO2)代替液氯。工业上以二硫化亚铁(FeS2)、氯酸钠(NaClO3)和硫酸溶液混合制备二氧化氯气体。已知黄铁矿中的硫元素最终氧化成 ,写出制备二氧化氯的离子方程式
,写出制备二氧化氯的离子方程式_______ 。
(3)生产漂白粉工厂的主要设备是氯化塔,塔从上到下分为四层,如图为生产流程示意图。生产漂白粉反应的化学方程式为_______ 。实际生产中,将石灰乳(含有3%~6%水分的熟石灰)从塔顶喷洒而下,氯气从塔的最底层通入。这样加料的目的是_______ 。
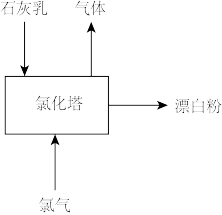
(1)自来水厂常用液氯进行杀菌消毒。氯气溶于水发生的可逆反应为
(2)用液氯消毒会产生微量有机氯代物,危害人体健康,可以使用二氧化氯(ClO2)代替液氯。工业上以二硫化亚铁(FeS2)、氯酸钠(NaClO3)和硫酸溶液混合制备二氧化氯气体。已知黄铁矿中的硫元素最终氧化成
 ,写出制备二氧化氯的离子方程式
,写出制备二氧化氯的离子方程式(3)生产漂白粉工厂的主要设备是氯化塔,塔从上到下分为四层,如图为生产流程示意图。生产漂白粉反应的化学方程式为

您最近一年使用:0次



