1 . FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。常见水处理剂还有高铁酸盐及ClO2,请回答下列问题:
(1)FeCl3可以用来刻蚀铜箔制造电路板,写出对应离子方程式________________ ;高铁酸盐是一种绿色净水剂,其有效成分是高铁酸根FeO 。能消毒,且能净水。工业上常在强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠,该反应的化学方程式为:
。能消毒,且能净水。工业上常在强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠,该反应的化学方程式为:_______________
(2)ClO2是一种高效、低毒的消毒剂,工业上可用KC1O3与Na2SO3在H2SO4存在下制得ClO2,该反应氧化剂与还原剂物质的量之比为___________
(3)漂白粉在工业中常用氯气通入石灰乳来制备,写出对应化学方程式_________________
(4)描述实验室制备氢氧化铁胶体的方法______________ ;写出对应的化学方程式_______________
(5)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3,配平下列反应:_____ 。
___________ClO + _____Fe2+ + _____ ( ) = ____Fe3+ + ___ Cl-+ _______ ( )
+ _____Fe2+ + _____ ( ) = ____Fe3+ + ___ Cl-+ _______ ( )
(1)FeCl3可以用来刻蚀铜箔制造电路板,写出对应离子方程式
 。能消毒,且能净水。工业上常在强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠,该反应的化学方程式为:
。能消毒,且能净水。工业上常在强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠,该反应的化学方程式为:(2)ClO2是一种高效、低毒的消毒剂,工业上可用KC1O3与Na2SO3在H2SO4存在下制得ClO2,该反应氧化剂与还原剂物质的量之比为
(3)漂白粉在工业中常用氯气通入石灰乳来制备,写出对应化学方程式
(4)描述实验室制备氢氧化铁胶体的方法
(5)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3,配平下列反应:
___________ClO
 + _____Fe2+ + _____ ( ) = ____Fe3+ + ___ Cl-+ _______ ( )
+ _____Fe2+ + _____ ( ) = ____Fe3+ + ___ Cl-+ _______ ( )
您最近一年使用:0次
2 . 从物质类别和元素化合价两个维度研究物质的性质及转化是重要的化学学习方法。氯及其化合物有重要用途,下图为氯元素的“价类二维图”的部分信息。请回答下列问题:
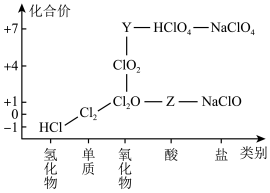
(1)根据图中信息写出Y、Z的化学式_______ 、_______ 。
(2)84消毒液能有效杀灭新冠病毒。某品牌84消毒液瓶体的部分标签如图所示。
回答下列问题:
①某使用说明中特别提醒84消毒液不可与洁厕灵(主要成分盐酸)混合使用,否则会产生 ,请用离子方程式表示其原因
,请用离子方程式表示其原因_______ 。
②如图所示,该品牌84消毒液的物质的量浓度为_______ ,84消毒液使用时需要稀释,某化学实验小组用上述84消毒液配制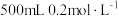 的稀溶液,需要用量筒量取该84消毒液
的稀溶液,需要用量筒量取该84消毒液_______  。
。
③配制过程中,下列操作会造成新配制的稀溶液浓度偏低的是_______ 。
A.量取浓84消毒液的量筒用蒸馏水洗涤2~3次,并把洗涤液转入容量瓶
B.容量瓶使用时未干燥
C.定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
D.定容时俯视刻度线
(3)①二氧化氯是一种高效消毒剂。实验室可用亚氯酸钠( )溶液与氯气反应制
)溶液与氯气反应制 ,同时生成氯化钠,此反应的化学方程式为
,同时生成氯化钠,此反应的化学方程式为_______ 。
② 可将废水中的
可将废水中的 转化为
转化为 而除去,本身被还原为
而除去,本身被还原为 ,该反应过程中氧化剂与还原剂的物质的量之比为
,该反应过程中氧化剂与还原剂的物质的量之比为_______ 。

(1)根据图中信息写出Y、Z的化学式
(2)84消毒液能有效杀灭新冠病毒。某品牌84消毒液瓶体的部分标签如图所示。
| 84消毒液 有效成分  规格 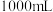 质量分数 25% 密度 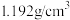 |
①某使用说明中特别提醒84消毒液不可与洁厕灵(主要成分盐酸)混合使用,否则会产生
 ,请用离子方程式表示其原因
,请用离子方程式表示其原因②如图所示,该品牌84消毒液的物质的量浓度为
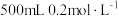 的稀溶液,需要用量筒量取该84消毒液
的稀溶液,需要用量筒量取该84消毒液 。
。③配制过程中,下列操作会造成新配制的稀溶液浓度偏低的是
A.量取浓84消毒液的量筒用蒸馏水洗涤2~3次,并把洗涤液转入容量瓶
B.容量瓶使用时未干燥
C.定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
D.定容时俯视刻度线
(3)①二氧化氯是一种高效消毒剂。实验室可用亚氯酸钠(
 )溶液与氯气反应制
)溶液与氯气反应制 ,同时生成氯化钠,此反应的化学方程式为
,同时生成氯化钠,此反应的化学方程式为②
 可将废水中的
可将废水中的 转化为
转化为 而除去,本身被还原为
而除去,本身被还原为 ,该反应过程中氧化剂与还原剂的物质的量之比为
,该反应过程中氧化剂与还原剂的物质的量之比为
您最近一年使用:0次
3 . 2020年突如其来的“新冠肺炎”使人们认识到日常杀菌消毒的重要性。其中含氯消毒剂在生产生活中有着广泛的用途。
(1)①写出实验室中制取氯气的化学方程式___________ ;
②写出次氯酸分解的化学反应方程式___________ ;新制氯水中含有的分子为___________ ;新制氯水含有多种离子,除OH-外,还有___________ ;
(2)常温下,氯气与烧碱溶液反应得“84”消毒液,NaClO 是“84”消毒液的有效成分,在此次抗击新冠病毒中发挥了重要作用。
①用离子方程式表示“84”消毒液的制备:___________ ;
②某温度下,将氯气通入NaOH溶液中,得到NaCl、NaClO和NaClO3的混合溶液,经测定ClO-与ClO 的离子个数比为1∶3,请配平该反应的:
的离子个数比为1∶3,请配平该反应的:___ ________Cl2+ _____OH- = ______Cl-+1ClO-+3ClO +_____H2O;
+_____H2O;
(3)世界卫生组织将ClO2定为A级高效安全灭菌消毒剂,它在食品保鲜、饮用水消毒等方面有广泛应用。消毒效率是用单位质量的消毒剂得电子数来表示的,ClO2作消毒剂时和氯气一样,还原产物均为Cl-,ClO2的消毒效率是氯气的___________ 倍(保留两位小数)。
(1)①写出实验室中制取氯气的化学方程式
②写出次氯酸分解的化学反应方程式
(2)常温下,氯气与烧碱溶液反应得“84”消毒液,NaClO 是“84”消毒液的有效成分,在此次抗击新冠病毒中发挥了重要作用。
①用离子方程式表示“84”消毒液的制备:
②某温度下,将氯气通入NaOH溶液中,得到NaCl、NaClO和NaClO3的混合溶液,经测定ClO-与ClO
 的离子个数比为1∶3,请配平该反应的:
的离子个数比为1∶3,请配平该反应的: +_____H2O;
+_____H2O;(3)世界卫生组织将ClO2定为A级高效安全灭菌消毒剂,它在食品保鲜、饮用水消毒等方面有广泛应用。消毒效率是用单位质量的消毒剂得电子数来表示的,ClO2作消毒剂时和氯气一样,还原产物均为Cl-,ClO2的消毒效率是氯气的
您最近一年使用:0次
2021-11-20更新
|
358次组卷
|
2卷引用:重庆市育才中学校2021-2022学年高一上学期期中考试化学试题
解题方法
4 . 物质类别和核心元素的价态是学习元素及其化合物性质的两个重要认识视角。下图为氯元素的单质及其化合物的“价~类”二维图。请回答下列问题:

(1)二维图中X的化学式(分子式)为_______ 。
(2)“84”消毒液(有效成分为NaClO)进行环境消毒时,会与空气中的CO2发生反应生成NaHCO3与次氯酸。写出该反应的离子方程式_______ 。
(3)舍勒是最早制取Cl2的化学家,请你写出舍勒制取Cl2的离子方程式_______ ,实验室对Cl2进行尾气处理的离子方程式为_______ 。
(4)二氧化氯(ClO2)是一种新型自来水消毒剂。工业上一种制备ClO2的反应原理为2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O,该反应中H2O2作_______ (填“氧化剂”或“还原剂”)。

(1)二维图中X的化学式(分子式)为
(2)“84”消毒液(有效成分为NaClO)进行环境消毒时,会与空气中的CO2发生反应生成NaHCO3与次氯酸。写出该反应的离子方程式
(3)舍勒是最早制取Cl2的化学家,请你写出舍勒制取Cl2的离子方程式
(4)二氧化氯(ClO2)是一种新型自来水消毒剂。工业上一种制备ClO2的反应原理为2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O,该反应中H2O2作
您最近一年使用:0次
23-24高一·全国·假期作业
5 . 配平下列方程式为___________
Cl2 + KOH — KCl + KClO + H2O
Cl2 + KOH — KCl + KClO + H2O
您最近一年使用:0次
解题方法
6 . 化学工业为疫情防控提供了强有力的物质支撑。次氯酸钠和二氧化氯(分子式为ClO2,其中Cl元素的化合价为+4价)在水处理等方面有广泛应用,是一种高效安全的灭菌消毒剂。
(1)NaClO溶液可由低温下将Cl2缓慢通入NaOH溶液中而制得。制备NaClO的化学方程式为_______ ;用于环境杀菌消毒的NaClO溶液须稀释并及时使用,若在空气中暴露时间过长且见光,将会导致消毒作用减弱,其原因是_______ 。
(2)ClO2的制备方法,有下列两种:
方法Ⅰ:2NaClO3 + 4HCl =2ClO2↑ + Cl2↑+ 2NaCl + 2H2O
方法Ⅱ:2NaClO3 + H2O2 +H2SO4 = 2ClO2↑ + O2↑+ Na2SO4 +2H2O
方法Ⅰ反应中,氧化产物为_______ (填化学式);方法Ⅱ反应中,产生1mol ClO2气体,电子转移_______ mol。
(3)将ClO2溶于水得到溶液,为测定其浓度,进行以下实验操作:
步骤1 取待测ClO2溶液20.00mL于锥形瓶中;
步骤2 用稀硫酸调节溶液至酸性,加入足量的KI晶体充分反应,使ClO2转化为Cl-;发生的反应为:4ClO2 + 20 KI +8H2SO4=4KCl +10I2 + 8 X + 8H2O
步骤3 逐滴加入0.1500mol·L-1的Na2S2O3溶液,发生的反应为:I2 + 2Na2S2O3= Na2S4O6 +2NaI,当将步骤2中反应生成的I2恰好完全反应时,消耗Na2S2O3溶液的体积为24.00mL。
①写出步骤2反应方程式中的X的化学式为_______ ;
②计算:ClO2溶液的物质的量浓度为_______ mol·L-1(写出计算过程)。
(1)NaClO溶液可由低温下将Cl2缓慢通入NaOH溶液中而制得。制备NaClO的化学方程式为
(2)ClO2的制备方法,有下列两种:
方法Ⅰ:2NaClO3 + 4HCl =2ClO2↑ + Cl2↑+ 2NaCl + 2H2O
方法Ⅱ:2NaClO3 + H2O2 +H2SO4 = 2ClO2↑ + O2↑+ Na2SO4 +2H2O
方法Ⅰ反应中,氧化产物为
(3)将ClO2溶于水得到溶液,为测定其浓度,进行以下实验操作:
步骤1 取待测ClO2溶液20.00mL于锥形瓶中;
步骤2 用稀硫酸调节溶液至酸性,加入足量的KI晶体充分反应,使ClO2转化为Cl-;发生的反应为:4ClO2 + 20 KI +8H2SO4=4KCl +10I2 + 8 X + 8H2O
步骤3 逐滴加入0.1500mol·L-1的Na2S2O3溶液,发生的反应为:I2 + 2Na2S2O3= Na2S4O6 +2NaI,当将步骤2中反应生成的I2恰好完全反应时,消耗Na2S2O3溶液的体积为24.00mL。
①写出步骤2反应方程式中的X的化学式为
②计算:ClO2溶液的物质的量浓度为
您最近一年使用:0次
解题方法
7 . 氯气是一种非常重要的化工原料,可用于制造盐酸、漂白剂、农药等,但氯气有毒,使用或接触到有关物质时应注意安全。请回答下列问题:
(1)新制氯水中,含有氯元素的微粒有___________ (填微粒符号,下同,不考虑水中杂质与氯气的反应),其中使新制氯水显淡黄绿色的微粒是___________ 。
(2) 和
和 可用于生产农药、催化剂等。31g红磷在一定量的氯气中燃烧,红磷和氯气均完全反应,生成白色烟雾,其中
可用于生产农药、催化剂等。31g红磷在一定量的氯气中燃烧,红磷和氯气均完全反应,生成白色烟雾,其中 和
和 的物质的量之比为3:2,则消耗的氯气在标准状况下的体积为
的物质的量之比为3:2,则消耗的氯气在标准状况下的体积为___________ L。
(3)标准状况下,氯气的密度为___________ 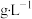 (结果保留两位小数),比空气的密度大。某地施工时挖破了废弃自来水厂的储氯罐,导致氯气泄漏。当地居民逃生和自救的正确做法是
(结果保留两位小数),比空气的密度大。某地施工时挖破了废弃自来水厂的储氯罐,导致氯气泄漏。当地居民逃生和自救的正确做法是___________ (填序号)。
a.逆风往高处跑 b.顺风往低处跑
c.用蘸有肥皂水的毛巾捂住口鼻 d.戴上用浓NaOH溶液处理过的口罩
(4)实验室制氯气时,要用NaOH溶液吸收尾气,反应的化学方程式为___________ ;通常不用澄清石灰水吸收氯气的原因是___________ 。
(1)新制氯水中,含有氯元素的微粒有
(2)
 和
和 可用于生产农药、催化剂等。31g红磷在一定量的氯气中燃烧,红磷和氯气均完全反应,生成白色烟雾,其中
可用于生产农药、催化剂等。31g红磷在一定量的氯气中燃烧,红磷和氯气均完全反应,生成白色烟雾,其中 和
和 的物质的量之比为3:2,则消耗的氯气在标准状况下的体积为
的物质的量之比为3:2,则消耗的氯气在标准状况下的体积为(3)标准状况下,氯气的密度为
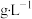 (结果保留两位小数),比空气的密度大。某地施工时挖破了废弃自来水厂的储氯罐,导致氯气泄漏。当地居民逃生和自救的正确做法是
(结果保留两位小数),比空气的密度大。某地施工时挖破了废弃自来水厂的储氯罐,导致氯气泄漏。当地居民逃生和自救的正确做法是a.逆风往高处跑 b.顺风往低处跑
c.用蘸有肥皂水的毛巾捂住口鼻 d.戴上用浓NaOH溶液处理过的口罩
(4)实验室制氯气时,要用NaOH溶液吸收尾气,反应的化学方程式为
您最近一年使用:0次
解题方法
8 . 科学的分类能够反映事物的本质特征,运用分类的方法,可以发现物质及其变化的规律。基于物质类别和元素价态,可以设计物质间转化的途径。请根据下列物质回答相关问题:
①小苏打 ②石墨 ③HCl ④酒精 ⑤FeCl3溶液 ⑥氧化钠
(1)上述物质中属于电解质的是_______ (填序号)
(2)Ⅰ.某同学用含钠元素的不同类别 物质制备NaCl。化学反应方程式如下:
a.2Na+Cl2 2NaCl
2NaCl
b.
c.NaOH+HCl=NaCl+H2O
d.
请从上述①~⑥中选择合适反应物补充b、d反应的化学反应方程式b:_______ ;d:_______ 。
Ⅱ.另一位同学从含氯元素的不同价态 考虑,认为Cl2与NaOH溶液反应也可以生成NaCl,请写出此方法的化学反应方程式_______ 。
(3)高铁酸钠(Na2FeO4)是一种新型绿色消毒剂,工业上制备Na2FeO4有多种方法,其中一种方法是用NaClO和⑤作为反应物在碱性环境下完成,此方法的化学原理可用离子反应方程式表示为:3ClO-+2Fe3++10OH-=2FeO +3Cl-+5H2O,该反应中氧化剂与还原剂的物质的量之比为
+3Cl-+5H2O,该反应中氧化剂与还原剂的物质的量之比为_______ ;请用单线桥法 在离子反应方程式上标出电子转移的方向和数目_______ 。
①小苏打 ②石墨 ③HCl ④酒精 ⑤FeCl3溶液 ⑥氧化钠
(1)上述物质中属于电解质的是
(2)Ⅰ.某同学用
a.2Na+Cl2
 2NaCl
2NaClb.
c.NaOH+HCl=NaCl+H2O
d.
请从上述①~⑥中选择合适反应物补充b、d反应的化学反应方程式b:
Ⅱ.另一位同学从
(3)高铁酸钠(Na2FeO4)是一种新型绿色消毒剂,工业上制备Na2FeO4有多种方法,其中一种方法是用NaClO和⑤作为反应物在碱性环境下完成,此方法的化学原理可用离子反应方程式表示为:3ClO-+2Fe3++10OH-=2FeO
 +3Cl-+5H2O,该反应中氧化剂与还原剂的物质的量之比为
+3Cl-+5H2O,该反应中氧化剂与还原剂的物质的量之比为
您最近一年使用:0次
9 . 实验室用二氧化锰和浓盐酸反应制取氯气并探究其性质,实验装置如图所示
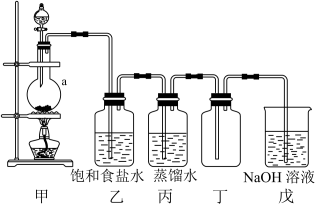
(1)仪器a的名称为___________ 。
(2)装置甲中发生反应的化学方程式为____ 。
(3)装置乙中饱和食盐水的作用是___________ 。
(4)装置丁中收集氯气的方法是___________ ,在装满氯气的集气瓶中放入红色鲜花,观察到鲜花褪色,原因是___________ 。
(5)装置戊中发生反应的离子方程式为___________ 。
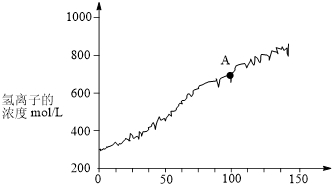
(6)充分反应后,将氯离子传感器插入广口瓶丙的溶液中,与数据采集器,计算机连接,用强光照射瓶中溶液,采集数据所得图象如图所示。
①A点溶液发生分解反应的离子方程式为___________ 。
②A点溶液中氯元素的存在形式有 和
和___________ 。


(1)仪器a的名称为
(2)装置甲中发生反应的化学方程式为
(3)装置乙中饱和食盐水的作用是
(4)装置丁中收集氯气的方法是
(5)装置戊中发生反应的离子方程式为
(6)充分反应后,将氯离子传感器插入广口瓶丙的溶液中,与数据采集器,计算机连接,用强光照射瓶中溶液,采集数据所得图象如图所示。
①A点溶液发生分解反应的离子方程式为
②A点溶液中氯元素的存在形式有
 和
和
您最近一年使用:0次
名校
10 . 请按要求回答下列问题:
(1)Al2O3能溶于强酸或强碱溶液生成盐和水,则Al2O3是一种_______ (填“酸性”、“碱性”或“两性”) 氧化物。
(2)氨气极易溶于水,其水溶液显_______ (填“酸”、“碱”或“中”)性。
(3)在常温下,将Cl2通入NaOH溶液中,可以得到漂白液。请写出该反应的离子方程式_______ 。
(4)高锰酸钾与浓盐酸在常温下能反应生成氯气,请写出反应的化学方程式_______ 。
(5)等质量的下列气体HCl、NH3、CO2、O2四种气体中,在相同温度和相同压强条件下,体积最大的是_______ 。
(6)设NA为阿伏加德罗常数的数值,如果ag某未知气体中含有的分子数为b,则cg该气体在标准状况下的体积约是_______ L (用NA的式子表示)。
(1)Al2O3能溶于强酸或强碱溶液生成盐和水,则Al2O3是一种
(2)氨气极易溶于水,其水溶液显
(3)在常温下,将Cl2通入NaOH溶液中,可以得到漂白液。请写出该反应的离子方程式
(4)高锰酸钾与浓盐酸在常温下能反应生成氯气,请写出反应的化学方程式
(5)等质量的下列气体HCl、NH3、CO2、O2四种气体中,在相同温度和相同压强条件下,体积最大的是
(6)设NA为阿伏加德罗常数的数值,如果ag某未知气体中含有的分子数为b,则cg该气体在标准状况下的体积约是
您最近一年使用:0次



