1 . 聚合硫酸铁又称聚铁,化学式[Fe2(OH)n(SO4)3-0.5n]n,广泛用于污水处理,实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、 SiO2等)制备聚铁和绿矾(FeSO4·7H2O),过程如下:
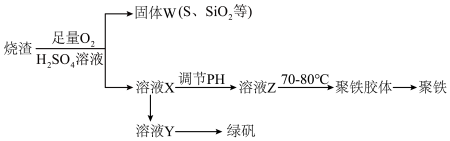
(1)验证固体W焙烧后产生的气体含有SO2的方法是_____________ 。
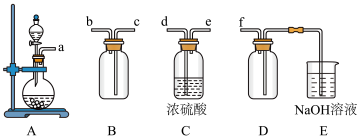
(2)实验室制备,收集干燥的SO2,所需仪器如下。装置A产生SO2,按气流方向连接各仪器口,顺序为a→_____ →_____ →_____ →_____ →f。装置D的作用是_________ ,装置E中NaOH溶液的作用是________________ 。
(3)制备绿矾时,向溶液X中加入过量_________ ,充分反应后,经_________ 操作得到溶液Y,再经浓缩、结晶等步骤得到绿矾。
(4)溶液Z的pH影响聚铁中铁的质量分数,用pH试纸测定溶液pH的操作方法为________ 。
若溶液Z的pH偏小,将导致聚铁中铁的质量分数偏_____________________ 。

(1)验证固体W焙烧后产生的气体含有SO2的方法是
(2)实验室制备,收集干燥的SO2,所需仪器如下。装置A产生SO2,按气流方向连接各仪器口,顺序为a→

(3)制备绿矾时,向溶液X中加入过量
(4)溶液Z的pH影响聚铁中铁的质量分数,用pH试纸测定溶液pH的操作方法为
若溶液Z的pH偏小,将导致聚铁中铁的质量分数偏
您最近一年使用:0次
2019-01-30更新
|
1022次组卷
|
5卷引用:2010-2011学年浙江省瑞安中学高二下学期期中考试化学试卷
(已下线)2010-2011学年浙江省瑞安中学高二下学期期中考试化学试卷2010年普通高等学校招生全国统一考试理综化学部分(山东卷)2010年高考化学试题分项专题十二 非金属元素及其化合物2010年高考化学试题分项专题十五 化学实验(已下线)2013届福建省清流一中高三第三阶段考试化学试卷
名校
2 . MnSO4是制备高纯MnCO3的中间原料。实验室用如图所示装置可制备少量MnSO4溶液,反应原理为:MnO2+H2SO3=MnSO4+H2O;下列说法错误的是


| A.缓慢通入混合气体可提高SO2的转化率 |
| B.若不通N2,则烧瓶中的进气管口容易被堵塞 |
| C.若实验中将N2换成空气,则反应液中c(Mn2+)/c(SO42-)的浓度之比变大 |
| D.石灰乳对尾气的吸收效果比澄清石灰水更好 |
您最近一年使用:0次
名校
3 . 已知二氧化硅、二氧化硫和二氧化碳都是酸性氧化物,化学性质具有一定的相似性,镁和钠的化学性质也具有一定的相似性。

用如上图所示装置进行镁和二氧化硫的实验,其中A是制备二氧化硫的发生装置。
(1)选择制取二氧化硫的合适试剂________ (填序号)。
①10%的硫酸溶液 ②80%硫酸溶液 ③亚硫酸钠固体 ④亚硫酸钙固体
(2)写出装置B中发生反应的化学方程式:______________________ 。
(3)你认为该装置的不足之处是_______________________________ (任写2条)。

用如上图所示装置进行镁和二氧化硫的实验,其中A是制备二氧化硫的发生装置。
(1)选择制取二氧化硫的合适试剂
①10%的硫酸溶液 ②80%硫酸溶液 ③亚硫酸钠固体 ④亚硫酸钙固体
(2)写出装置B中发生反应的化学方程式:
(3)你认为该装置的不足之处是
您最近一年使用:0次
2018-02-25更新
|
367次组卷
|
3卷引用:浙江省嘉兴市第一中学2017-2018学年高二上学期期末考试化学试题
4 . 研究性学习小组用Na2SO3与硫酸溶液(硫酸与水体积比1∶1)制备SO2并进行性质探究实验。

(1)D中的实验现象是_____________ ,C、E中溶液都褪色,分别体现SO2________ 、_______ 性质。
(2)请在方框中画出收集SO2以及尾气处理装置(标相关试剂)。___________
(3)研究小组发现B中有白色沉淀,为了清楚沉淀的物质,研究小组往B中加入过量稀盐酸,沉淀 不溶解,你认为留下的沉淀物是__________ ,形成该沉淀的反应方程式有:_________________________________________________________________________________
为了进一步验证沉淀原因,研究小组另取BaC12溶液,加热煮沸,冷却及 时加入少量苯液封,然后再通SO2,结果发现沉淀量减少,但仍有轻微浑 浊。研究小组改进A装置(如图),再进行实验,B中没有出现浑浊。下列气体可作为X气体的是_____________
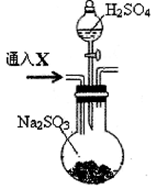
A.CO2 B.NH3 C.O3 D.N2 E.NO2
(4)SO2为空气污染物,研究小组为测定某工厂区空气中SO2的含量,取10m3(标准状况)的空气, 缓慢通过足量溴水中,在所得溶液中加入过量的BaC12溶液,将产生的白色沉淀洗涤、干燥,用电子称称其质量为0.233g,则:
① 检验洗涤已经干净的实验操作是_________________________________________________ 。
② 试计算此空气中SO2的浓度(列出计算表达式并计算结果,结果单位用mg/m3表示)。________________________________________________

(1)D中的实验现象是
(2)请在方框中画出收集SO2以及尾气处理装置(标相关试剂)。
(3)研究小组发现B中有白色沉淀,为了清楚沉淀的物质,研究小组往B中加入过量稀盐酸,沉淀 不溶解,你认为留下的沉淀物是
为了进一步验证沉淀原因,研究小组另取BaC12溶液,加热煮沸,冷却及 时加入少量苯液封,然后再通SO2,结果发现沉淀量减少,但仍有轻微浑 浊。研究小组改进A装置(如图),再进行实验,B中没有出现浑浊。下列气体可作为X气体的是

A.CO2 B.NH3 C.O3 D.N2 E.NO2
(4)SO2为空气污染物,研究小组为测定某工厂区空气中SO2的含量,取10m3(标准状况)的空气, 缓慢通过足量溴水中,在所得溶液中加入过量的BaC12溶液,将产生的白色沉淀洗涤、干燥,用电子称称其质量为0.233g,则:
① 检验洗涤已经干净的实验操作是
② 试计算此空气中SO2的浓度(列出计算表达式并计算结果,结果单位用mg/m3表示)。
您最近一年使用:0次
5 . 工业上常通过高温分解FeSO4的方法制备Fe2O3,其化学方程式为:
2FeSO4="===" Fe2O3+SO2↑+SO3↑ 为检验FeSO4高温分解的产物,进行如下实验:
①取少量FeSO4高温分解得到的固体,加一定量稀盐酸溶解,向该溶液中加入适量的KSCN溶液,观察溶液颜色的变化以检验Fe3+是否存在。
②将FeSO4高温分解产生的气体通入右图所示的装置中,以检验产生的气体中是否含有SO2和SO3。请回答以下问题:
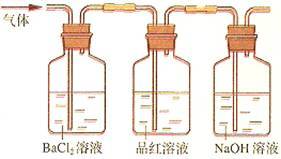
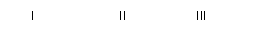
(1)写出用KSCN检验Fe3+的离子方程式_____________________________ 。
(2)装置I中试剂为氯化钡溶液,进行操作②时氯化钡溶液中有白色沉淀产生。甲同学说,这个白色沉淀可能是BaSO4和BaSO3的混合物;乙同学说,这个白色沉淀是BaSO4;丙同学说,这个白色沉淀是BaSO3。请你设计一个简单的实验帮他们加以鉴别。________________________________ ;你认为上述哪一位同学的观点正确?____________________
(3)装置II中试剂为品红溶液,其作用是___________________ ,品红溶液中可观察到现象是______________________________________ 。
(4)装置III中试剂为NaOH溶液,其目的是________________________ 。
2FeSO4="===" Fe2O3+SO2↑+SO3↑ 为检验FeSO4高温分解的产物,进行如下实验:
①取少量FeSO4高温分解得到的固体,加一定量稀盐酸溶解,向该溶液中加入适量的KSCN溶液,观察溶液颜色的变化以检验Fe3+是否存在。
②将FeSO4高温分解产生的气体通入右图所示的装置中,以检验产生的气体中是否含有SO2和SO3。请回答以下问题:

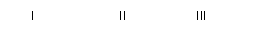
(1)写出用KSCN检验Fe3+的离子方程式
(2)装置I中试剂为氯化钡溶液,进行操作②时氯化钡溶液中有白色沉淀产生。甲同学说,这个白色沉淀可能是BaSO4和BaSO3的混合物;乙同学说,这个白色沉淀是BaSO4;丙同学说,这个白色沉淀是BaSO3。请你设计一个简单的实验帮他们加以鉴别。
(3)装置II中试剂为品红溶液,其作用是
(4)装置III中试剂为NaOH溶液,其目的是
您最近一年使用:0次
11-12高二上·广东中山·期中
6 . 实验室制取乙烯,常因温度过高而发生副反应。部分乙醇跟浓硫酸反应,生成炭黑、二氧化硫、二氧化碳和水蒸气。请用下图编号为(1)~(6)的实验装置,设计一个实验,以验证上述反应后的混合气体中含有二氧化硫、二氧化碳和水蒸气。
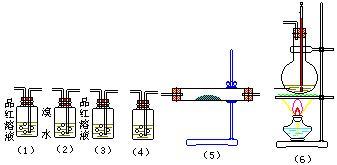
(1)装置(5)中的固体药品为_________________________ ,用以验证的产物是_______________________ 。
(2)装置(4)中的溶液是________________________________ ,用以验证的产物是_______________________ 。
(3)装置(1)中的现象是_________________________ ;装置(2)中溴水的作用是________________________ 。
(4)实验室制备乙烯的化学方程式:________________________________________ 。

(1)装置(5)中的固体药品为
(2)装置(4)中的溶液是
(3)装置(1)中的现象是
(4)实验室制备乙烯的化学方程式:
您最近一年使用:0次
名校
解题方法
7 . 下列装置及其使用说法正确的是
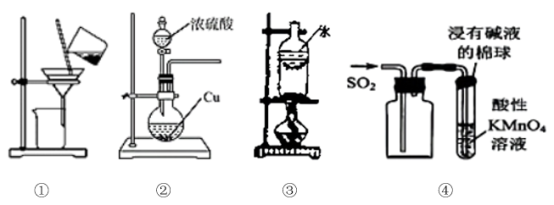

| A.用装置①分离胶体和溶液 | B.用装置②制备SO2 |
| C.用装置③分离NaCl和I2 | D.用装置④收集SO2并验证其漂白性 |
您最近一年使用:0次
2017-11-05更新
|
811次组卷
|
7卷引用:河北省定州中学2017-2018学年高二(承智班)上学期期中考试化学试题
名校
8 . Na2S2O3·5H2O在化学定量分析中常用作基准物质,实验室制备原理为:2Na2S+Na2CO3+4SO2 3Na2S2O3+CO2。设计如下装置(夹持仪器省略)进行实验。
3Na2S2O3+CO2。设计如下装置(夹持仪器省略)进行实验。
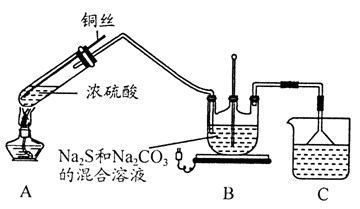
(1)A中发生的化学反应方程式为____________ 。
(2)C中所盛试剂可能是______ ;若要停止A中的化学反应,除取下酒精灯停止加热外,还可以采取的操作是_______ 。
(3)学生乙在加热A后,发现液面下的铜丝变黑。对黑色生成物该学生提出如下假设:
①可能是CuO ②可能是Cu2O ③可能是CuS
学生丙提出假设②一定不成立,依据是___________ ;该生用如下实验进一步验证黑色物质的组成:
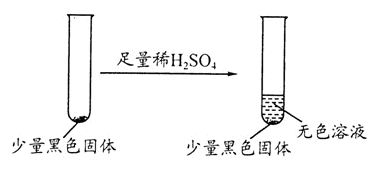
基于上述假设分析,黑色物质的组成为_____________ (填化学式)。
(4)实验室用Na2S2O3标液测量废水Ba2+的浓度,过程如下:
(已知:2 S2O32一+I2=S4O62—+2 I-)

①写出BaCrO4沉淀与过量HI、HCl溶液反应的离子方程式______________ ;
②以淀粉为指示剂,则到达滴定终点的现象是_______________ ;
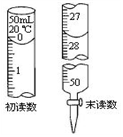
③若标液Na2S2O3的浓度0.0030mol·L-1,消耗该Na2S2O3溶液体积如图,则废水Ba2+的浓度为___ 。
 3Na2S2O3+CO2。设计如下装置(夹持仪器省略)进行实验。
3Na2S2O3+CO2。设计如下装置(夹持仪器省略)进行实验。
(1)A中发生的化学反应方程式为
(2)C中所盛试剂可能是
(3)学生乙在加热A后,发现液面下的铜丝变黑。对黑色生成物该学生提出如下假设:
①可能是CuO ②可能是Cu2O ③可能是CuS
学生丙提出假设②一定不成立,依据是

基于上述假设分析,黑色物质的组成为
(4)实验室用Na2S2O3标液测量废水Ba2+的浓度,过程如下:
(已知:2 S2O32一+I2=S4O62—+2 I-)

①写出BaCrO4沉淀与过量HI、HCl溶液反应的离子方程式
②以淀粉为指示剂,则到达滴定终点的现象是
③若标液Na2S2O3的浓度0.0030mol·L-1,消耗该Na2S2O3溶液体积如图,则废水Ba2+的浓度为

您最近一年使用:0次
2016-12-09更新
|
1246次组卷
|
3卷引用:贵州省思南中学2016-2017学年高二下学期期末考试化学试题
13-14高二上·江苏扬州·期末
名校
解题方法
9 . 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:

其中CO的制备原理:HCOOH CO↑+H2O,并设计出原料气的制备装置(如下图)
CO↑+H2O,并设计出原料气的制备装置(如下图)
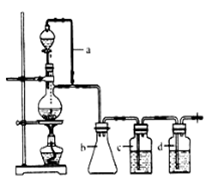
请填写下列空白:
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2-丙醇,从中可以选择合适的试剂制备氢气、丙烯。写出制备丙烯的化学方程式:________________________________ 。
(2)若用以上装置制备干燥纯净的CO,装置中a的作用是__________ ,装置中b的作用是_________ ,c中盛装的试剂是___________ 。
(3)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是___________ (填序号)
①饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水 ④无水CuSO4 ⑤品红溶液
(4)正丁醛经催化加氢得到含少量正丁醛的1-丁醇粗品,为纯化1-丁醇,该小组查阅文献得知:
①R—CHO+NaHSO3(饱和) RCH(OH)SO3Na↓;②沸点:乙醚34℃,1-丁醇118℃,并设计出如下提纯路线:
RCH(OH)SO3Na↓;②沸点:乙醚34℃,1-丁醇118℃,并设计出如下提纯路线:

试剂1为______________ ,操作2为_____________ ,操作3为_____________ 。

其中CO的制备原理:HCOOH
 CO↑+H2O,并设计出原料气的制备装置(如下图)
CO↑+H2O,并设计出原料气的制备装置(如下图)
请填写下列空白:
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2-丙醇,从中可以选择合适的试剂制备氢气、丙烯。写出制备丙烯的化学方程式:
(2)若用以上装置制备干燥纯净的CO,装置中a的作用是
(3)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是
①饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水 ④无水CuSO4 ⑤品红溶液
(4)正丁醛经催化加氢得到含少量正丁醛的1-丁醇粗品,为纯化1-丁醇,该小组查阅文献得知:
①R—CHO+NaHSO3(饱和)
 RCH(OH)SO3Na↓;②沸点:乙醚34℃,1-丁醇118℃,并设计出如下提纯路线:
RCH(OH)SO3Na↓;②沸点:乙醚34℃,1-丁醇118℃,并设计出如下提纯路线:
试剂1为
您最近一年使用:0次
2017-02-17更新
|
502次组卷
|
7卷引用:2012-2013学年江苏省扬州市高二上学期期末检测化学(选修)试卷
(已下线)2012-2013学年江苏省扬州市高二上学期期末检测化学(选修)试卷2014-2015学年江苏省东台市三仓中学高二12月月考化学试卷2016-2017学年江苏省扬州中学高二12月月考化学卷江苏省启东中学2017-2018学年高二下学期期中考试(普通班)化学试题【市级联考】江苏省高邮市2018-2019学年高二上学期期中考试化学试题(已下线)河北省石家庄市第二中学2016-2017学年高二下学期3月份月考化学试题(已下线)【镇江新东方】高二上第一次月考一中三校联考
名校
10 . 二氯化砜(SO2Cl2)是一种无色液体,主要用于有机物和无机物的氯化等。其熔点为-54.1℃.沸点为69.2℃;常温下比较稳定,受热易分解,遇水剧烈反应生成硫酸和盐酸。
(1)制备。实验室可利用SO2和Cl2按下列装置制取少量SO2Cl2(丙中放有樟脑液,起催化作用)。已知SO2(g)+Cl2(g) SO2Cl2(g) △H<0
SO2Cl2(g) △H<0
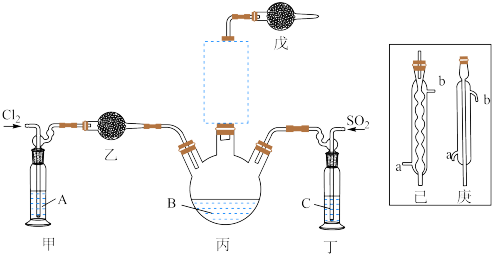
①可以用浓盐酸和酸性高锰酸钾制取氯气,该反应的化学方程式为_________ ;溶液A为____ 。
②上图实框中仪器己的名称为_____ ;反应装置图的虚框中未画出的仪器是____ (填“己”或“庚”)。
③如果将丙装置放入冰水中,会更有利于二氯化砜的生成,其原因是___________ 。
④下列有关说法错误的是________ (填编号)。
a.乙、戊装置相同,在实验中的作用也完全相同
b.甲、丁装置为洗气装置,可用于气体的除杂和干燥
c.组装仪器后首先要进行的操作是检查装置的气密性
d.为提高反应物的利用率,可控制甲、丁装置中产生气泡的速率相等
(2)提纯。将收集到的产物进行减压蒸馏,减压蒸馏的目的是____________________ 。
(3)测定。取1.00g蒸馏后液体,小心地完全溶于水,向所得的溶液中加入足量氯化钡溶液,测得生成沉淀的质量为1.60g,则所得蒸馏成分中二氯化砜的质量百分含量为_________ %。
(4)贮存。二氯化砜应储存于阴凉、干燥、通风良好的库房。但久置后微显黄色,其原因是______ 。
(1)制备。实验室可利用SO2和Cl2按下列装置制取少量SO2Cl2(丙中放有樟脑液,起催化作用)。已知SO2(g)+Cl2(g)
 SO2Cl2(g) △H<0
SO2Cl2(g) △H<0
①可以用浓盐酸和酸性高锰酸钾制取氯气,该反应的化学方程式为
②上图实框中仪器己的名称为
③如果将丙装置放入冰水中,会更有利于二氯化砜的生成,其原因是
④下列有关说法错误的是
a.乙、戊装置相同,在实验中的作用也完全相同
b.甲、丁装置为洗气装置,可用于气体的除杂和干燥
c.组装仪器后首先要进行的操作是检查装置的气密性
d.为提高反应物的利用率,可控制甲、丁装置中产生气泡的速率相等
(2)提纯。将收集到的产物进行减压蒸馏,减压蒸馏的目的是
(3)测定。取1.00g蒸馏后液体,小心地完全溶于水,向所得的溶液中加入足量氯化钡溶液,测得生成沉淀的质量为1.60g,则所得蒸馏成分中二氯化砜的质量百分含量为
(4)贮存。二氯化砜应储存于阴凉、干燥、通风良好的库房。但久置后微显黄色,其原因是
您最近一年使用:0次
2016-12-09更新
|
223次组卷
|
3卷引用:湖南省衡阳市第八中学2016-2017学年高二理科实验班下学期第二次月考理科综合化学试题



