解题方法
1 . 钠元素在自然界中分布很广,储量极为丰富,都以化合态存在,如氯化钠、碳酸钠、硫酸钠等。钠单质和钠的化合物在生产、生活中被广泛应用。请根据钠及其化合物性质按要求完成各题。
(1)钠原子在周期表中的位置为___________ ,钠离子的结构示意图___________ 。
(2)请选择下列物质中合适的物质,按要求填空:
NaOH、 CaCl2 、 SO2 、H2O 、 NH4Cl
只含有离子键的有___________ (填化学式,下同),既含有离子键又含有共价键的有___________ ,只含共价键的有___________ 。
(3)钠的化学性质活泼,暴露在空气中生成___________ 色Na2O,在空气中加热,生成___________ 色的Na2O2,Na2O2可用作呼吸面具、潜水艇的供氧剂,写出Na2O2和CO2反应的化学方程式:___________ 。
(4)钠能在冷水中剧烈反应,该反应的实验现象中描述错误的是____。
(5)下列有关物质的性质描述正确的是____。
(6)Na2CO3和NaHCO3是常见的钠盐,且两者之间可以相互转化,请回答下列问题:
①下列有关碳酸钠和碳酸氢钠的说法正确的是____ 。
A.热稳定性:Na2CO3<NaHCO3
B.溶于水后,碳酸钠溶液呈碱性,碳酸氢钠溶液呈酸性
C.相同条件下,与同种酸反应的剧烈程度:Na2CO3<NaHCO3
D.石碱风化是物理过程
②写出Na2CO3在水溶液中的电离方程式___________ ;
③向Na2CO3溶液中通入CO2可生成NaHCO3,该反应的化学方程式为___________ ;
④加热15.0g碳酸钠和碳酸氢钠的固体混合物至质量不再发生变化,剩余固体的质量为11.9g,则混合物中碳酸氢钠的质量分数为____ 。
A.42% B.44% C.56% D.58%
(1)钠原子在周期表中的位置为
(2)请选择下列物质中合适的物质,按要求填空:
NaOH、 CaCl2 、 SO2 、H2O 、 NH4Cl
只含有离子键的有
(3)钠的化学性质活泼,暴露在空气中生成
(4)钠能在冷水中剧烈反应,该反应的实验现象中描述错误的是____。
| A.钠熔化成银白色小球 | B.钠在水面上迅速游动 |
| C.发出嘶嘶的声响 | D.溶液逐渐变红色 |
| A.钠与氧气反应时的产物主要取决于氧气的用量及纯度 |
| B.钠投入硫酸铜溶液中有气体和蓝色沉淀产生 |
| C.Na2O和Na2O2分别溶于水中,所得的产物相同 |
| D.FeCl3溶液用于铜质印刷线路制作,原因是两者发生置换反应 |
①下列有关碳酸钠和碳酸氢钠的说法正确的是
A.热稳定性:Na2CO3<NaHCO3
B.溶于水后,碳酸钠溶液呈碱性,碳酸氢钠溶液呈酸性
C.相同条件下,与同种酸反应的剧烈程度:Na2CO3<NaHCO3
D.石碱风化是物理过程
②写出Na2CO3在水溶液中的电离方程式
③向Na2CO3溶液中通入CO2可生成NaHCO3,该反应的化学方程式为
④加热15.0g碳酸钠和碳酸氢钠的固体混合物至质量不再发生变化,剩余固体的质量为11.9g,则混合物中碳酸氢钠的质量分数为
A.42% B.44% C.56% D.58%
您最近一年使用:0次
解题方法
2 . 某小组想通过实验探究 Na、Mg、Al 三种金属元素性质的递变规律。
I.探究 Na、Mg、Al 分别与水反应的情况。
实验①:切一小块绿豆大小的金属 Na,用滤纸吸干其表面的煤油,将其投入盛有 100ml 水(含酚酞)的烧杯中。观察到 Na 与冷水发生剧烈反应,烧杯内溶液变红。
(1)与水反应生成氢氧化钠和氢气,写出该反应的化学方程式___________ 。
(2)上述反应中,作还原剂的是___________ 。
A.Na B.H2O C.NaOH
(3)上述反应中若有23克金属Na被充分反应,则产生气体在标况下的体积约为___________ L。
(4)溶液中,使酚酞试液变红的微粒是___________ 。
A.Na+ B.H+ C.OH-
实验②:分别取一小段镁条和铝条,放入两支试管中,向试管中各加入 2ml 水,再滴入2 滴酚酞试液,观察到试管中均无明显现象。
有同学提出实验②的设计存在问题,故对实验②作如下调整:
实验③:另取镁条和铝条,分别用砂纸打磨去除它们表面的氧化膜后,再进行以上实验 操作并加热。观察到:未加热时,反应现象均不明显;加热后镁条表面有气泡生成,溶液变红;加热后 Al 与水反应现象仍不明显。
(5)实验②的设计中未考虑到的因素是___________ 。
(6)通过上述实验,得出 Na、Mg、Al 的金属性由强到弱的顺序是___________ 。
Ⅱ.比较 NaOH、Mg(OH)2、Al(OH)3碱性的强弱。
实验④:在试管中加入2ml 0.5mol·L-1 Al2(SO4)3溶液,然后逐滴滴加 2mol·L-1 NaOH溶液至过量,边加边振荡。观察到试管中先出现白色沉淀后全部溶解。
实验⑤:在试管中加入2ml 1mol·L-1 MgSO4溶液,然后逐滴滴加2mol·L-1 NaOH 溶液至过量,边加边振荡。观察到试管中出现白色沉淀且不溶解。
(7)写出由实验④、⑤的实验现象可推导得出的结论。
(8)综上实验可知,NaOH、Mg(OH)2、Al(OH)3的碱性由强到弱的顺序是___________ 。
I.探究 Na、Mg、Al 分别与水反应的情况。
实验①:切一小块绿豆大小的金属 Na,用滤纸吸干其表面的煤油,将其投入盛有 100ml 水(含酚酞)的烧杯中。观察到 Na 与冷水发生剧烈反应,烧杯内溶液变红。
(1)与水反应生成氢氧化钠和氢气,写出该反应的化学方程式
(2)上述反应中,作还原剂的是
A.Na B.H2O C.NaOH
(3)上述反应中若有23克金属Na被充分反应,则产生气体在标况下的体积约为
(4)溶液中,使酚酞试液变红的微粒是
A.Na+ B.H+ C.OH-
实验②:分别取一小段镁条和铝条,放入两支试管中,向试管中各加入 2ml 水,再滴入2 滴酚酞试液,观察到试管中均无明显现象。
有同学提出实验②的设计存在问题,故对实验②作如下调整:
实验③:另取镁条和铝条,分别用砂纸打磨去除它们表面的氧化膜后,再进行以上实验 操作并加热。观察到:未加热时,反应现象均不明显;加热后镁条表面有气泡生成,溶液变红;加热后 Al 与水反应现象仍不明显。
(5)实验②的设计中未考虑到的因素是
(6)通过上述实验,得出 Na、Mg、Al 的金属性由强到弱的顺序是
Ⅱ.比较 NaOH、Mg(OH)2、Al(OH)3碱性的强弱。
实验④:在试管中加入2ml 0.5mol·L-1 Al2(SO4)3溶液,然后逐滴滴加 2mol·L-1 NaOH溶液至过量,边加边振荡。观察到试管中先出现白色沉淀后全部溶解。
实验⑤:在试管中加入2ml 1mol·L-1 MgSO4溶液,然后逐滴滴加2mol·L-1 NaOH 溶液至过量,边加边振荡。观察到试管中出现白色沉淀且不溶解。
(7)写出由实验④、⑤的实验现象可推导得出的结论。
| 现象 | 结论 | |
| ④ | 出现白色沉淀 | Al(OH)3的碱性比NaOH弱 |
| 沉淀全部溶解 | ||
| ⑤ | 出现白色沉淀 | |
| 沉淀不溶解 | Mg(OH)2无酸性 |
您最近一年使用:0次
解题方法
3 . (一)金属种类繁多,性质各异,应用十分广泛。
(1)将一小块金属钠分别放入下列溶液中,对应的现象正确的是_______
(2)少量Na2O2与H2O反应生成H2O2和NaOH。下列说法正确的是_______
(3)向某溶液中加入少量Na2O2后,原溶液中所含的下列离子浓度会显著改变的是_______
(二)在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:(已知:室温下Ksp[Fe(OH)3]= 4.0×10-38)Ⅰ:向废液中投入过量铁屑,充分反应后分离出固体和滤液;Ⅱ:向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气。
(4)FeCl3蚀刻铜箔反应的离子方程式为___________ :过程Ⅰ分离得到固体的主要成分是___________ 。
(5)过程Ⅱ中发生反应的化学方程式为___________ ;过程Ⅱ中调节溶液的pH为5,最终溶液中金属离子浓度为___________ 。(列式计算)
(6)有同学研究上述“过程Ⅱ”方案后,设计了下列方案:向滤液中加入足量的NaOH溶液使Fe2+完全沉淀,过滤,小心加热沉淀直到水分蒸干,再灼烧到质量不再变化。假设现有200mL0.1mol·L-1FeCl2溶液,按照上述操作,理想情况下,该同学应该得到的固体质量为___________ ;通过比较,说明石灰水—空气法与氢氧化钠—加热法相比的一个优点是___________ 。
(1)将一小块金属钠分别放入下列溶液中,对应的现象正确的是_______
| A.饱和NaOH溶液:产生气体,恢复至室温后溶液的pH增大 |
| B.稀CuSO4溶液:产生气体,有紫红色物质析出 |
| C.MgCl2溶液:产生气体,生成白色沉淀 |
| D.NH4NO3溶液:产生无色无味气体 |
(2)少量Na2O2与H2O反应生成H2O2和NaOH。下列说法正确的是_______
A.Na2O2的电子式为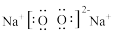 | B.H2O的空间构型为直线形 |
| C.H2O2中O元素的化合价为-1 | D.NaOH仅含离子键 |
(3)向某溶液中加入少量Na2O2后,原溶液中所含的下列离子浓度会显著改变的是_______
A.NO | B.NH | C.HCO | D.SO |
(二)在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:(已知:室温下Ksp[Fe(OH)3]= 4.0×10-38)Ⅰ:向废液中投入过量铁屑,充分反应后分离出固体和滤液;Ⅱ:向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气。
(4)FeCl3蚀刻铜箔反应的离子方程式为
(5)过程Ⅱ中发生反应的化学方程式为
(6)有同学研究上述“过程Ⅱ”方案后,设计了下列方案:向滤液中加入足量的NaOH溶液使Fe2+完全沉淀,过滤,小心加热沉淀直到水分蒸干,再灼烧到质量不再变化。假设现有200mL0.1mol·L-1FeCl2溶液,按照上述操作,理想情况下,该同学应该得到的固体质量为
您最近一年使用:0次
名校
解题方法
4 . Ⅰ.汉弗里·戴维是英国著名化学家,他提出:“电流与化合物的相互作用,是最有可能将所有物质分解为元素的方法”。通过这种方法,他制备得到了金属钾和钠。
(1)戴维在1807年用电解熔融烧碱的方法制得金属钠,电极之间设置镍网做隔膜以分离电解产物,电解的总反应方程式为:___________ 。
(2)关于金属钠,下列叙述正确的是___________
(3)钠在空气中燃烧产物的颜色是___________ , 电子式为___________ 。
(4)ag钠完全燃烧后,将固体充分溶解在bg水中,所得溶液溶质的质量分数是___________ 。
(5)某实验小组把 CO2通入饱和Na2CO3溶液制取NaHCO3,装置如下图所示(气密性已检验,部分夹持装置略):
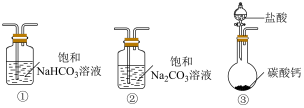
选取必要的实验装置,正确的连接顺序为___________ (填序号)。
Ⅱ.为确定制得的固体样品是纯净的 NaHCO3小组同学提出下列实验方案:
甲方案:将样品溶液与BaCl2溶液反应,观察现象
乙方案:测定 pH法
(6)为判定甲方案的可行性, 某同学用NaHCO3分析纯配制的溶液,与BaCl2溶液等体积混合进行实验,结果如下:
此实验说明甲方案___________ (填“可行”或“不可行”)。
(7)产生浑浊(伴有气体产生)的离子方程式:___________ 。
(8)乙方案是:取等质量的固体样品和分析纯 Na2CO3加等质量的水配制的溶液,分别与 pH 计测定 pH,pH更大的是___________ (填化学式)。
(1)戴维在1807年用电解熔融烧碱的方法制得金属钠,电极之间设置镍网做隔膜以分离电解产物,电解的总反应方程式为:
(2)关于金属钠,下列叙述正确的是___________
| A.钠可保存在煤油或CCl4等液态有机物中 |
| B.氯化钠在电流作用下电离出的钠离子和氯离子 |
| C.钠与硫在常温下化合就能剧烈反应,甚至发生爆炸 |
| D.若金属钠着火,可采用干粉灭火器灭火 |
(3)钠在空气中燃烧产物的颜色是
(4)ag钠完全燃烧后,将固体充分溶解在bg水中,所得溶液溶质的质量分数是
(5)某实验小组把 CO2通入饱和Na2CO3溶液制取NaHCO3,装置如下图所示(气密性已检验,部分夹持装置略):

选取必要的实验装置,正确的连接顺序为
Ⅱ.为确定制得的固体样品是纯净的 NaHCO3小组同学提出下列实验方案:
甲方案:将样品溶液与BaCl2溶液反应,观察现象
乙方案:测定 pH法
(6)为判定甲方案的可行性, 某同学用NaHCO3分析纯配制的溶液,与BaCl2溶液等体积混合进行实验,结果如下:
NaHCO3溶液 BaCl2溶液 | 0.2mol/L | 0.1mol/L | 0.02mol/L |
| 0.2mol/L | 浑浊 | 浑浊 | 少许浑浊 |
| 0.1mol/L | 浑浊 | 少许浑浊 | 无现象 |
| 0.02mol/L | 少许浑浊 | 无现象 | 无现象 |
(7)产生浑浊(伴有气体产生)的离子方程式:
(8)乙方案是:取等质量的固体样品和分析纯 Na2CO3加等质量的水配制的溶液,分别与 pH 计测定 pH,pH更大的是
您最近一年使用:0次
名校
解题方法
5 . 已知: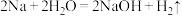 ,将
,将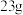 钠与过量的重水
钠与过量的重水 反应,产生气体的质量是
反应,产生气体的质量是___________ 。
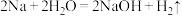 ,将
,将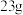 钠与过量的重水
钠与过量的重水 反应,产生气体的质量是
反应,产生气体的质量是
您最近一年使用:0次
名校
解题方法
6 . 等物质的量的钠和铁分别与足量的水反应,下列说法正确的是
| A.反应条件相同 | B.金属单质都作氧化剂 |
| C.转移电子的数目相同 | D.反应的还原产物相同 |
您最近一年使用:0次
名校
解题方法
7 . 下图中甲是演示金属钠与水反应的实验装置,为收集并检验气体产物,某兴趣小组将甲装置改进成如图中乙或丙所示的装置,请根据要求回答下列问题。
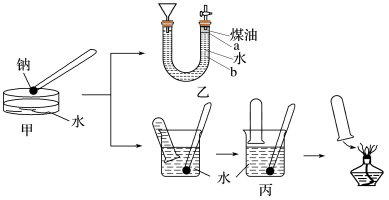
(1)写出钠与水反应的离子方程式:___________ 。和铝相比,钠与水反应更剧烈的原因是___________ (从原子结构的角度进行解释说明)。
(2)若按乙装置实验,液体添加完毕后,关闭活塞,打开右边胶塞,向煤油中加入一小块钠,立即塞好胶塞,可观察到的现象是________。
(3)用乙装置实验,点燃气体产物时,是否需要检验纯度?___ (填“是“或“否”)。
(4)按图丙所示方法来收集产生的气体,需将钠用某种金属包好,再放入水中。取相同质量的钠按下列两种情况收集产生的气体:①用扎有多个小孔的铝箔包住钠②用扎有多个小孔的铜箔包住钠,在相同条件下的体积关系是________ 。
A.二者收集气体一样多 B.①收集气体体积较大 C.②收集气体体积较大

(1)写出钠与水反应的离子方程式:
(2)若按乙装置实验,液体添加完毕后,关闭活塞,打开右边胶塞,向煤油中加入一小块钠,立即塞好胶塞,可观察到的现象是________。
| A.钠块始终保持在煤油中的a处,直至完全消失 |
| B.钠处于煤油和水的交界处上下浮动 |
| C.随反应的进行煤油与胶塞处液面下降,漏斗中液面上升 |
| D.最终钠块在煤油中燃烧起来 |
(4)按图丙所示方法来收集产生的气体,需将钠用某种金属包好,再放入水中。取相同质量的钠按下列两种情况收集产生的气体:①用扎有多个小孔的铝箔包住钠②用扎有多个小孔的铜箔包住钠,在相同条件下的体积关系是
A.二者收集气体一样多 B.①收集气体体积较大 C.②收集气体体积较大
您最近一年使用:0次
8 . 钠及其化合物具有独特的性质和广泛的用途。
I.
(1)下图为钠与水反应的实验示意图。
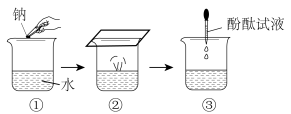
i.②中现象说明钠的密度比水___________ (“大”或“小”)。
ii.实验中观察到钠融成小球,下列能量变化示意图中能解释该现象的是___________ 。
a.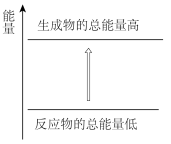 B.
B.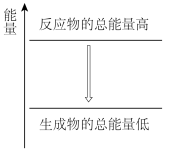
iii.③中加入酚酞试液后的现象是___________ 。
(2)用化学方程式表示由氯化钠制取金属钠的原理。___________
(3)将一定量的 通入
通入 溶液中。所得溶液转移至Y形管的一侧,并放入小磁子;向Y形管另一侧支管中加入
溶液中。所得溶液转移至Y形管的一侧,并放入小磁子;向Y形管另一侧支管中加入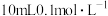 盐酸,Y形管上端连接压强传感器。将Y形管倾斜,使两支管中的溶液混合,启动磁力搅拌器,采集压强数据。当数据变化平缓时,停止采集数据,得到如图所示的实验结果:
盐酸,Y形管上端连接压强传感器。将Y形管倾斜,使两支管中的溶液混合,启动磁力搅拌器,采集压强数据。当数据变化平缓时,停止采集数据,得到如图所示的实验结果:
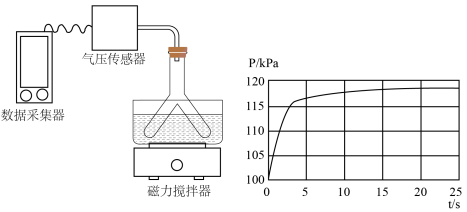
其中0~5s发生反应的离子方程式为___________ 。20s时溶液中的溶质是___________ (不考虑气体在水中的溶解)。
II.过碳酸钠(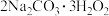 ),俗名固态双氧水,具有去污杀菌等功效。其制备原理为:
),俗名固态双氧水,具有去污杀菌等功效。其制备原理为: (反应放热)
(反应放热)
(4)结合 和
和 的性质,推测制备过碳酸钠的原料中,
的性质,推测制备过碳酸钠的原料中, 与
与 的物质的量之比应
的物质的量之比应___________ 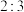 。
。
A.大于 B.等于 C.小于
向 中加入
中加入 溶液的速度不能过快,原因是
溶液的速度不能过快,原因是___________ 。
(5)在过碳酸钠的生产过程中需要加入稳定剂,以得到稳定性好的过碳酸钠产品,保证其在一定贮存期内仍具有高活性的氧含量。以不同种类的稳定剂制备过碳酸钠产品,测得其活性氧质量分数随时间的变化如图所示:
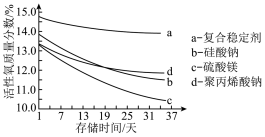
由图可知,制备过碳酸钠时应选择的稳定剂是___________ ,理由是___________ 。
A.a B.b C.c D.d
I.
(1)下图为钠与水反应的实验示意图。

i.②中现象说明钠的密度比水
ii.实验中观察到钠融成小球,下列能量变化示意图中能解释该现象的是
a.
 B.
B.
iii.③中加入酚酞试液后的现象是
(2)用化学方程式表示由氯化钠制取金属钠的原理。
(3)将一定量的
 通入
通入 溶液中。所得溶液转移至Y形管的一侧,并放入小磁子;向Y形管另一侧支管中加入
溶液中。所得溶液转移至Y形管的一侧,并放入小磁子;向Y形管另一侧支管中加入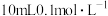 盐酸,Y形管上端连接压强传感器。将Y形管倾斜,使两支管中的溶液混合,启动磁力搅拌器,采集压强数据。当数据变化平缓时,停止采集数据,得到如图所示的实验结果:
盐酸,Y形管上端连接压强传感器。将Y形管倾斜,使两支管中的溶液混合,启动磁力搅拌器,采集压强数据。当数据变化平缓时,停止采集数据,得到如图所示的实验结果:
其中0~5s发生反应的离子方程式为
II.过碳酸钠(
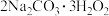 ),俗名固态双氧水,具有去污杀菌等功效。其制备原理为:
),俗名固态双氧水,具有去污杀菌等功效。其制备原理为: (反应放热)
(反应放热)(4)结合
 和
和 的性质,推测制备过碳酸钠的原料中,
的性质,推测制备过碳酸钠的原料中, 与
与 的物质的量之比应
的物质的量之比应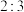 。
。A.大于 B.等于 C.小于
向
 中加入
中加入 溶液的速度不能过快,原因是
溶液的速度不能过快,原因是(5)在过碳酸钠的生产过程中需要加入稳定剂,以得到稳定性好的过碳酸钠产品,保证其在一定贮存期内仍具有高活性的氧含量。以不同种类的稳定剂制备过碳酸钠产品,测得其活性氧质量分数随时间的变化如图所示:

由图可知,制备过碳酸钠时应选择的稳定剂是
A.a B.b C.c D.d
您最近一年使用:0次
名校
9 . I.金属在生活中有着广泛的应用,人们甚至根据使用材料的种类,将人类漫长的历史分为了三个大的时代,分别是石器时代、青铜器时代,而后是铁器时代,直到19世纪早期,戴维组装了一个特别大的电池用于实验,先后发现了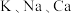 等许多金属。
等许多金属。
(1)造成上述人们利用金属先后顺序事实的最主要因素是_______。
(2)1827年维勒用金属钾还原熔融的无水氯化铝得到较纯的金属铝单质,但今天人们早已舍弃这种制备金属铝的方法,你认为可能的原因有_______ (写出一种合理原因即可)。写出现代工业上获得金属铝的化学反应方程式_______ 。
(3)已知铍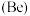 与铝的性质相似。则下列判断正确的是_______。
与铝的性质相似。则下列判断正确的是_______。
(4)钠是一种活泼的金属,将绿豆大的钠块投入如图所示的烧杯中,可能出现的现象_______。

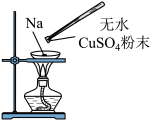
(5)在蒸发皿中放一小块钠,加热至熔化成小球时,用玻璃棒蘸取少量无水 粉末与其接触,瞬间产生耀眼的火花,同时有红色物质生成。下列说法错误的是_______。
粉末与其接触,瞬间产生耀眼的火花,同时有红色物质生成。下列说法错误的是_______。
(6)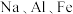 都是重要的金属元素。下列说法正确的是_______。
都是重要的金属元素。下列说法正确的是_______。
(7)类推的思维方法在化学学习中有时会产生错误结论,因此结论最终要经过实践的检验,才能决定其正确与否,下列几种关于金属的类推结论中,错误的是_______。
①钠与水反应生成 和
和 ;所有金属与水反应都生成碱和
;所有金属与水反应都生成碱和
②铁露置在空气中一段时间后就会生锈;性质更活泼的铝不能稳定存在于空气中
③ 与S直接化合时可得到
与S直接化合时可得到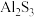 ;
; 与S直接化合时也可得到
与S直接化合时也可得到
④ 受热易分解,
受热易分解,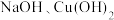 受热也易分解
受热也易分解
(8)单质A的燃烧热大。已知A为短周期元素,其气态原子逐个失去1~4个电子所需吸收能量如表所示。若该原子核外电子有三层,则该元素位于周期表_______ 族,写出A燃烧后形成的氧化物的电子式:_______ 。
Ⅱ.炼铁的主要原理之一是赤铁矿。它的主要成分在一定条件下有下列反应: 。在反应形成的固体混合物(
。在反应形成的固体混合物( 、
、 )中,元素铁和氧的质量比用
)中,元素铁和氧的质量比用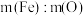 表示。
表示。
(9)根据上述反应,固体质量每减轻 ,将产生
,将产生
_______ L(S.T.P)。
(10)上述反应形成的固体混和物中,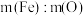 不可能是_______。
不可能是_______。
(11) 也是铁重要的氧化物之一,其在高温下与金属铝反应,也能获得单质铁,写出相关的化学反应方程式
也是铁重要的氧化物之一,其在高温下与金属铝反应,也能获得单质铁,写出相关的化学反应方程式_______ 。
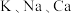 等许多金属。
等许多金属。(1)造成上述人们利用金属先后顺序事实的最主要因素是_______。
| A.地壳中金属元素的含量 | B.金属的延展性 |
| C.金属的导电性 | D.金属活泼性的差异 |
(3)已知铍
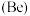 与铝的性质相似。则下列判断正确的是_______。
与铝的性质相似。则下列判断正确的是_______。| A.铍遇冷水剧烈反应 | B.氧化铍的化学式为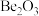 |
| C.氢氧化铍能与氢氧化钠溶液反应 | D. 能置换出 能置换出 中的镁单质 中的镁单质 |

| A.钠块在煤油、水两液体界面处反应,上下跳动,水层变红 |
| B.钠块只在煤油层中游动,并放出气体 |
| C.钠块只在水层中游动,钠块熔化,水层变红 |
| D.钠块在四氯化碳、水两液体界面处反应,熔化成小球并上下跳动,水层变红 |
 粉末与其接触,瞬间产生耀眼的火花,同时有红色物质生成。下列说法错误的是_______。
粉末与其接触,瞬间产生耀眼的火花,同时有红色物质生成。下列说法错误的是_______。
| A.钠受热易熔成小球说明其熔点低 |
B.钠与 粉末反应时放出大量热 粉末反应时放出大量热 |
C.一定条件下, 可与 可与 反应生成 反应生成 |
D.将无水 粉末改为 粉末改为 溶液,反应现象相同 溶液,反应现象相同 |
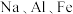 都是重要的金属元素。下列说法正确的是_______。
都是重要的金属元素。下列说法正确的是_______。| A.三者的最高价氧化物对应水化物均为碱性 | B.三者的氢氧化物都是白色固体 |
| C.三者的氯化物都可用化合反应制得 | D.三者的单质在空气中最终都生成氧化物 |
①钠与水反应生成
 和
和 ;所有金属与水反应都生成碱和
;所有金属与水反应都生成碱和
②铁露置在空气中一段时间后就会生锈;性质更活泼的铝不能稳定存在于空气中
③
 与S直接化合时可得到
与S直接化合时可得到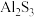 ;
; 与S直接化合时也可得到
与S直接化合时也可得到
④
 受热易分解,
受热易分解,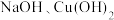 受热也易分解
受热也易分解| A.①② | B.③④ | C.①②③ | D.①②③④ |
 |  |  | 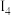 | …后续省略 | |
电离能(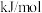 ) ) | 738 | 1451 | 7733 | 10540 | … |
Ⅱ.炼铁的主要原理之一是赤铁矿。它的主要成分在一定条件下有下列反应:
 。在反应形成的固体混合物(
。在反应形成的固体混合物( 、
、 )中,元素铁和氧的质量比用
)中,元素铁和氧的质量比用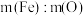 表示。
表示。(9)根据上述反应,固体质量每减轻
 ,将产生
,将产生
(10)上述反应形成的固体混和物中,
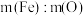 不可能是_______。
不可能是_______。| A.21∶9 | B.21∶7.5 | C.21∶5 | D.21∶8 |
 也是铁重要的氧化物之一,其在高温下与金属铝反应,也能获得单质铁,写出相关的化学反应方程式
也是铁重要的氧化物之一,其在高温下与金属铝反应,也能获得单质铁,写出相关的化学反应方程式
您最近一年使用:0次
22-23高一下·上海浦东新·期中
名校
解题方法
10 . 钠元素在自然界中都以化合物的形式存在,钠的单质和化合物用途广泛,回答下列问题:
(1)采用空气和Na为原料可制备 。空气与熔融的金属Na反应前需依次通过的试剂为
。空气与熔融的金属Na反应前需依次通过的试剂为___________ 、___________ (选填编号)。
a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d. 溶液
溶液
(2)向酸性 溶液中加入
溶液中加入 粉末,观察到溶液褪色,发生如下反应:___________
粉末,观察到溶液褪色,发生如下反应:___________ ___________
___________ ___________
___________ ___________
___________ ___________
___________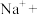 ___________
___________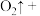 ___________。配平上述离子方程式,并用单线桥法表示电子转移的方向和数目
___________。配平上述离子方程式,并用单线桥法表示电子转移的方向和数目___________ 。该反应说明 具有
具有___________ (选填“氧化性”“还原性”或“漂白性”)。
某研究性学习小组的同学,为测定某种含有少量氧化钠的过氧化钠试样中过氧化钠的含量,称取w g样品与足量的水反应,测定生成气体在通常状况(约20℃,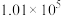 Pa)的体积,设计了如图所示的实验装置进行探究
Pa)的体积,设计了如图所示的实验装置进行探究
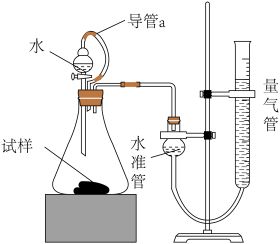
回答下列问题:
(3)装置中导管a的作用是___________ 。
(4)反应前后量气管中液面读数分别为 mL、
mL、 mL(实验条件下的气体摩尔体积为
mL(实验条件下的气体摩尔体积为 L/mol),试计算试样中过氧化钠的质量分数:
L/mol),试计算试样中过氧化钠的质量分数:___________ 。
(5)通过实验,测得该试样中过氧化钠质量分数偏高,产生这种现象的原因可能是___________ (选填编号)。
a.反应后测定气体体积时水准管的水面低于量气管的水面
b.锥形瓶中留有反应生成的气体
c.测定气体体积时未冷却至室温
(1)采用空气和Na为原料可制备
 。空气与熔融的金属Na反应前需依次通过的试剂为
。空气与熔融的金属Na反应前需依次通过的试剂为a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d.
 溶液
溶液(2)向酸性
 溶液中加入
溶液中加入 粉末,观察到溶液褪色,发生如下反应:___________
粉末,观察到溶液褪色,发生如下反应:___________ ___________
___________ ___________
___________ ___________
___________ ___________
___________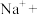 ___________
___________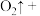 ___________。配平上述离子方程式,并用单线桥法表示电子转移的方向和数目
___________。配平上述离子方程式,并用单线桥法表示电子转移的方向和数目 具有
具有某研究性学习小组的同学,为测定某种含有少量氧化钠的过氧化钠试样中过氧化钠的含量,称取w g样品与足量的水反应,测定生成气体在通常状况(约20℃,
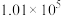 Pa)的体积,设计了如图所示的实验装置进行探究
Pa)的体积,设计了如图所示的实验装置进行探究
回答下列问题:
(3)装置中导管a的作用是
(4)反应前后量气管中液面读数分别为
 mL、
mL、 mL(实验条件下的气体摩尔体积为
mL(实验条件下的气体摩尔体积为 L/mol),试计算试样中过氧化钠的质量分数:
L/mol),试计算试样中过氧化钠的质量分数:(5)通过实验,测得该试样中过氧化钠质量分数偏高,产生这种现象的原因可能是
a.反应后测定气体体积时水准管的水面低于量气管的水面
b.锥形瓶中留有反应生成的气体
c.测定气体体积时未冷却至室温
您最近一年使用:0次



