解题方法
1 . 加热蒸干氯化镁溶液时因水解不完全会得到一种灰白色沉淀一一碱式氯化镁,化学式可表示为Mgx(OH)yClz•nH2O.设计如图装置验证其化学式。下列有关实验说法不正确的是( )


| A.碱式氯化镁受热分解可以产生氧化镁,氯气和水 |
| B.结束反应时,先停止加热,通一段时间N2后再关闭活塞K |
| C.①②中依次盛装氢氧化钠溶液、浓硫酸 |
| D.只需称取原样品质量、反应结束后硬质玻璃管中剩余固体质量以及装置①增重的质量即可推出其化学式 |
您最近一年使用:0次
2020-04-01更新
|
297次组卷
|
3卷引用:四川省成都市2020届高三上学期第二次统考检测化学试题
2 . 下列关于物质用途的叙述中,不正确的是
| A.钾钠合金呈液态,可做快中子反应堆的导热剂 |
| B.硅酸钠俗称“水玻璃”,是制造水泥的原料 |
| C.硅是太阳能电池的常用材料 |
| D.氧化镁的熔点高达2800℃,是优质的耐高温材料 |
您最近一年使用:0次
2019-08-12更新
|
279次组卷
|
3卷引用:四川省泸县第五中学2019-2020学年高一下学期第一次在线月考化学试题
3 . 将一定质量的Mg-Al合金投入100mL一定物质的量浓度的某HCl溶液中,充分反应。向反应后的溶液中逐滴加入一定物质的量浓度的NaOH溶液,生成沉淀的质量与所加NaOH溶液的体积关系如下图。回答下列问题:

(1)写出OA段和BC段反应的离子方程式:
OA:___________ ; BC:_____________ ;
(2)原Mg-Al合金的质量是_____________ 。
(3)原HCl溶液的物质的量浓度是________________ 。
(4)所加NaOH溶液的物质的量浓度是____________ 。

(1)写出OA段和BC段反应的离子方程式:
OA:
(2)原Mg-Al合金的质量是
(3)原HCl溶液的物质的量浓度是
(4)所加NaOH溶液的物质的量浓度是
您最近一年使用:0次
2019-03-20更新
|
1332次组卷
|
4卷引用:四川省泸州市泸县第二中学2019-2020学年高一下学期第一次在线月考化学试题
4 . 下图为某化工企业生产流程示意图,下列说法正确的是
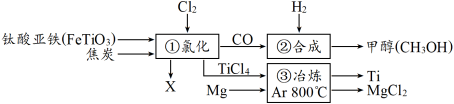

| A.钛酸亚铁(FeTiO3)中钛元素为+3价 |
| B.①中反应为:2FeTiO3+6C+7Cl2=2X+2TiCl4+6CO,则X为FeCl3 |
| C.③中氩气(Ar)作反应物,反应类型为置换反应 |
| D.②中为使原料全部转化为甲醇,理论上CO和H2投料的质量比为1:2 |
您最近一年使用:0次
2018-09-02更新
|
785次组卷
|
4卷引用:四川省绵阳东辰国际学校2021-2022学年高一上学期第一次月考试化学试题
5 . 某课外活动小组根据镁与CO2的反应设计实验探究镁与NO2的反应。
甲同学推测产物是MgO和N2;
乙同学推测产物除了MgO和N2外,固体中还可能含有Y。
该小组同学设计了以下装置探究镁与NO2反应的固体产物,并测定其组成。

(1)实验开始时,先关闭止水夹后打开弹簧夹,再打开分液漏斗活塞,当硬质玻璃管充满红棕色气体后,打开止水夹,关闭弹簧夹,最后点燃酒精灯。这样做的目的是___________________________________________________________
(2)装置B中的试剂可以选用________
A、浓硫酸 B、无水氯化钙 C、五氧化二磷 D、碱石灰
(3)装置C中盛装氢氧化钠溶液的作用是:___________________________________
(4)为保证生成气体体积的准确性,读取量筒刻度时应注意的问题是①气体恢复至室温再读数;②_______________________________ ;③______________________________ 。
(5)实验结束后,同学们将固体产物取出与水反应,发现有刺激性气味的气体产生,该气体能使湿润的石蕊试纸变蓝。说明乙组同学推测正确,请写出Y与水反应的化学方程式__________________________________
(6)若初始加入镁粉质量为3.6 g,在足量的NO2中充分反应后 ,收集到N2体积为448mL (标准状况),则产物中MgO的质量是_________
甲同学推测产物是MgO和N2;
乙同学推测产物除了MgO和N2外,固体中还可能含有Y。
该小组同学设计了以下装置探究镁与NO2反应的固体产物,并测定其组成。

(1)实验开始时,先关闭止水夹后打开弹簧夹,再打开分液漏斗活塞,当硬质玻璃管充满红棕色气体后,打开止水夹,关闭弹簧夹,最后点燃酒精灯。这样做的目的是
(2)装置B中的试剂可以选用
A、浓硫酸 B、无水氯化钙 C、五氧化二磷 D、碱石灰
(3)装置C中盛装氢氧化钠溶液的作用是:
(4)为保证生成气体体积的准确性,读取量筒刻度时应注意的问题是①气体恢复至室温再读数;②
(5)实验结束后,同学们将固体产物取出与水反应,发现有刺激性气味的气体产生,该气体能使湿润的石蕊试纸变蓝。说明乙组同学推测正确,请写出Y与水反应的化学方程式
(6)若初始加入镁粉质量为3.6 g,在足量的NO2中充分反应后 ,收集到N2体积为448mL (标准状况),则产物中MgO的质量是
您最近一年使用:0次
2018-04-01更新
|
1382次组卷
|
11卷引用:四川省棠湖中学2018届高三下学期第二次月考理综化学试题
四川省棠湖中学2018届高三下学期第二次月考理综化学试题【全国百强校】四川省棠湖中学2017-2018学年高二零诊模拟理综化学试题贵州省遵义市第四中学2018届高三3月月考化学试题【全国市级联考】四川省泸州市2018届高三高考模拟考试理综化学试题山东省青州市2018届高三第三次高考模拟考试理综化学试题2020届高考化学二轮复习大题精准训练 ——物质组成的探究实验题(已下线)【南昌新东方】2019-2020 莲塘一中 高一(上)期末 004(已下线)专题6.2 实验综合题(必考)(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升广东省中山市中山纪念中学2020届高三第二次质量检测化学试题安徽省滁州市定远县育才学校2021届高三下学期开学考试理综化学试题江西省南昌市南昌县莲塘第一中学2019-2020学年高一上学期期末化学试题
名校
6 . 氯酸镁常用作催熟剂、除草剂等,实验室制备Mg(C1O3)2·6H2O 的流程如下:

已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②四种化合物的溶解度(S)随温度(T)变化曲线如图所示。
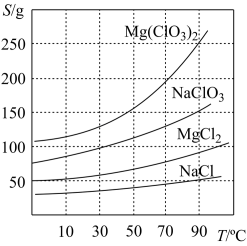
(1)过滤所需要的主要玻璃仪器有_________ 。
(2)加MgO后过滤所得滤渣的主要成分的化学式为_________ 。
(3)加入NaClO3饱和溶液后发生反应的化学方程式为__________ ,再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为:①________ ;______ ;洗涤;②将滤液冷却结晶;③过滤、洗涤。
(4)产品中Mg(ClO3)2·6H2O含量的测定:(已知Mg(ClO3)2·6H2O的摩尔质量为299 g/mol)
步骤1:准确称量3.50g产品配成100 mL溶液。
步骤2:取10.00mL于锥形瓶中,加入10.00mL稀硫酸和20.00mL1.000mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100mol/LK2Cr2O7 溶液滴定剩余的Fe2+至终点。反应的方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7 溶液15.00mL。
① 写出步骤2中发生反应的离子方程式__________ ;
② 产品中Mg(ClO3)2·6H2O的质量分数为_______ 。(保留到小数点后一位)

已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②四种化合物的溶解度(S)随温度(T)变化曲线如图所示。

(1)过滤所需要的主要玻璃仪器有
(2)加MgO后过滤所得滤渣的主要成分的化学式为
(3)加入NaClO3饱和溶液后发生反应的化学方程式为
(4)产品中Mg(ClO3)2·6H2O含量的测定:(已知Mg(ClO3)2·6H2O的摩尔质量为299 g/mol)
步骤1:准确称量3.50g产品配成100 mL溶液。
步骤2:取10.00mL于锥形瓶中,加入10.00mL稀硫酸和20.00mL1.000mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100mol/LK2Cr2O7 溶液滴定剩余的Fe2+至终点。反应的方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7 溶液15.00mL。
① 写出步骤2中发生反应的离子方程式
② 产品中Mg(ClO3)2·6H2O的质量分数为
您最近一年使用:0次
2013·安徽黄山·一模
名校
7 . 下列物质的转化在给定条件下能实现的是( )
①Al2O3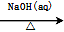 NaAlO2(aq)
NaAlO2(aq)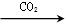 Al(OH)3
Al(OH)3
②S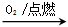 SO3
SO3 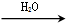 H2SO4
H2SO4
③饱和NaCl(aq) NaHCO3
NaHCO3 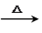 Na2CO3
Na2CO3
④Fe2O3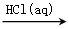 FeCl3(aq)
FeCl3(aq)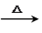 无水FeCl3
无水FeCl3
⑤MgCl2(aq)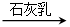 Mg(OH)2
Mg(OH)2 MgO
MgO
①Al2O3
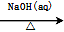 NaAlO2(aq)
NaAlO2(aq)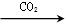 Al(OH)3
Al(OH)3②S
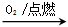 SO3
SO3 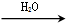 H2SO4
H2SO4③饱和NaCl(aq)
 NaHCO3
NaHCO3 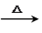 Na2CO3
Na2CO3④Fe2O3
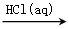 FeCl3(aq)
FeCl3(aq) 无水FeCl3
无水FeCl3⑤MgCl2(aq)
 Mg(OH)2
Mg(OH)2 MgO
MgO| A.②③④ | B.①③⑤ | C.②④⑤ | D.①④⑤ |
您最近一年使用:0次
2018-02-26更新
|
736次组卷
|
19卷引用:2014届四川成都树德中学高三第三次理综测试化学试卷
(已下线)2014届四川成都树德中学高三第三次理综测试化学试卷(已下线)2015届浙江省台州中学高三上学期第一次统练化学试卷2015届吉林省东北师大附中高三上学期第一次摸底化学试卷2016届福建省闽粤联合体高三上学期第三次联考化学试卷2016届湖北省荆州市公安一中高三上学期12月月考化学试卷黑龙江省齐齐哈尔市第八中学2018届高三第二次月考化学试题河北省定州中学2018届高三承智班上学期第二次月考化学试题江西省临川第二中学2018届高三上学期第四次月考(期中)化学试题安徽省合肥市第九中学2019届高三第一次月考化学试题天津市静海区第一中学2020届高三3月统练化学试题天津市南开中学2020届高三第二次月考化学试题(已下线)2013届安徽省黄山市高中毕业班第一次质量检测化学试卷(已下线)2014高考化学名师知识点精编 专题12钠、铝及其重要化合物练习卷(已下线)2013-2014学年浙江省杭州地区六校高二下学期期中联考化学试卷宁夏石嘴山市第三中学2018届高三上学期期中考试化学试题江西省新余市第一中学2018届高三毕业班第四次模拟考试化学试题内蒙古集宁一中2018届高三上学期期末考试化学试题黑龙江省伊春市第二中学2017-2018学年高二下学期期末考试化学试题2020届高三化学总复习考点强化练习:物质及其变化
8 . 下列实验结果与图像不相符的是


| A.向含有盐酸、氯化镁和氯化铝的溶液中逐渐加入氢氧化钠溶液直至过量 |
| B.向澄清石灰水中通入二氧化碳气体直至过量 |
| C.向氯化铝的溶液中逐渐加入氢氧化钠溶液直至过量 |
| D.向氯化铝的溶液中逐渐加入氨水直至过量 |
您最近一年使用:0次
2018-02-24更新
|
806次组卷
|
5卷引用:四川省宜宾市叙州区第一中学校2022-2023学年高一上学期第三次月考试化学试题
9 . 将一定质量由镁和铝组成的合金投入200 mL一定物质的量浓度的盐酸中,合金全部溶解,向所得溶液中滴加6 mol/L的NaOH溶液到过量,生成沉淀的质量与加入的NaOH溶液的体积关系如下图所示:
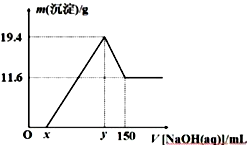
下列说法不正确的是

下列说法不正确的是
| A.镁铝合金中,Mg与Al的物质的量之比为 2∶1 |
| B.所用盐酸的物质的量浓度为4 mol/L |
| C.图象中的x=20 |
| D.图象中,Ox 段的离子方程式为:H++OH-= H2O;y~150 段的离子方程式为:Al(OH)3+OH-=AlO2-+ 2H2O |
您最近一年使用:0次
2018-01-21更新
|
616次组卷
|
3卷引用:四川省成都市第七中学2017-2018学年度上学期高一1月阶段性测试化学试题
10 . 有一镁铝合金,用适量稀硫酸完全溶解,再加入氢氧化钠溶液,析出沉淀的质量与加入氢氧化钠的体积关系如图所示,原合金中镁铝的质量比为
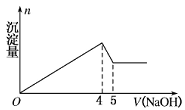

| A.4:9 | B.4:3 | C.8:9 | D.20:27 |
您最近一年使用:0次
2018-01-01更新
|
207次组卷
|
3卷引用:四川省南充高级中学2017-2018学年高一12月月考化学试题



