真题
1 . 无水氯化铝在生产、生活中应用广泛。
(1)氯化铝在水中形成具有净水作用的氢氧化铝胶体,其反应的离子方程式为___________ 。
(2)工业上用铝土矿(主要成分为Al2O3,含有Fe2O3、SiO2等杂质)制取无水氯化铝的一种工艺流程示意如下:

已知:
①步骤Ⅰ中焙烧使固体水分挥发、气孔数目增多,其作用是___________ (只要求写出一种)。
②步骤Ⅱ中若不通入氯气和氧气,则反应生成相对原子质量比硅大的单质是___________ 。
③已知:
Al2O3(s)+3C(s)=2Al(s)+3CO(g) ΔH1=+1344.1 kJ ·mol-1
2AlCl3(g)=2Al(s)+3Cl2(g) ΔH2=+1169.2 kJ ·mol-1
由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为___________ 。
④步骤Ⅲ经冷却至室温后,气体用足量的NaOH冷溶液吸收,生成的盐主要有3种,其化学式分别为___________ 。
⑤结合流程及相关数据分析,步骤Ⅴ中加入铝粉的目的是___________ 。
(1)氯化铝在水中形成具有净水作用的氢氧化铝胶体,其反应的离子方程式为
(2)工业上用铝土矿(主要成分为Al2O3,含有Fe2O3、SiO2等杂质)制取无水氯化铝的一种工艺流程示意如下:

已知:
| 物质 | SiCl4 | AlCl3 | FeCl3 | FeCl2 |
| 沸点/℃ | 57.6 | 180(升华) | 300(升华) | 1023 |
②步骤Ⅱ中若不通入氯气和氧气,则反应生成相对原子质量比硅大的单质是
③已知:
Al2O3(s)+3C(s)=2Al(s)+3CO(g) ΔH1=+1344.1 kJ ·mol-1
2AlCl3(g)=2Al(s)+3Cl2(g) ΔH2=+1169.2 kJ ·mol-1
由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为
④步骤Ⅲ经冷却至室温后,气体用足量的NaOH冷溶液吸收,生成的盐主要有3种,其化学式分别为
⑤结合流程及相关数据分析,步骤Ⅴ中加入铝粉的目的是
您最近一年使用:0次
2019-01-30更新
|
1815次组卷
|
5卷引用:2016届吉林省吉林大学附属中学高三上第一次摸底考试化学试卷
名校
2 . 以冶炼金属铝的废弃物铝灰为原料制取超细α—氧化铝,既能降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为A12O3(含少量杂质SiO2、FeO、Fe2O3),其制备流程如下:
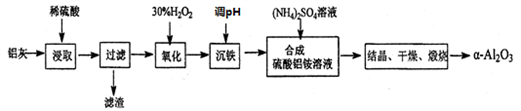
(1)用上图中“滤渣”和NaOH焙烧制备硅酸钠,可采用的装置为____ (填选项编号)。
(2)流程中加入H2O2有气体产生,原因是_______________________________ 。
(3)通过调节溶液的pH来“沉铁”,得到Fe(OH)3。已知:
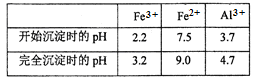
为保证产品的纯度,可以选用下列物质中的_______ 调节溶液pH(填字母),调节pH的范围为___________________________ 。
a.A12O3b.NaOH c.Al(OH)3d.Na2CO3
(4)煅烧硫酸铝铵晶体,发生的主要反应为:
4[NH4Al(SO4)2·12H2O] 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,
将产生的气体通过下图所示的装置:
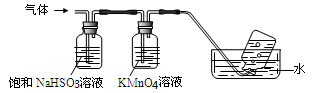
①集气瓶中收集到的气体是_____________________ (填化学式);
②装有KMnO4溶液洗气瓶的作用是__________________________________ ;
③选用一种常用化学试剂和稀硝酸检验硫酸铝铵,该试剂是______________ 。

(1)用上图中“滤渣”和NaOH焙烧制备硅酸钠,可采用的装置为

(2)流程中加入H2O2有气体产生,原因是
(3)通过调节溶液的pH来“沉铁”,得到Fe(OH)3。已知:

为保证产品的纯度,可以选用下列物质中的
a.A12O3b.NaOH c.Al(OH)3d.Na2CO3
(4)煅烧硫酸铝铵晶体,发生的主要反应为:
4[NH4Al(SO4)2·12H2O]
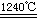 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过下图所示的装置:

①集气瓶中收集到的气体是
②装有KMnO4溶液洗气瓶的作用是
③选用一种常用化学试剂和稀硝酸检验硫酸铝铵,该试剂是
您最近一年使用:0次
2018-03-30更新
|
657次组卷
|
4卷引用:吉林省吉林市普通中学2018届高三高中毕业班第三次调研测试理综化学试题
名校
解题方法
3 . 铝土矿的主要成分是Al2O3,含有杂质SiO2、Fe2O3、MgO。工业上从铝土矿中提取Al可采用如图所示工艺流程:
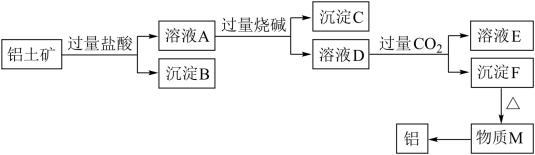
请回答下列问题:
(1)铝土矿加入盐酸后生成Al3+的离子方程式为_____________________________ 。
(2)沉淀B与烧碱反应的离子方程式为______________________________________ 。
(3)溶液D中通入过量CO2的离子方程式为_____________________________ 。
(4)“通入过量CO2”能否改用过量盐酸________ (填“能或否”),原因是_____________ 。
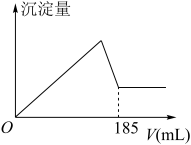
(5)向共含有0.05mol Al3+、Fe3+的溶液中滴入1mol/L NaOH 溶液,生成沉淀的量与加入NaOH 溶液的体积关系如图所示。 则溶液中Al3+的物质的量为_________ mol。

请回答下列问题:
(1)铝土矿加入盐酸后生成Al3+的离子方程式为
(2)沉淀B与烧碱反应的离子方程式为
(3)溶液D中通入过量CO2的离子方程式为
(4)“通入过量CO2”能否改用过量盐酸
(5)向共含有0.05mol Al3+、Fe3+的溶液中滴入1mol/L NaOH 溶液,生成沉淀的量与加入NaOH 溶液的体积关系如图所示。 则溶液中Al3+的物质的量为

您最近一年使用:0次
2018-01-24更新
|
408次组卷
|
2卷引用:吉林省柳河中学2017-2018学年高一上学期期末考试化学试题
解题方法
4 . 铝土矿的主要成分是Al2O3,还含有Fe2O3、SiO2等杂质。
Ⅰ.从铝土矿中提取氧化铝的流程如下图所示:
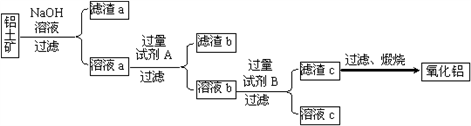
(1)试剂A是________ ;溶液b与试剂B反应的离子方程式为________ 。
(2)加入NaOH溶液进行的反应的离子方程式为_________ 、____________ 。
Ⅲ.新型陶瓷氮化铝可用以下两种方法制备
(3)①氧化铝高温还原法: Al2O3 + C + N2 AlN + CO(请配平)
AlN + CO(请配平)
②氯化铝与氨气高温合成法:AlCl3+NH3 AlN+3HCl
AlN+3HCl
(4)方法②比方法①在生产上更具优势。下列说法中,正确的是_______ 。
A.方法①中的 Al2O3、C、N2结构稳定,反应时破坏化学键需要消耗更多的能量
B.方法①中的Al2O3和C容易残留在氮化铝中
C.两种方法中氮化铝均为还原产物
Ⅰ.从铝土矿中提取氧化铝的流程如下图所示:

(1)试剂A是
(2)加入NaOH溶液进行的反应的离子方程式为
Ⅲ.新型陶瓷氮化铝可用以下两种方法制备
(3)①氧化铝高温还原法: Al2O3 + C + N2
 AlN + CO(请配平)
AlN + CO(请配平)②氯化铝与氨气高温合成法:AlCl3+NH3
 AlN+3HCl
AlN+3HCl(4)方法②比方法①在生产上更具优势。下列说法中,正确的是
A.方法①中的 Al2O3、C、N2结构稳定,反应时破坏化学键需要消耗更多的能量
B.方法①中的Al2O3和C容易残留在氮化铝中
C.两种方法中氮化铝均为还原产物
您最近一年使用:0次
真题
名校
5 . 用含有A1203、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O。,工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品。
(1)H2SO4溶解A12O3的离子方程式是_______________ 1;
(2)KMnO4-氧化Fe2+的离子方程式补充完整:______
 1MnO
1MnO +
+ Fe2++
Fe2++ ______=
______= Mn2++
Mn2++ Fe3++
Fe3++ ______
______
(3)已知:
生成氢氧化物沉淀的pH
注:金属离子的起始浓度为0.1mol·L-1
根据表中数据解释步骤Ⅱ的目的:._________________ ;
(4)已知:一定条件下,MnO 可与Mn2+反应生成MnO2,
可与Mn2+反应生成MnO2,
①向Ⅲ的沉淀中加入浓HCI并加热,能说明沉淀中存在MnO2的现象是_____________ ;
②Ⅳ中加入MnSO4的目的是:______________ ;
Ⅰ.向铝灰中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品。
(1)H2SO4溶解A12O3的离子方程式是
(2)KMnO4-氧化Fe2+的离子方程式补充完整:
 1MnO
1MnO +
+ Fe2++
Fe2++ ______=
______= Mn2++
Mn2++ Fe3++
Fe3++ ______
______(3)已知:
生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
根据表中数据解释步骤Ⅱ的目的:.
(4)已知:一定条件下,MnO
 可与Mn2+反应生成MnO2,
可与Mn2+反应生成MnO2,①向Ⅲ的沉淀中加入浓HCI并加热,能说明沉淀中存在MnO2的现象是
②Ⅳ中加入MnSO4的目的是:
您最近一年使用:0次
2019-01-30更新
|
1885次组卷
|
4卷引用:吉林省长春外国语学校2020-2021学年高一下学期期初考试化学试题
吉林省长春外国语学校2020-2021学年高一下学期期初考试化学试题2013年全国普通高等学校招生统一考试理科综合能力测试化学(北京卷)(已下线)2014届高考化学二轮复习四川配套训练 第10讲金属元素化合物练习卷河南省范县第一中学2021-2022学年高一上学期第三次月考检测化学试题
名校
解题方法
6 . 工业上用含有铝、铁、铜的废弃合金为主要原料制取硫酸铝溶液、硝酸铜晶体和无水氯化铁,其生产流程如图所示。

已知:
(1)在滤液A中直接加入硫酸后所得到的硫酸铝溶液中除含少量硫酸外,还一定含有的杂质是______ (填化学式)。
(2)请设计一个更合理的实验方案由滤液A制备纯净的硫酸铝溶液,写出相关的两个离子方程式______ 、______ 。
(3)将溶液C调节pH,pH的范围是______ 。
A.3.2≤ pH≤4.7 B.3.2≤ pH<4.7 C.3.2< pH<4.7 D.3.2< pH≤4.7
(4)要制得更纯的Cu(NO3)2·6H2O晶体,可进行的操作是______ (填操作名称)。
(5)操作Ⅱ的具体操作是______ 。

已知:
| 沉淀物 | Fe(OH)3 | Cu(OH)2 |
| 开始沉淀的pH | 1.9 | 4.7 |
| 沉淀完全的pH | 3.2 | 6.7 |
(1)在滤液A中直接加入硫酸后所得到的硫酸铝溶液中除含少量硫酸外,还一定含有的杂质是
(2)请设计一个更合理的实验方案由滤液A制备纯净的硫酸铝溶液,写出相关的两个离子方程式
(3)将溶液C调节pH,pH的范围是
A.3.2≤ pH≤4.7 B.3.2≤ pH<4.7 C.3.2< pH<4.7 D.3.2< pH≤4.7
(4)要制得更纯的Cu(NO3)2·6H2O晶体,可进行的操作是
(5)操作Ⅱ的具体操作是
您最近一年使用:0次
名校
解题方法
7 . 已知某混合物含有A单质与化合物B,在一定条件下可按图所示发生转化。

(1)沉淀H变沉淀I的化学方程式_____________________________ 。
(2)反应②的化学方程式_____________________________ 。
(3)溶液E中通入过量二氧化碳的离子方程式_______________________________ 。
(4)用化学反应方程式和简洁的语言解释图中溶液K制取化合物C的过程:__________ 。
(5)若要保存F溶液,应向溶液中加入两种物质为:_________ 、________ (填化学式)。

(1)沉淀H变沉淀I的化学方程式
(2)反应②的化学方程式
(3)溶液E中通入过量二氧化碳的离子方程式
(4)用化学反应方程式和简洁的语言解释图中溶液K制取化合物C的过程:
(5)若要保存F溶液,应向溶液中加入两种物质为:
您最近一年使用:0次
2017-10-23更新
|
225次组卷
|
2卷引用:吉林省实验中学2018届高三上学期第二次月考化学试题
11-12高三·江苏·阶段练习
名校
8 . 工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:

下列叙述正确的是

下列叙述正确的是
| A.按上述流程,试剂X可以是氢氧化钠溶液,也可以是盐酸 |
| B.反应①过滤后所得沉淀为氧化铁 |
| C.图中所有的转化反应都不是氧化还原反应 |
| D.反应②的离子方程式为2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
您最近一年使用:0次
2019-02-14更新
|
2899次组卷
|
23卷引用:【全国百强校】吉林省实验中学2017-2018学年高二下学期期末考试化学试题
【全国百强校】吉林省实验中学2017-2018学年高二下学期期末考试化学试题2018-2019学年人教版高中化学必修一:18-19 章末综合测评3 金属及其化合物(已下线)2012届江苏省苏北四市(徐、连、淮、宿)高三元月调研测试化学试卷(已下线)2013届江苏省灌南高级中学高三上学期期中考试化学试卷(已下线)2014高考名师推荐化学镁、铝及其化合物主要性质2015届四川省达州市大竹县文星中学高三3月月考化学试卷2016-2017学年天津市部分区高一上学期期末化学试卷辽宁省大连育明高级中学、本溪市高级中学2018届高三10月月考化学(理)试题人教版2017届高三单元精练检测三化学试题【全国百强校】甘肃省兰州市第一中学2018-2019学年高一上学期12月月考化学试题【全国百强校】福建省师范大学附属中学2018-2019学年高一上学期期末考试化学试题河北省辛集一中2018-2019学年高二下学期返校考试化学试题(已下线)2019年7月30日 《每日一题》2020年一轮复习-“铝三角”及其应用宁夏青铜峡市高级中学(吴忠中学分校)2020届高三上学期第二次月考化学试题河北省辛集中学2020届高三上学期期中考试化学试题陕西省渭南市澄城县城关中学2019-2020学年高二检测化学试题广西钦州市2019-2020学年高一下学期期末教学质量监测化学(理)试题(已下线)练习9 铁的多样性-2020-2021学年【补习教材·寒假作业】高一化学(鲁科版2019)福建省莆田第四中学2019-2020学年高一上学期期末考试化学试题江西省宜春市丰城市第九中学2021-2022学年高三上学期第三次月考化学试题河南省温县第一高级中学2021-2022学年高三上学期10月月考化学试题(已下线)专题突破卷03?金属及其化合物?-2024年高考化学一轮复习考点通关卷(新教材新高考)(已下线)专题04 金属材料及金属矿物的开发利用一题多问
11-12高三·全国·阶段练习
解题方法
9 . 工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:

下列叙述正确的是

下列叙述正确的是
| A.反应②的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3 |
| B.反应①、过滤后所得沉淀为氢氧化铁 |
| C.图中所示转化反应都不是氧化还原反应 |
| D.试剂X可以是氢氧化钠溶液,也可以是盐酸 |
您最近一年使用:0次
2019-01-30更新
|
427次组卷
|
5卷引用:吉林省洮南市第一中学2021届高三上学期期中考试化学试题
吉林省洮南市第一中学2021届高三上学期期中考试化学试题(已下线)2013届新课标高三配套月考(一)化学试卷(A卷)(已下线)2014届浙江省衢州一中高三上学期期中考试化学试卷河南省豫西名校2019-2020学年高一上学期第二次联考化学试题甘肃省临夏回族自治州永靖县移民中学2019-2020学年高三上学期期中考试化学试题
解题方法
10 . 工业上常以铬铁矿(主要成分为亚铬酸亚铁FeCr2O4,还含有Al2O3、SiO2等杂质)为主要原料生产红矾钠(Na2Cr2O7),某实验小组模拟其流程如下图所示:
(1)FeCr2O4中Cr的化合价为____________ ,步骤①焙烧时所用的仪器名称为_________ ;步骤①中生成Na2CrO4的化学方程式为________________________ 。
(2)步骤①煅烧反应极慢,需要升温至纯碱呈熔融状态,反应速率才加快,其主要原因为________ 。
(3)步骤②过滤时所用到的玻璃仪器有________________ ;
(4)涉骤③用硫酸将溶液的pH调至中性,所得滤渣2的主要成分是__________ 、__________ ;
(5)步骤④向滤液2加入硫酸酸化过程中,溶液由黄色变为橙色,反应的离子方程式为___________ 。
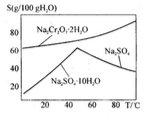
(6)下图是Na2Cr2O7·2H2O和Na2SO4的溶解度曲线,步骤④中获得副产品Na2SO4的实验操作方法为____________________ 。

(1)FeCr2O4中Cr的化合价为
(2)步骤①煅烧反应极慢,需要升温至纯碱呈熔融状态,反应速率才加快,其主要原因为
(3)步骤②过滤时所用到的玻璃仪器有
(4)涉骤③用硫酸将溶液的pH调至中性,所得滤渣2的主要成分是
(5)步骤④向滤液2加入硫酸酸化过程中,溶液由黄色变为橙色,反应的离子方程式为
(6)下图是Na2Cr2O7·2H2O和Na2SO4的溶解度曲线,步骤④中获得副产品Na2SO4的实验操作方法为
您最近一年使用:0次



