1 . 已知A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀,W溶液中加入KSCN出现红色。
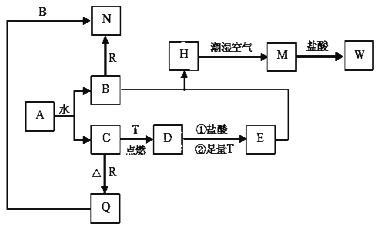
(1)写出下列物质的化学式:A______________ ;D________________ 。
(2)按要求写出下列反应的化学方程式:
H在潮湿空气中变成M的实验现象为___________________ ,
该过程用化学方程式可表示为________________________ 。
(3)B和R反应生成N的离子方程式:________________ 。

(1)写出下列物质的化学式:A
(2)按要求写出下列反应的化学方程式:
H在潮湿空气中变成M的实验现象为
该过程用化学方程式可表示为
(3)B和R反应生成N的离子方程式:
您最近一年使用:0次
2 . 铋(Bi)的无毒与不致癌性有很多特殊用途,其化合物广泛应用于电子、医药等领域。由辉铋矿(主要成分为Bi2S3,含杂质PbO2等)制备Bi2O3的工艺如下:
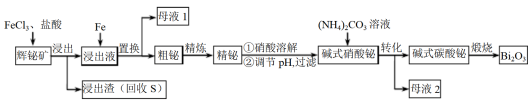
回答下列问题:
(1)Bi位于元素周期表第六周期,与N、P同族,Bi的原子结构示意图为________ 。
(2)“浸出”时Bi2S3与FeCl3溶液反应的化学方程式为________ ,反应液必须保持强酸性,否则铋元素会以BiOCl(碱式氯化铋)形式混入浸出渣使产率降低,原因是________ (用离子方程式表示)。

(3)“置换”时生成单质铋的离子方程式为________ 。“母液1”中通入气体X后可循环利用,气体X的化学式为________ 。
(4)“粗铋”中含有的杂质主要是Pb,通过熔盐电解精炼可达到除杂的目的,其装置示意图如右。电解后,阳极底部留下的为精铋。写出电极反应式:阳极________ ;阴极________ 。
(5)碱式硝酸铋直接灼烧也能得到Bi2O3,上述工艺中转化为碱式碳酸铋再灼烧,除了能改良产品性状,另一优点是________ 。“母液2”中可回收的主要物质是________ 。

回答下列问题:
(1)Bi位于元素周期表第六周期,与N、P同族,Bi的原子结构示意图为
(2)“浸出”时Bi2S3与FeCl3溶液反应的化学方程式为

(3)“置换”时生成单质铋的离子方程式为
(4)“粗铋”中含有的杂质主要是Pb,通过熔盐电解精炼可达到除杂的目的,其装置示意图如右。电解后,阳极底部留下的为精铋。写出电极反应式:阳极
(5)碱式硝酸铋直接灼烧也能得到Bi2O3,上述工艺中转化为碱式碳酸铋再灼烧,除了能改良产品性状,另一优点是
您最近一年使用:0次
2017-05-01更新
|
957次组卷
|
2卷引用:广东省广州市2017届高三4月综合测试(二)理综化学试题
3 . FeCl3的用途广泛。
(1)实验室利用FeCl3制备Fe(OH)3胶体:
①Fe(OH)3胶体制备反应的化学方程式为___________________________________________ 。
②利用所制得的Fe(OH)3胶体进行实验:将其装入U形管内,用石墨作电极,通电一段时间后发现
___________ 极区附近的红褐色逐渐变深,这表明_________________________________
③向Fe(OH)3胶体中加H2SO4溶液,产生的现象是_______________________________ 。
(2)FeCl3溶液常用于腐蚀铜印刷电路板,该反应的离子方程式为_________________________ 。
(3)FeCl3常用于净水,用离子方程式表示其原理____________________________________ 。
(4)FeCl3溶液中若混有FeCl2,检验FeCl2的试剂为________________________ 。
(5)将FeCl3溶液蒸干并灼烧得到的固体成分为__________________ 。
(6)已知Fe(OH)3的Ksp=8×10-38,某溶液中c(FeCl3)=0.05mol/L,如果要使Fe(OH)3沉淀完全,pH至少为______________________ 。
(溶液中离子浓度小于10-5mol/L认为沉淀已完全,已知lg2=0.3 lg5=0.7)
(1)实验室利用FeCl3制备Fe(OH)3胶体:
①Fe(OH)3胶体制备反应的化学方程式为
②利用所制得的Fe(OH)3胶体进行实验:将其装入U形管内,用石墨作电极,通电一段时间后发现
③向Fe(OH)3胶体中加H2SO4溶液,产生的现象是
(2)FeCl3溶液常用于腐蚀铜印刷电路板,该反应的离子方程式为
(3)FeCl3常用于净水,用离子方程式表示其原理
(4)FeCl3溶液中若混有FeCl2,检验FeCl2的试剂为
(5)将FeCl3溶液蒸干并灼烧得到的固体成分为
(6)已知Fe(OH)3的Ksp=8×10-38,某溶液中c(FeCl3)=0.05mol/L,如果要使Fe(OH)3沉淀完全,pH至少为
(溶液中离子浓度小于10-5mol/L认为沉淀已完全,已知lg2=0.3 lg5=0.7)
您最近一年使用:0次
名校
4 . 氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗品并精制的流程。
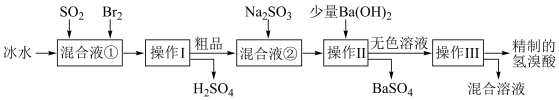
根据上述流程回答下列问题:
(1)混合液①中发生反应的化学方程式为________________________ 。
(2)溴与氯结合形成BrCl,BrCl的性质与卤素单质相似。则BrCl与水发生反应的化学方程式为___________________ 。
(3)加入Ba(OH)2反应的离子方程式为______________ 操作Ⅱ的名称是______ 。操作Ⅲ一般适用于分离______ 混合物。(选填编号)
a.固体和液体 b.固体和固体 c.互不相溶的液体 d.互溶的液体
(4)纯净的氢溴酸应为无色液体,但实际工业生产中制得的氢溴酸(工业氢溴酸)常带有淡淡的黄色。于是甲、乙两同学设计了简单实验加以探究:甲同学假设工业氢溴酸呈淡黄色是因为含有F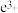 ,则用于证明该假设所用的试剂为
,则用于证明该假设所用的试剂为______ ,反应的离子方程式为_____________ 。

根据上述流程回答下列问题:
(1)混合液①中发生反应的化学方程式为
(2)溴与氯结合形成BrCl,BrCl的性质与卤素单质相似。则BrCl与水发生反应的化学方程式为
(3)加入Ba(OH)2反应的离子方程式为
a.固体和液体 b.固体和固体 c.互不相溶的液体 d.互溶的液体
(4)纯净的氢溴酸应为无色液体,但实际工业生产中制得的氢溴酸(工业氢溴酸)常带有淡淡的黄色。于是甲、乙两同学设计了简单实验加以探究:甲同学假设工业氢溴酸呈淡黄色是因为含有F
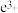 ,则用于证明该假设所用的试剂为
,则用于证明该假设所用的试剂为
您最近一年使用:0次
解题方法
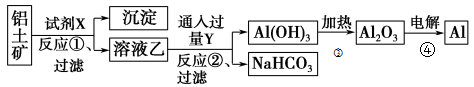
5 . 工业上用铝土矿(主要成分为Al2O3,只含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
回答下列问题:
(1)实验室进行过滤用到的玻璃仪器有烧杯、玻璃棒、_______________ 。
(2)上述反应是否都是氧化还原反应_________ (填“是”或“否”);写出反应①的化学方程式________________________ 。
(3)反应①后过滤的沉淀为____________ ,简述确定此物质中金属元素及其价态的操作过程________ 。
(4)利用铝制得的镁铝合金用途很广泛,比如用作手机机身,某课外活动小组欲对某一品牌手机机身的铝镁合金进行研究,测定其中铝的质量分数。
I.他们利用盐酸、氢氧化钠溶液设计下列实验方案:
方案:铝镁合金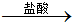 溶液
溶液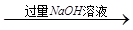
 称量灼烧产物的质量。
称量灼烧产物的质量。
用该方案进行实验时,除了称量灼烧产物的质量外,还需称量的是_______________ 。
II.拓展研究:在向铝镁合金溶于盐酸后的溶液中加入过量NaOH溶液时,生成沉淀的质量与加入NaOH溶液体积的关系可用数轴关系表示:
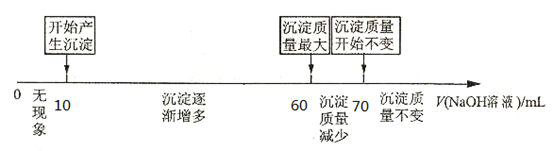
当加入60~70ml氢氧化钠溶液时,请写出发生的离子方程式___________________________ 。
你判断,根据上图数轴中的数据能否求出合金中铝的质量分数?_________ (选填“能”或“不能”)。
下列①②两题选一题作答。(多答不给分)
①若不能求出合金中铝的质量分数,请说明理由 。
②若能求出合金中铝的质量分数,则铝的质量分数为______________ 。

回答下列问题:
(1)实验室进行过滤用到的玻璃仪器有烧杯、玻璃棒、
(2)上述反应是否都是氧化还原反应
(3)反应①后过滤的沉淀为
(4)利用铝制得的镁铝合金用途很广泛,比如用作手机机身,某课外活动小组欲对某一品牌手机机身的铝镁合金进行研究,测定其中铝的质量分数。
I.他们利用盐酸、氢氧化钠溶液设计下列实验方案:
方案:铝镁合金
 溶液
溶液
 称量灼烧产物的质量。
称量灼烧产物的质量。用该方案进行实验时,除了称量灼烧产物的质量外,还需称量的是
II.拓展研究:在向铝镁合金溶于盐酸后的溶液中加入过量NaOH溶液时,生成沉淀的质量与加入NaOH溶液体积的关系可用数轴关系表示:

当加入60~70ml氢氧化钠溶液时,请写出发生的离子方程式
你判断,根据上图数轴中的数据能否求出合金中铝的质量分数?
下列①②两题选一题作答。(多答不给分)
①若不能求出合金中铝的质量分数,请说明理由 。
②若能求出合金中铝的质量分数,则铝的质量分数为
您最近一年使用:0次
6 . 铁是目前用途最广,用量最大的金属。运用所学知识,回答下列问题。
(1)鉴别Fe(OH)3胶体和FeCl3溶液的方法是_____________________ 。
(2)电子工业用FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:________________________ 。
(3)工程师欲从制造印刷电路板的废水中回收铜,并获得FeCl3溶液,设计如下方案:

①滤渣C的化学式为____________ ;
②试剂F宜选用______ (填选项序号),通入F的目的是_______________ ;
A.酸性KMnO4溶液 B.氯水 C.溴水
(4)某研究性学习小组为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
①取少量待测溶液,滴入KSCN溶液呈红色,则待测液中含有的金属阳离子是________ ;②溶液组成的测定:取30.0mL待测溶液,加入足量的AgNO3溶液,得25.83g白色沉淀。则溶液中c(Cl-)=__________ 。
(1)鉴别Fe(OH)3胶体和FeCl3溶液的方法是
(2)电子工业用FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:
(3)工程师欲从制造印刷电路板的废水中回收铜,并获得FeCl3溶液,设计如下方案:

①滤渣C的化学式为
②试剂F宜选用
A.酸性KMnO4溶液 B.氯水 C.溴水
(4)某研究性学习小组为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
①取少量待测溶液,滴入KSCN溶液呈红色,则待测液中含有的金属阳离子是
您最近一年使用:0次
2016-12-09更新
|
218次组卷
|
2卷引用:2014-2015福建省八县一中高一上学期期末考试化学试卷
7 . 下列叙述错误的是
| A.烧碱和消石灰都是碱 |
| B.金属与盐溶液的反应都是置换反应 |
| C.钢是用量最大、用途最广的合金 |
| D.金属钾、钠、及钾钠合金的熔点关系:钠>钾>钾钠合金 |
您最近一年使用:0次
8 . FeCl3是一种用途比较广泛的铁盐。
(1)印刷电路板是由高分子材料和铜箔复合而成的,刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,生成CuCl2和FeCl2,请写出该反应的离子方程式:___________________ 。
(2)FeCl3在天然水中可生成氢氧化铁胶体,其沉降水中悬浮物的速率高于铝盐,是城市污水和工业废水处理的高效絮凝剂.实验中制取氢氧化铁胶体的方法是_______ (填序号)。
①向FeCl3溶液中加入足量的NaOH溶液;
②将饱和的FeCl3溶液滴入沸水中,并继续煮沸至生成红褐色液体;
③将饱和的FeCl3溶液滴入沸水中,并继续煮沸至生成红褐色沉淀;
含有Fe3+的盐溶液遇到___________ 溶液时变成红色,我们可以利用这一反应检验Fe3+的存在。
(3)FeCl3可使湿润的淀粉碘化钾试纸变蓝,化学方程式为2FeCl3+2KI=2FeCl2+I2+2KCl,用双线桥法标出该反应中电子转移的方向和数目__________________________
将一定量的CCl4加入上述反应后的溶液中,振荡、静置后会发现下层液体为__________ 色,再将混合液倒入_________ (填仪器名称)中,可将两层液体分离。
(1)印刷电路板是由高分子材料和铜箔复合而成的,刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,生成CuCl2和FeCl2,请写出该反应的离子方程式:
(2)FeCl3在天然水中可生成氢氧化铁胶体,其沉降水中悬浮物的速率高于铝盐,是城市污水和工业废水处理的高效絮凝剂.实验中制取氢氧化铁胶体的方法是
①向FeCl3溶液中加入足量的NaOH溶液;
②将饱和的FeCl3溶液滴入沸水中,并继续煮沸至生成红褐色液体;
③将饱和的FeCl3溶液滴入沸水中,并继续煮沸至生成红褐色沉淀;
含有Fe3+的盐溶液遇到
(3)FeCl3可使湿润的淀粉碘化钾试纸变蓝,化学方程式为2FeCl3+2KI=2FeCl2+I2+2KCl,用双线桥法标出该反应中电子转移的方向和数目
将一定量的CCl4加入上述反应后的溶液中,振荡、静置后会发现下层液体为
您最近一年使用:0次
9 . 已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素。在一定条件下它们之间的相互转化关系如图所示(部分反应中的H2O已略去)。

请回答下列问题:
(1)若A可用于自来水消毒,D是生产、生活中用量最大、用途最广的金属单质,则反应②的离子方程式是________________________ 。
(2)若A是一种碱性气体,常用作制冷剂,B是汽车尾气之一,遇空气会变色,则反应①的化学方程式为________________________________ 。
(3)若A、C、D都是常见气体,C是导致酸雨的主要气体,则反应③的化学方程式为______________ 。某同学将搜集到的一定量的酸雨保存在密闭容器中,每隔一定时间测酸雨的pH,发现在起始一段时间内,酸雨的pH呈减小趋势,用离子方程式解释原因:________________ 。

请回答下列问题:
(1)若A可用于自来水消毒,D是生产、生活中用量最大、用途最广的金属单质,则反应②的离子方程式是
(2)若A是一种碱性气体,常用作制冷剂,B是汽车尾气之一,遇空气会变色,则反应①的化学方程式为
(3)若A、C、D都是常见气体,C是导致酸雨的主要气体,则反应③的化学方程式为
您最近一年使用:0次
解题方法
10 . 硫酸亚铁是一种重要的化工产品,在工业上有重要的用途。学生探究烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备绿矾(FeSO4·7H2O式量为278),并进一步计算产品的纯度,工艺流程如下所示:
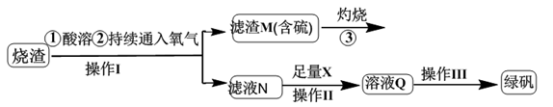
(1)烧渣在进行酸溶时用到的酸为___________ 。
(2)过程灼烧时产生的气体通入下列溶液中,溶液不会褪色的是
(3)X是_______ ,此时滤液N中发生反应的离子方程式为____________ 。检验溶液Q中含有的金属阳离子的实验方法是__________________ 。
(4)操作III的操作步骤为蒸发浓缩、_________ 、过滤(填操作名称)、________ 、干燥。
(5)测定绿矾产品中Fe2+含量的实验步骤:
a.称取6.0g产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液体积为40.00mL。(滴定时发生反应的离子方程式为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O)。
①标准液应盛装在________ 滴定管中(填“酸式”或“碱式”)
计算上述产品中FeSO4·7H2O的质量分数为_________ ;
②若在a步操作中,进行定容时仰视刻度线定容,则会使测得的产品中FeSO4·7H2O的质量分数______ 。(填“偏大”“偏小”或“无影响”)。

(1)烧渣在进行酸溶时用到的酸为
(2)过程灼烧时产生的气体通入下列溶液中,溶液不会褪色的是
| A.品红溶液 | B.紫色石蕊溶液 | C.酸性KMnO4溶液 | D.红色的酚酞试液 |
(3)X是
(4)操作III的操作步骤为蒸发浓缩、
(5)测定绿矾产品中Fe2+含量的实验步骤:
a.称取6.0g产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液体积为40.00mL。(滴定时发生反应的离子方程式为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O)。
①标准液应盛装在
计算上述产品中FeSO4·7H2O的质量分数为
②若在a步操作中,进行定容时仰视刻度线定容,则会使测得的产品中FeSO4·7H2O的质量分数
您最近一年使用:0次
2016-12-09更新
|
339次组卷
|
2卷引用:2016届山东省寿光现代中学高三下学期开学检测化学试卷



