名校
解题方法
1 . 硫代硫酸钠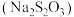 俗称大苏打,广泛用于定影、媒染等领域,临床上用于氰化物解毒。实验室中以
俗称大苏打,广泛用于定影、媒染等领域,临床上用于氰化物解毒。实验室中以 和
和 为主要原料制备
为主要原料制备 。回答下列问题:
。回答下列问题:
(1) 能解毒氰化物的原理为
能解毒氰化物的原理为 。为检验该转化生成了
。为检验该转化生成了 ,最佳方法是取少量反应液,先向其中加入足量的盐酸,再加入
,最佳方法是取少量反应液,先向其中加入足量的盐酸,再加入______ (填化学式)溶液,观察到的现象是______ 。
(2)工业级硫化钠中混有杂质(重金属硫化物、煤粉等),需进行纯化。纯化实验装置如图1,保持水浴沸腾,回流一段时间后,过滤,将滤液冷却至室温后析出高纯硫化钠。
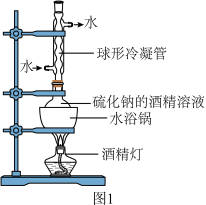
将工业硫化钠溶于酒精并加热时,采取水浴加热的优点是______ 。
(3)利用图2装置制备 。
。
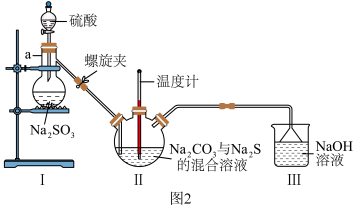
①仪器a的名称为______ 。
②实验开始时,打开螺旋夹并适当调节螺旋夹,一方面可以防止倒吸,另一方面可以______ 。
③装置Ⅱ处发生反应的总化学方程式为______ ,停止通入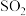 前要控制装置Ⅱ中溶液pH约为7而不能小于7的理由是
前要控制装置Ⅱ中溶液pH约为7而不能小于7的理由是______ 。
④装置Ⅲ的作用是______ 。
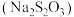 俗称大苏打,广泛用于定影、媒染等领域,临床上用于氰化物解毒。实验室中以
俗称大苏打,广泛用于定影、媒染等领域,临床上用于氰化物解毒。实验室中以 和
和 为主要原料制备
为主要原料制备 。回答下列问题:
。回答下列问题:(1)
 能解毒氰化物的原理为
能解毒氰化物的原理为 。为检验该转化生成了
。为检验该转化生成了 ,最佳方法是取少量反应液,先向其中加入足量的盐酸,再加入
,最佳方法是取少量反应液,先向其中加入足量的盐酸,再加入(2)工业级硫化钠中混有杂质(重金属硫化物、煤粉等),需进行纯化。纯化实验装置如图1,保持水浴沸腾,回流一段时间后,过滤,将滤液冷却至室温后析出高纯硫化钠。

将工业硫化钠溶于酒精并加热时,采取水浴加热的优点是
(3)利用图2装置制备
 。
。
①仪器a的名称为
②实验开始时,打开螺旋夹并适当调节螺旋夹,一方面可以防止倒吸,另一方面可以
③装置Ⅱ处发生反应的总化学方程式为
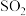 前要控制装置Ⅱ中溶液pH约为7而不能小于7的理由是
前要控制装置Ⅱ中溶液pH约为7而不能小于7的理由是④装置Ⅲ的作用是
您最近一年使用:0次
2 . 我国锰矿资源主要为贫碳酸锰矿(主要成分为 ,还含有少量
,还含有少量 、
、 、
、 、
、 、
、 、
、 ),利用贫碳酸锰矿制取
),利用贫碳酸锰矿制取 的流程如图所示,回答下列问题。
的流程如图所示,回答下列问题。 ,
, 。
。
(1) 中锰元素的价态有+2价和+3价,则下列表示
中锰元素的价态有+2价和+3价,则下列表示 组成的式子正确的是___________(填标号)。
组成的式子正确的是___________(填标号)。
(2)“滤渣1”的主要成分是___________ (填化学式)。
(3)“氧化”的目的是将 转化为
转化为 ,写出发生反应的离子方程式
,写出发生反应的离子方程式___________ ,检测 是否完全氧化的试剂是
是否完全氧化的试剂是___________ (写试剂名称)。
(4)“除钙镁”后的滤液中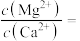
___________ 。
(5)“碳化”过程需要加热,但温度不能太高,试分析温度不能太高的原因___________ 。
(6)“焙烧”过程中随温度不同生成的锰的氧化物也不同。图中A点对应的氧化物是___________ ,为了获得 ,需要加热到
,需要加热到___________  (已知:A、B、C三点对应的物质均为纯净氧化物)。
(已知:A、B、C三点对应的物质均为纯净氧化物)。
 ,还含有少量
,还含有少量 、
、 、
、 、
、 、
、 、
、 ),利用贫碳酸锰矿制取
),利用贫碳酸锰矿制取 的流程如图所示,回答下列问题。
的流程如图所示,回答下列问题。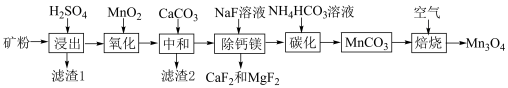
 ,
, 。
。(1)
 中锰元素的价态有+2价和+3价,则下列表示
中锰元素的价态有+2价和+3价,则下列表示 组成的式子正确的是___________(填标号)。
组成的式子正确的是___________(填标号)。A.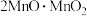 | B.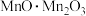 | C.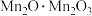 | D. |
(2)“滤渣1”的主要成分是
(3)“氧化”的目的是将
 转化为
转化为 ,写出发生反应的离子方程式
,写出发生反应的离子方程式 是否完全氧化的试剂是
是否完全氧化的试剂是(4)“除钙镁”后的滤液中
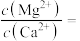
(5)“碳化”过程需要加热,但温度不能太高,试分析温度不能太高的原因
(6)“焙烧”过程中随温度不同生成的锰的氧化物也不同。图中A点对应的氧化物是
 ,需要加热到
,需要加热到 (已知:A、B、C三点对应的物质均为纯净氧化物)。
(已知:A、B、C三点对应的物质均为纯净氧化物)。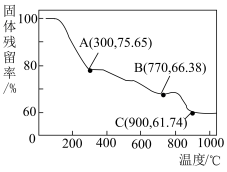
您最近一年使用:0次
2024-03-08更新
|
238次组卷
|
4卷引用:陕西省延安市黄龙县中学2023-2024学年高三下学期开学考试理综试卷-高中化学
陕西省延安市黄龙县中学2023-2024学年高三下学期开学考试理综试卷-高中化学陕西省西安工业大学附属中学2023-2024学年高三下学期3月月考理科综合试题-高中化学甘肃省张掖市某重点校2023-2024学年高三下学期模拟考化学试题(已下线)大题预测卷(黑龙江、吉林专用)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)
名校
3 . 铁及其化合物在生产,生活中有着重要作用。按要求回答下列问题
(1)铁及其化合物的价类分布及转化关系如图所示:
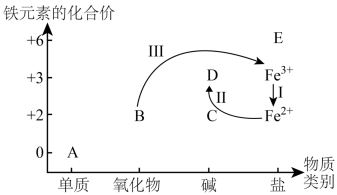
①氯化铁溶液常用于蚀刻铜制电路板,实现了反应Ⅰ的转化,写出反应的离子方程式:_____
②往氯化亚铁溶液中滴加氢氧化钠溶液的过程可实现E→C→D的转化,可观察到的现象为_____
③为实现反应Ⅲ的转化,可选择的试剂为稀硝酸,被还原的N和未被还原的N的物质的量之比为_____ 。
(2)探究某铁盐X的组成与性质(忽略过程中氧气的参与):
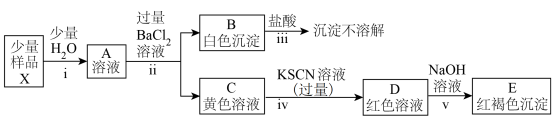
①由步骤ⅱ、ⅲ及其现象可推知该铁盐X中含有的阴离子为_____ (填离子符号)。
②根据步骤ⅳ、ⅴ及其现象分析,体系中与 结合能力最强的离子是
结合能力最强的离子是_____ (填“ ”或“
”或“ ”)。
”)。
(3)高铁酸钾( )是一种新型污水处理剂。可以次氯酸钠和氯化铁为原料,在碱性溶液中反应生成高铁酸钠,然后加入氢氧化钾,将高铁酸钠转化成高铁酸钾。
)是一种新型污水处理剂。可以次氯酸钠和氯化铁为原料,在碱性溶液中反应生成高铁酸钠,然后加入氢氧化钾,将高铁酸钠转化成高铁酸钾。
①写出生成高铁酸钠的反应的离子方程式:_____
②若反应过程中转移了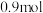 电子,则还原产物的物质的量为
电子,则还原产物的物质的量为_____ mol。
③低温下,向高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾( ),由此可说明溶解度:
),由此可说明溶解度: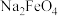
_____ (填“>”“<”或“=”) 。
。
(1)铁及其化合物的价类分布及转化关系如图所示:

①氯化铁溶液常用于蚀刻铜制电路板,实现了反应Ⅰ的转化,写出反应的离子方程式:
②往氯化亚铁溶液中滴加氢氧化钠溶液的过程可实现E→C→D的转化,可观察到的现象为
③为实现反应Ⅲ的转化,可选择的试剂为稀硝酸,被还原的N和未被还原的N的物质的量之比为
(2)探究某铁盐X的组成与性质(忽略过程中氧气的参与):

①由步骤ⅱ、ⅲ及其现象可推知该铁盐X中含有的阴离子为
②根据步骤ⅳ、ⅴ及其现象分析,体系中与
 结合能力最强的离子是
结合能力最强的离子是 ”或“
”或“ ”)。
”)。(3)高铁酸钾(
 )是一种新型污水处理剂。可以次氯酸钠和氯化铁为原料,在碱性溶液中反应生成高铁酸钠,然后加入氢氧化钾,将高铁酸钠转化成高铁酸钾。
)是一种新型污水处理剂。可以次氯酸钠和氯化铁为原料,在碱性溶液中反应生成高铁酸钠,然后加入氢氧化钾,将高铁酸钠转化成高铁酸钾。①写出生成高铁酸钠的反应的离子方程式:
②若反应过程中转移了
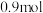 电子,则还原产物的物质的量为
电子,则还原产物的物质的量为③低温下,向高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(
 ),由此可说明溶解度:
),由此可说明溶解度: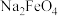
 。
。
您最近一年使用:0次
2023-12-29更新
|
231次组卷
|
3卷引用:2024届陕西省西安市长安区教育片区高三上学期模拟考试理科综合试卷
4 . 磷酸亚铁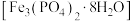 是生产锂电池的原料,能溶于强酸,不溶于水。实验室可以绿矾
是生产锂电池的原料,能溶于强酸,不溶于水。实验室可以绿矾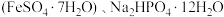 及
及 为原料制备磷酸亚铁,主要反应为
为原料制备磷酸亚铁,主要反应为 。
。
I.配制 溶液
溶液
(1)实验室常用绿矾配制 溶液,配制过程中需要用到的玻璃仪器除烧杯、量筒、容量瓶外,还有
溶液,配制过程中需要用到的玻璃仪器除烧杯、量筒、容量瓶外,还有___________ 。若实验需要配制。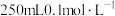 的
的 溶液,则需要称取的绿矾的质量为
溶液,则需要称取的绿矾的质量为___________ g。
Ⅱ.提纯制备晶体
(2)利用工业品十二水合磷酸氢二钠(含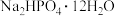 、重金属盐及有色杂质等)提纯得到
、重金属盐及有色杂质等)提纯得到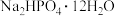 晶体。已知:
晶体。已知: 溶液
溶液 在
在 ,重金属硫化物不溶于水。请将实验步骤补充完整:
,重金属硫化物不溶于水。请将实验步骤补充完整:
将工业品溶于热水;
①___________ ;
②___________ ;
③___________ ;
冷却结晶,过滤、洗涤及干燥。
(实验中可选用的试剂: 溶液、
溶液、 溶液、
溶液、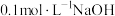 溶液、活性炭)
溶液、活性炭)
Ⅲ.合成磷酸亚铁及杂质的检验
(3)在三颈烧瓶中先加入抗坏血酸(维生素C)稀溶液作底液,然后向烧瓶中滴入 与
与 的混合溶液至
的混合溶液至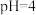 时,再滴入
时,再滴入 溶液,最终维持
溶液,最终维持 。
。
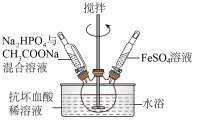
①用抗坏血酸稀溶液作底液的作用是___________ 。
②检验产品中是否混有 或
或 杂质的操作方法是
杂质的操作方法是___________ 。
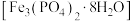 是生产锂电池的原料,能溶于强酸,不溶于水。实验室可以绿矾
是生产锂电池的原料,能溶于强酸,不溶于水。实验室可以绿矾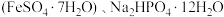 及
及 为原料制备磷酸亚铁,主要反应为
为原料制备磷酸亚铁,主要反应为 。
。I.配制
 溶液
溶液(1)实验室常用绿矾配制
 溶液,配制过程中需要用到的玻璃仪器除烧杯、量筒、容量瓶外,还有
溶液,配制过程中需要用到的玻璃仪器除烧杯、量筒、容量瓶外,还有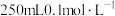 的
的 溶液,则需要称取的绿矾的质量为
溶液,则需要称取的绿矾的质量为Ⅱ.提纯制备晶体
(2)利用工业品十二水合磷酸氢二钠(含
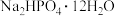 、重金属盐及有色杂质等)提纯得到
、重金属盐及有色杂质等)提纯得到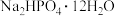 晶体。已知:
晶体。已知: 溶液
溶液 在
在 ,重金属硫化物不溶于水。请将实验步骤补充完整:
,重金属硫化物不溶于水。请将实验步骤补充完整:将工业品溶于热水;
①
②
③
冷却结晶,过滤、洗涤及干燥。
(实验中可选用的试剂:
 溶液、
溶液、 溶液、
溶液、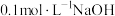 溶液、活性炭)
溶液、活性炭)Ⅲ.合成磷酸亚铁及杂质的检验
(3)在三颈烧瓶中先加入抗坏血酸(维生素C)稀溶液作底液,然后向烧瓶中滴入
 与
与 的混合溶液至
的混合溶液至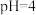 时,再滴入
时,再滴入 溶液,最终维持
溶液,最终维持 。
。
①用抗坏血酸稀溶液作底液的作用是
②检验产品中是否混有
 或
或 杂质的操作方法是
杂质的操作方法是
您最近一年使用:0次
2023-12-01更新
|
521次组卷
|
4卷引用:陕西省西安市2023-2024学年高三上学期12月联考化学试卷
陕西省西安市2023-2024学年高三上学期12月联考化学试卷2024届河南省新乡市高三第一次模拟考试理科综合试题(已下线)专题09 化学实验综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)河北省邯郸市六校联考2023-2024学年高二上学期11月月考化学试题
名校
5 . 用硫铁矿(主要成分是FeS2, 含少量Al2O3、 SiO2和Fe3O4)为原料, 制备磷酸亚铁锂(LiFePO4),流程如下图所示:

已知几种金属离子沉淀的pH如下表所示:
回答下列问题:
(1)焙烧的目的是___________ 。
(2)流程中从“焙烧”到“氧化”要经过一系列步骤,从下列步骤中选择正确的步骤并合理排序___________→___________→___________→___________。_________

(3)“试剂R”最好选择___________ 。
(4)流程中“高温煅烧”时,反应的化学方程式为___________ 。
(5)检验产品中是否混有Fe(OH)3或FePO4杂质的实验操作是___________ 。
(6)用0.100 mol·L-1酸性K2Cr2O7标准溶液滴定Fe2+,测定产品LiFePO4的纯度。
①从下列选项中选择合理的仪器和操作,补全如下步骤[“___________”上填写一件最关键的仪器,“___________ )”内填写一种操作,均用字母表示]。__________
用___________(称量LiFePO4样品8.000 g)→用烧杯(___________ ) →用___________(___________ )→用___________(量取25.00 mL Fe2+溶液)→滴加2~3滴二苯胺磺酸钠作指示剂→用滴定管(盛装K2Cr2O7标准溶液,滴定至溶液由浅绿色变为蓝紫色)→(重复滴定3次,平均消耗K2Cr2O7溶液20.00 mL)。
仪器: a.量筒; b.托盘天平; c. 100 mL容量瓶; d.分析天平; e.试剂瓶; f.移液管。
操作: g.配制一定体积的 Fe2+溶液; h.加稀硫酸溶解样品; i.装瓶贴标签。
②产品的纯度为___________ 。

已知几种金属离子沉淀的pH如下表所示:
| 金属氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀的pH | 2.3 | 7.5 | 4.0 |
| 完全沉淀的pH | 4.1 | 9.7 | 5.2 |
(1)焙烧的目的是
(2)流程中从“焙烧”到“氧化”要经过一系列步骤,从下列步骤中选择正确的步骤并合理排序___________→___________→___________→___________。

(3)“试剂R”最好选择
(4)流程中“高温煅烧”时,反应的化学方程式为
(5)检验产品中是否混有Fe(OH)3或FePO4杂质的实验操作是
(6)用0.100 mol·L-1酸性K2Cr2O7标准溶液滴定Fe2+,测定产品LiFePO4的纯度。
①从下列选项中选择合理的仪器和操作,补全如下步骤[“___________”上填写一件最关键的仪器,“___________ )”内填写一种操作,均用字母表示]。
用___________(称量LiFePO4样品8.000 g)→用烧杯(___________ ) →用___________(___________ )→用___________(量取25.00 mL Fe2+溶液)→滴加2~3滴二苯胺磺酸钠作指示剂→用滴定管(盛装K2Cr2O7标准溶液,滴定至溶液由浅绿色变为蓝紫色)→(重复滴定3次,平均消耗K2Cr2O7溶液20.00 mL)。
仪器: a.量筒; b.托盘天平; c. 100 mL容量瓶; d.分析天平; e.试剂瓶; f.移液管。
操作: g.配制一定体积的 Fe2+溶液; h.加稀硫酸溶解样品; i.装瓶贴标签。
②产品的纯度为
您最近一年使用:0次
解题方法
6 . 废旧锌锰电池中的黑锰粉含有MnO2、MnO(OH)、NH4Cl和少量ZnCl2、Fe2O3及炭黑等,为了保护环境、充分利用锰资源,通过如下流程制备MnSO4。

回答下列问题:
(1)Mn的原子结构示意图为___________ 。
(2)“滤液a”的主要成分为NH4Cl,另外还含有少量ZnCl2等。
①用离子方程式表示“滤液a”呈酸性的原因___________ 。
②根据下图所示的溶解度曲线,将“滤液a”蒸发结晶、___________ 、洗涤、干燥,得NH4Cl固体。

(3)“焙炒”的目的是除炭、氧化MnO(OH)等。空气中O2氧化MnO(OH)的化学方程式为___________ 。
(4)探究“酸浸”中MnO2溶解的适宜操作。
实验I.向MnO2中加入H2O2溶液,产生大量气泡;再加入稀H2SO4,固体未明显溶解。
实验II.向MnO2中加入稀H2SO4,固体未溶解;再加入H2O2溶液,产生大量气泡,固体完全溶解。
①实验I中MnO2的作用是___________ ,实验II中H2O2的作用是___________ 。
②由实验可知,“酸浸”溶解MnO2时加入试剂的顺序是___________ 。
(5)加入MnO调pH时,证明MnSO4溶液中Fe3+沉淀完全的实验步骤及现象:取少量溶液,滴加___________ (填试剂),观察到___________ (填现象)。

回答下列问题:
(1)Mn的原子结构示意图为
(2)“滤液a”的主要成分为NH4Cl,另外还含有少量ZnCl2等。
①用离子方程式表示“滤液a”呈酸性的原因
②根据下图所示的溶解度曲线,将“滤液a”蒸发结晶、

(3)“焙炒”的目的是除炭、氧化MnO(OH)等。空气中O2氧化MnO(OH)的化学方程式为
(4)探究“酸浸”中MnO2溶解的适宜操作。
实验I.向MnO2中加入H2O2溶液,产生大量气泡;再加入稀H2SO4,固体未明显溶解。
实验II.向MnO2中加入稀H2SO4,固体未溶解;再加入H2O2溶液,产生大量气泡,固体完全溶解。
①实验I中MnO2的作用是
②由实验可知,“酸浸”溶解MnO2时加入试剂的顺序是
(5)加入MnO调pH时,证明MnSO4溶液中Fe3+沉淀完全的实验步骤及现象:取少量溶液,滴加
您最近一年使用:0次
名校
解题方法
7 . 取一定量加碘食盐(可能含 、KI、
、KI、 等),加蒸馏水溶解,分成几份对加碘食盐的组成进行实验测定。(已知酸性条件下
等),加蒸馏水溶解,分成几份对加碘食盐的组成进行实验测定。(已知酸性条件下 能氧化
能氧化 ,碱性或中性条件下
,碱性或中性条件下 不能氧化
不能氧化 )
)
(1)配制一定质量分数的加碘盐溶液的下列操作正确的是_______ 。_______ ,实验Ⅱ中红色物质的化学名称为_______ 。
(3)实验Ⅲ中溶液不变色,说明加碘食盐_______ (填“含”或“不含”)KI。
(4)有同学认为该加碘盐中可能含 ,设计实验方案检验是否含
,设计实验方案检验是否含
_______ 。
(5)加碘盐中若含KI,在潮湿空气中易引起碘的损失,为提高其稳定性,可加适量稳定剂,以减少碘的损失,下列物质可以作为稳定剂的是_______。
(6)为测定加碘盐中 的含量,实验小组称取x g加碘盐,加蒸馏水溶解,滴加适量稀盐酸和几滴淀粉溶液,并加入足量KI固体,充分反应后,用a mol/L的
的含量,实验小组称取x g加碘盐,加蒸馏水溶解,滴加适量稀盐酸和几滴淀粉溶液,并加入足量KI固体,充分反应后,用a mol/L的 标准溶液进行滴定,消耗VmL标准溶液,则加碘盐中
标准溶液进行滴定,消耗VmL标准溶液,则加碘盐中 含量为
含量为_______ mg/kg。(列出计算表达式,已知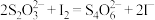 ,忽略测定过程中微量
,忽略测定过程中微量 的干扰)
的干扰)
(7)有同学认为可以直接用 溶液检测
溶液检测 的存在,并根据反应溶液蓝色出现的时间来衡量反应速率,实验记录如下:
的存在,并根据反应溶液蓝色出现的时间来衡量反应速率,实验记录如下:
设计该实验的目的是_______ 。
 、KI、
、KI、 等),加蒸馏水溶解,分成几份对加碘食盐的组成进行实验测定。(已知酸性条件下
等),加蒸馏水溶解,分成几份对加碘食盐的组成进行实验测定。(已知酸性条件下 能氧化
能氧化 ,碱性或中性条件下
,碱性或中性条件下 不能氧化
不能氧化 )
)| 实验 | 现象 |
Ⅰ.取一份溶液,滴加少量稀硫酸酸化,加入足量KI固体,加入适量 振荡,静置 振荡,静置 | 加入足量KI固体,溶液显淡黄色,加入 振荡静置后下层溶液显紫红色 振荡静置后下层溶液显紫红色 |
| Ⅱ.另取一份溶液滴加KSCN溶液 | 溶液显红色 |
| Ⅲ.另取一份溶液滴加淀粉溶液,并滴加少量稀硫酸 | 溶液不变色 |
a.  b.
b.  c.
c.  d.
d. 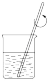
(3)实验Ⅲ中溶液不变色,说明加碘食盐
(4)有同学认为该加碘盐中可能含
 ,设计实验方案检验是否含
,设计实验方案检验是否含
(5)加碘盐中若含KI,在潮湿空气中易引起碘的损失,为提高其稳定性,可加适量稳定剂,以减少碘的损失,下列物质可以作为稳定剂的是_______。
A. | B. | C. | D. |
 的含量,实验小组称取x g加碘盐,加蒸馏水溶解,滴加适量稀盐酸和几滴淀粉溶液,并加入足量KI固体,充分反应后,用a mol/L的
的含量,实验小组称取x g加碘盐,加蒸馏水溶解,滴加适量稀盐酸和几滴淀粉溶液,并加入足量KI固体,充分反应后,用a mol/L的 标准溶液进行滴定,消耗VmL标准溶液,则加碘盐中
标准溶液进行滴定,消耗VmL标准溶液,则加碘盐中 含量为
含量为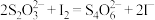 ,忽略测定过程中微量
,忽略测定过程中微量 的干扰)
的干扰)(7)有同学认为可以直接用
 溶液检测
溶液检测 的存在,并根据反应溶液蓝色出现的时间来衡量反应速率,实验记录如下:
的存在,并根据反应溶液蓝色出现的时间来衡量反应速率,实验记录如下:| 含淀粉和稀盐酸的加碘盐溶液/mL | 0.01mol/L的 溶液/mL 溶液/mL | 加水体积/mL | 实验温度/℃ | 出现蓝色时间/s | |
| 实验1 | 15 | 5 | 25 | 25 | |
| 实验2 | 15 |  | 30 | 25 | |
| 实验3 | 15 | 5 |  | 0 |
您最近一年使用:0次
2023-02-24更新
|
481次组卷
|
3卷引用:陕西省安康市高新中学2023-2024学年高三下学期2月月考理综试题-高中化学
陕西省安康市高新中学2023-2024学年高三下学期2月月考理综试题-高中化学湖北省华中师范大学第一附属中学等高考联盟2023届高三下学期2月联考化学试题(已下线)预测卷05-【大题精做】冲刺2023年高考化学大题突破+限时集训(新高考专用)
8 . 硫氰化钾 是一种用途广泛的化工原料,常用于染料、药物的生产。实验小组设计如图所示的实验装置模拟工业制备
是一种用途广泛的化工原料,常用于染料、药物的生产。实验小组设计如图所示的实验装置模拟工业制备 并进行相关探究实验。
并进行相关探究实验。

已知:① 是一种不溶于水且密度大于水的非极性试剂;
是一种不溶于水且密度大于水的非极性试剂;
② 。
。
请回答下列问题:
(1) 的电子式为
的电子式为___________ 。
(2)装置A用于实验室制备氨气,该反应的化学方程式为___________ 。
(3)装置B中,三口烧瓶内盛有 、水和固体催化剂,通入氨气的导管需要插入
、水和固体催化剂,通入氨气的导管需要插入 液体中,其目的是
液体中,其目的是___________ 。
(4)待三口烧瓶内液体不再分层时,熄灭装置A处的酒精灯,关闭 ,移开水浴。将装置B继续加热至
,移开水浴。将装置B继续加热至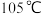 ,待
,待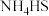 完全分解后,打开
完全分解后,打开 ,缓缓滴入适量
,缓缓滴入适量 溶液,充分反应后制得
溶液,充分反应后制得 溶液。装置C中仪器a的名称为
溶液。装置C中仪器a的名称为___________ ,装置C处的烧杯中产生淡黄色浑浊的原因是___________ (用离子方程式表示)。
(5)过滤装置C中吸收尾气后的悬浊液,得到滤液x。现取少量滤液x进行如图所示的探究实验。
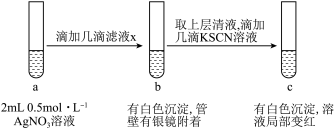
已知: 。
。
①试管b中产生银镜的原因是___________ (用离子方程式表示)。
②观察到试管c中出现上述实验现象后,用力振荡试管c,又观察到红色褪去且白色沉淀增多,结合平衡移动的知识解释其原因___________ 。
 是一种用途广泛的化工原料,常用于染料、药物的生产。实验小组设计如图所示的实验装置模拟工业制备
是一种用途广泛的化工原料,常用于染料、药物的生产。实验小组设计如图所示的实验装置模拟工业制备 并进行相关探究实验。
并进行相关探究实验。
已知:①
 是一种不溶于水且密度大于水的非极性试剂;
是一种不溶于水且密度大于水的非极性试剂;②
 。
。请回答下列问题:
(1)
 的电子式为
的电子式为(2)装置A用于实验室制备氨气,该反应的化学方程式为
(3)装置B中,三口烧瓶内盛有
 、水和固体催化剂,通入氨气的导管需要插入
、水和固体催化剂,通入氨气的导管需要插入 液体中,其目的是
液体中,其目的是(4)待三口烧瓶内液体不再分层时,熄灭装置A处的酒精灯,关闭
 ,移开水浴。将装置B继续加热至
,移开水浴。将装置B继续加热至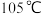 ,待
,待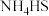 完全分解后,打开
完全分解后,打开 ,缓缓滴入适量
,缓缓滴入适量 溶液,充分反应后制得
溶液,充分反应后制得 溶液。装置C中仪器a的名称为
溶液。装置C中仪器a的名称为(5)过滤装置C中吸收尾气后的悬浊液,得到滤液x。现取少量滤液x进行如图所示的探究实验。

已知:
 。
。①试管b中产生银镜的原因是
②观察到试管c中出现上述实验现象后,用力振荡试管c,又观察到红色褪去且白色沉淀增多,结合平衡移动的知识解释其原因
您最近一年使用:0次
解题方法
9 . 某兴趣小组探究SO2气体还原Fe3+、I2,它们使用的药品和装置如图所示:
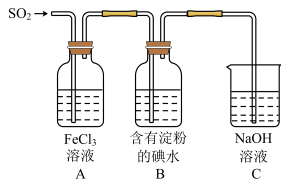
(1)SO2气体还原Fe3+,其还原产物是_______ (填离子符号),参加反应的SO2和Fe3+的物质的量之比是_______ 。
(2)下列实验方案适用于在实验室制取所需SO2的是_______。
(3)装置C的作用是_______ 。
(4)B中看到的现象是_______ ,发生的化学反应是_______ 。
(5)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入酸性KMnO4溶液,紫红色褪去。
方案②:往第二份试液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第三份试液中加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是_______ ,原因是_______ 。

(1)SO2气体还原Fe3+,其还原产物是
(2)下列实验方案适用于在实验室制取所需SO2的是_______。
| A.Na2SO3溶液与HNO3 | B.Na2SO3固体与浓硫酸 |
| C.固体硫在纯氧中燃烧 | D.铜与热浓H2SO4 |
(4)B中看到的现象是
(5)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入酸性KMnO4溶液,紫红色褪去。
方案②:往第二份试液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第三份试液中加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是
您最近一年使用:0次
21-22高一下·上海浦东新·期末
名校
10 . 为探索工业含铝、铁、铜合金废料的再利用,某同学实设计的回收利用方案如下:
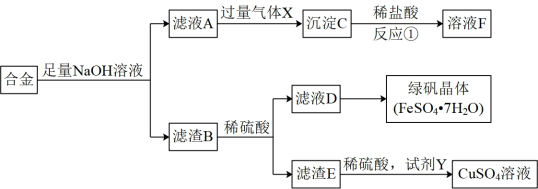
(1)滤渣B的主要成分为_______ ,溶液F的主要成分为_______ 。
(2)检验滤液D是否含有 的方法为
的方法为_______ 。
(3)从滤液D得到绿矾晶体,须进行的操作为:_______ 、_______ 、过滤洗涤、干燥。
(4)试剂Y可能为_______ 。
A.NO B. C.
C. D.
D.
与直接用浓硫酸与E反应制备 相比,用稀硫酸和试剂Y更符合“绿色化学”,的要求,原因是
相比,用稀硫酸和试剂Y更符合“绿色化学”,的要求,原因是_______ 、_______ 。
(5)若气体X为 ,请写出“滤液A”与过量气体X反应的离子方程式:
,请写出“滤液A”与过量气体X反应的离子方程式:_______ 。

(1)滤渣B的主要成分为
(2)检验滤液D是否含有
 的方法为
的方法为(3)从滤液D得到绿矾晶体,须进行的操作为:
(4)试剂Y可能为
A.NO B.
 C.
C. D.
D.
与直接用浓硫酸与E反应制备
 相比,用稀硫酸和试剂Y更符合“绿色化学”,的要求,原因是
相比,用稀硫酸和试剂Y更符合“绿色化学”,的要求,原因是(5)若气体X为
 ,请写出“滤液A”与过量气体X反应的离子方程式:
,请写出“滤液A”与过量气体X反应的离子方程式:
您最近一年使用:0次



