解题方法
1 . 铁是人类较早使用的金属之一、运用铁及其化合物的知识,完成下列问题。
(1)现有铁和铜的混合物,可以通过___________ 把他们分开。
A.盐酸 B.NaOH C.FeCl3
(2)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板。
请写出FeCl3溶液与铜反应的离子方程式:___________ 。
反应后的废液中含有Fe3+,可以用___________ 检验。
(3)现将反应后的废液采用以下流程进行回收再生,根据流程图完成下列填空。___________ ,黄绿色气体C可以把滤液转化成FeCl3腐蚀液,写出反应过程中的离子方程式___________ 。
(4)取“滤液”少许于试管中,然后滴加氢氧化钠溶液,产生白色沉淀,___________ (补全实验现象),此过程涉及氧化还原反应的化学方程式是___________ 。
(5)把一定量铁粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+和Fe3+的物质的量浓度恰好相等。则已反应的Fe3+和未反应的Fe3+的物质的量之比为___________ 。
(1)现有铁和铜的混合物,可以通过
A.盐酸 B.NaOH C.FeCl3
(2)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板。
请写出FeCl3溶液与铜反应的离子方程式:
反应后的废液中含有Fe3+,可以用
(3)现将反应后的废液采用以下流程进行回收再生,根据流程图完成下列填空。

(4)取“滤液”少许于试管中,然后滴加氢氧化钠溶液,产生白色沉淀,
(5)把一定量铁粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+和Fe3+的物质的量浓度恰好相等。则已反应的Fe3+和未反应的Fe3+的物质的量之比为
您最近一年使用:0次
名校
解题方法
2 . 铝、铁、硅的单质及化合物在工业生产中具有广泛应用,工业上常用某矿石(主要成分有Al2O3、Fe2O3、FeO、SiO2等)来制备绿矾(FeSO4•7H2O)和氧化铝,其工艺流程如图:
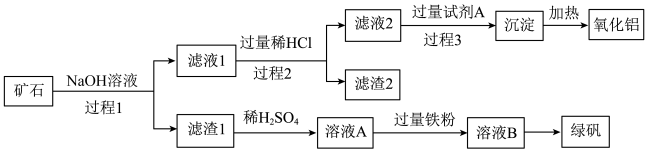
回答下列问题:
(1)滤渣1的成分是_______ ,举例说明滤渣2的用途 _______ 。
(2)用离子方程式表示溶液A加入过量铁粉的目的是_______ 。
(3)写出由滤液1生成滤液2的离子方程式_______ 。
(4)过程1、2、3均涉及分离操作,所需玻璃仪器有_______ 。
(5)过程3需要加入的试剂A是_______ ,写出此过程的离子方程式 _______ 。

回答下列问题:
(1)滤渣1的成分是
(2)用离子方程式表示溶液A加入过量铁粉的目的是
(3)写出由滤液1生成滤液2的离子方程式
(4)过程1、2、3均涉及分离操作,所需玻璃仪器有
(5)过程3需要加入的试剂A是
您最近一年使用:0次
3 . 一种以钛铁矿( ,含
,含 等杂质)为主要原料制备钛白粉
等杂质)为主要原料制备钛白粉 的工艺流程如图所示。
的工艺流程如图所示。
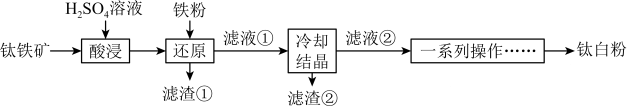
已知:①“酸浸”后钛元素主要以 形式存在;
形式存在;
② 在
在 时生成沉淀,
时生成沉淀, 时沉淀完全。
时沉淀完全。
(1)“酸浸”时,常将钛铁矿粉碎,并进行搅拌,其目的是___________ 。
(2)“酸浸”时, 发生反应的化学方程式为
发生反应的化学方程式为___________ 。
(3)滤渣①的主要成分是___________ (填化学式)。
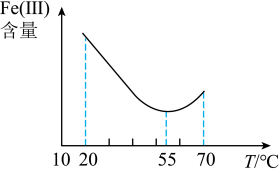
(4)流程中加入铁粉的目的是还原体系中的 。为探究最佳反应条件,某化学兴趣小组在保持反应时间相同的情况下进行探究得到结果如下。保持其它反应条件不变,还原体系中
。为探究最佳反应条件,某化学兴趣小组在保持反应时间相同的情况下进行探究得到结果如下。保持其它反应条件不变,还原体系中 (Ⅲ)(
(Ⅲ)( 价的铁元素)含量随
价的铁元素)含量随 变化如图所示。
变化如图所示。
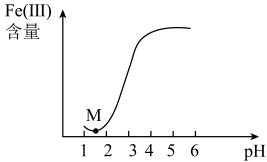
①试分析 点以后体系中
点以后体系中 (Ⅲ)含量随着
(Ⅲ)含量随着 大而增大的原因是
大而增大的原因是___________ 。
②保持其它反应条件不变,还原体系中 (Ⅲ)含量随温度变化如图所示。由图可知,还原体系中
(Ⅲ)含量随温度变化如图所示。由图可知,还原体系中 (Ⅲ)的最佳反应温度为
(Ⅲ)的最佳反应温度为___________ 
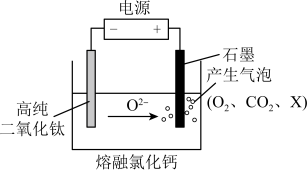
(5)如图为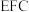 剑桥法用固体二氧化钛
剑桥法用固体二氧化钛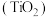 生产海绵钛的装置示意图,其原理是在较低的阴极电位下,
生产海绵钛的装置示意图,其原理是在较低的阴极电位下, (阴极)中的氧解离进入熔盐,阴极最后只剩下纯钛。阴极的电极反应式为
(阴极)中的氧解离进入熔盐,阴极最后只剩下纯钛。阴极的电极反应式为___________ ,产生的气体中 的化学式为
的化学式为___________ 。
 ,含
,含 等杂质)为主要原料制备钛白粉
等杂质)为主要原料制备钛白粉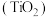 的工艺流程如图所示。
的工艺流程如图所示。
已知:①“酸浸”后钛元素主要以
 形式存在;
形式存在;②
 在
在 时生成沉淀,
时生成沉淀, 时沉淀完全。
时沉淀完全。(1)“酸浸”时,常将钛铁矿粉碎,并进行搅拌,其目的是
(2)“酸浸”时,
 发生反应的化学方程式为
发生反应的化学方程式为(3)滤渣①的主要成分是
(4)流程中加入铁粉的目的是还原体系中的
 。为探究最佳反应条件,某化学兴趣小组在保持反应时间相同的情况下进行探究得到结果如下。保持其它反应条件不变,还原体系中
。为探究最佳反应条件,某化学兴趣小组在保持反应时间相同的情况下进行探究得到结果如下。保持其它反应条件不变,还原体系中 (Ⅲ)(
(Ⅲ)( 价的铁元素)含量随
价的铁元素)含量随 变化如图所示。
变化如图所示。
①试分析
 点以后体系中
点以后体系中 (Ⅲ)含量随着
(Ⅲ)含量随着 大而增大的原因是
大而增大的原因是②保持其它反应条件不变,还原体系中
 (Ⅲ)含量随温度变化如图所示。由图可知,还原体系中
(Ⅲ)含量随温度变化如图所示。由图可知,还原体系中 (Ⅲ)的最佳反应温度为
(Ⅲ)的最佳反应温度为

(5)如图为
 剑桥法用固体二氧化钛
剑桥法用固体二氧化钛 生产海绵钛的装置示意图,其原理是在较低的阴极电位下,
生产海绵钛的装置示意图,其原理是在较低的阴极电位下, (阴极)中的氧解离进入熔盐,阴极最后只剩下纯钛。阴极的电极反应式为
(阴极)中的氧解离进入熔盐,阴极最后只剩下纯钛。阴极的电极反应式为 的化学式为
的化学式为
您最近一年使用:0次
解题方法
4 . 模拟工业上用黄铜灰渣(含有Cu、Zn、CuO、ZnO及少量FeO、Fe3O4、Fe2O3)生产Cu(NO3)2溶液的流程如下图所示。
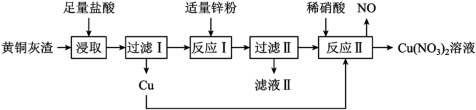
回答下列问题:
(1)写出“浸取”时Fe3O4反应的离子方程式:_______ 。
(2)过滤Ⅰ后所得滤液中是否含Fe3+,并说明理由_______ 。
(3)检验“滤液Ⅱ”中由铁元素形成的阳离子的方法是_______ 。
(4)“反应Ⅱ”所用稀硝酸可由质量分数为63%、密度为1.40g·cm-3的浓硝酸稀释获得。若要获得100mL1.4mol·L-1的稀硝酸,需要用_____ 量取浓硝酸的体积为________ mL。
(5)金属材料的使用见证了人类文明发展过程,铝合金是目前用途广泛的合金之一、例如,硬铝(一种铝合金)中含Cu 4%、Mg 0.5%、______ 0.5%、Si 0.7%,它的密度小、强度高、具有较强的抗腐蚀能力。(填元素符号)
(6)工业废电路板的铜常用FeCl3溶液来溶解处理回收。现将一块电路板浸泡在100 mL FeCl3溶液中使铜全部溶解得到浸泡液(电路板上其他物质均不发生反应),测得电路板质量减少了6.4g,在浸泡液中加足量的铁粉并使之充分反应,过滤并干燥固体,固体质量比加入的铁粉质量减少了4.8g,请回答下列问题:
①浸泡液中的溶质是________ (写化学式)。
②参与反应的铁粉的质量是______ g。
③假设溶液的体积不变,最后所得溶液c(Fe2+)=_____ mol·L-1。

回答下列问题:
(1)写出“浸取”时Fe3O4反应的离子方程式:
(2)过滤Ⅰ后所得滤液中是否含Fe3+,并说明理由
(3)检验“滤液Ⅱ”中由铁元素形成的阳离子的方法是
(4)“反应Ⅱ”所用稀硝酸可由质量分数为63%、密度为1.40g·cm-3的浓硝酸稀释获得。若要获得100mL1.4mol·L-1的稀硝酸,需要用
(5)金属材料的使用见证了人类文明发展过程,铝合金是目前用途广泛的合金之一、例如,硬铝(一种铝合金)中含Cu 4%、Mg 0.5%、
(6)工业废电路板的铜常用FeCl3溶液来溶解处理回收。现将一块电路板浸泡在100 mL FeCl3溶液中使铜全部溶解得到浸泡液(电路板上其他物质均不发生反应),测得电路板质量减少了6.4g,在浸泡液中加足量的铁粉并使之充分反应,过滤并干燥固体,固体质量比加入的铁粉质量减少了4.8g,请回答下列问题:
①浸泡液中的溶质是
②参与反应的铁粉的质量是
③假设溶液的体积不变,最后所得溶液c(Fe2+)=
您最近一年使用:0次
名校
解题方法
5 . 实验室测定氧化物 的组成实验如下:
的组成实验如下:

下列有关说法正确的是
 的组成实验如下:
的组成实验如下:
下列有关说法正确的是
A.溶液 中只含有 中只含有 和 和 | B.样品X中含有+3价铁元素 |
C.溶液 中 中 | D.根据步骤Ⅰ、Ⅱ可判断X为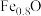 |
您最近一年使用:0次
解题方法
6 . 某工厂酸性废液中含有 、
、 、
、 、
、 、
、 ,以该废液为原料制备
,以该废液为原料制备 的工艺流程如下(部分操作和反应条件略):
的工艺流程如下(部分操作和反应条件略):
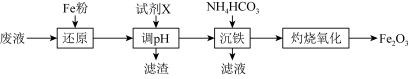
已知:加入试剂X调节pH使 生成沉淀。
生成沉淀。
回答下列问题:
(1)写出“还原”步骤中反应的离子方程式:_____________ 、_________________ 。
(2)若加入Fe粉过量,取少量调节pH过滤后得到的滤液,加入NaOH溶液的现象为_____________ ,请写出沉淀颜色发生变化的化学方程式:_________________________ 。
(3)“沉铁”过程中有 沉淀和气体生成,写出该反应的离子方程式:
沉淀和气体生成,写出该反应的离子方程式:_________________ ; 在空气中经“灼烧氧化”生成
在空气中经“灼烧氧化”生成 ,试写出“灼烧氧化”的化学方程式:
,试写出“灼烧氧化”的化学方程式:____________________ 。
 、
、 、
、 、
、 、
、 ,以该废液为原料制备
,以该废液为原料制备 的工艺流程如下(部分操作和反应条件略):
的工艺流程如下(部分操作和反应条件略):
已知:加入试剂X调节pH使
 生成沉淀。
生成沉淀。回答下列问题:
(1)写出“还原”步骤中反应的离子方程式:
(2)若加入Fe粉过量,取少量调节pH过滤后得到的滤液,加入NaOH溶液的现象为
(3)“沉铁”过程中有
 沉淀和气体生成,写出该反应的离子方程式:
沉淀和气体生成,写出该反应的离子方程式: 在空气中经“灼烧氧化”生成
在空气中经“灼烧氧化”生成 ,试写出“灼烧氧化”的化学方程式:
,试写出“灼烧氧化”的化学方程式:
您最近一年使用:0次
名校
解题方法
7 . 高纯四氧化三锰是电子工业生产锰锌氧软磁材料重要原料之一、以菱锰矿(主要成分为 ,含
,含 和少量Fe、Cu、Ni、Ca、Mg等元素)为原料制备四氧化三锰工艺流程如下图所示。
和少量Fe、Cu、Ni、Ca、Mg等元素)为原料制备四氧化三锰工艺流程如下图所示。
(1)酸浸时 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(2)“滤渣1”的主要成分为 、
、 ,还含有
,还含有___________ (填化学式)。
(3)福美钠的化学式为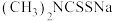 。生成福美镍沉淀的结构为
。生成福美镍沉淀的结构为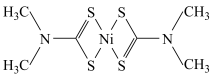 ,其中硫与镍之间的结合方式为下列中的
,其中硫与镍之间的结合方式为下列中的___________ (填标号);
A.离子键 B.金属键 C.氢键 D.配位键
25℃,电离常数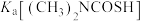
___________  (填“大于”“小于”或“等于”),其判断理由是
(填“大于”“小于”或“等于”),其判断理由是___________ 。
(4)除钙镁时, 、
、 沉淀后溶液中
沉淀后溶液中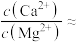
___________ [已知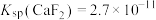 、
、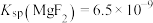 ]
]
(5)除硅时,絮凝剂为阳离子型聚丙烯酰胺,可通过“吸附—电中和—架桥”使硅酸胶体絮凝沉淀,硅酸胶体粒子带___________ 电荷(填“正”或“负”)。
(6) 在空气中被氧化生成
在空气中被氧化生成 反应的化学方程式为
反应的化学方程式为___________ 。
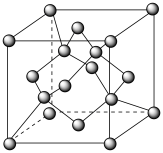
(7) 可表示为
可表示为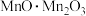 ,温度高于1170℃时属于立方晶体,其中
,温度高于1170℃时属于立方晶体,其中 和Mn3+占据晶胞的顶点、面心及内部交错的4个小立方体的体心,与金刚石晶胞中碳原子占据的位置相似(金刚石晶胞如图所示)。若
和Mn3+占据晶胞的顶点、面心及内部交错的4个小立方体的体心,与金刚石晶胞中碳原子占据的位置相似(金刚石晶胞如图所示)。若 晶体的密度为
晶体的密度为 ,则晶胞参数
,则晶胞参数
___________ pm(列出计算式,阿伏加德罗常数的值为 )。
)。
 ,含
,含 和少量Fe、Cu、Ni、Ca、Mg等元素)为原料制备四氧化三锰工艺流程如下图所示。
和少量Fe、Cu、Ni、Ca、Mg等元素)为原料制备四氧化三锰工艺流程如下图所示。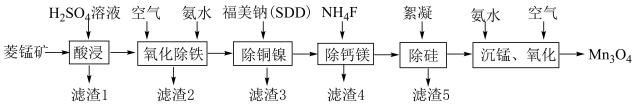
(1)酸浸时
 发生反应的离子方程式为
发生反应的离子方程式为(2)“滤渣1”的主要成分为
 、
、 ,还含有
,还含有(3)福美钠的化学式为
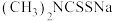 。生成福美镍沉淀的结构为
。生成福美镍沉淀的结构为 ,其中硫与镍之间的结合方式为下列中的
,其中硫与镍之间的结合方式为下列中的A.离子键 B.金属键 C.氢键 D.配位键
25℃,电离常数
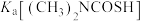
 (填“大于”“小于”或“等于”),其判断理由是
(填“大于”“小于”或“等于”),其判断理由是(4)除钙镁时,
 、
、 沉淀后溶液中
沉淀后溶液中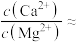
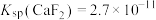 、
、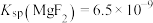 ]
](5)除硅时,絮凝剂为阳离子型聚丙烯酰胺,可通过“吸附—电中和—架桥”使硅酸胶体絮凝沉淀,硅酸胶体粒子带
(6)
 在空气中被氧化生成
在空气中被氧化生成 反应的化学方程式为
反应的化学方程式为(7)
 可表示为
可表示为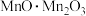 ,温度高于1170℃时属于立方晶体,其中
,温度高于1170℃时属于立方晶体,其中 和Mn3+占据晶胞的顶点、面心及内部交错的4个小立方体的体心,与金刚石晶胞中碳原子占据的位置相似(金刚石晶胞如图所示)。若
和Mn3+占据晶胞的顶点、面心及内部交错的4个小立方体的体心,与金刚石晶胞中碳原子占据的位置相似(金刚石晶胞如图所示)。若 晶体的密度为
晶体的密度为 ,则晶胞参数
,则晶胞参数
 )。
)。
您最近一年使用:0次
2024-01-06更新
|
631次组卷
|
3卷引用:云南省昆明市第一中学2023-2024学年高三上学期11月月考理科综合试题
名校
解题方法
8 . 重铬酸钾( )在实验室和工业上都有广泛应用,如用于制铬矾、制火柴、电镀、有机合成等。工业上。以铬铁矿[主要成分为
)在实验室和工业上都有广泛应用,如用于制铬矾、制火柴、电镀、有机合成等。工业上。以铬铁矿[主要成分为 ,杂质主要为硅、铁、铝的氧化物]制备重铬酸钾的工艺流程如下图所示:
,杂质主要为硅、铁、铝的氧化物]制备重铬酸钾的工艺流程如下图所示:
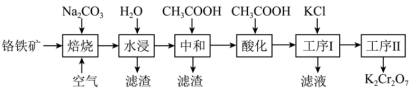
已知:①焙烧时 ,中的Fe元素转化为
,中的Fe元素转化为 ,Cr元素转化为
,Cr元素转化为 ;
;
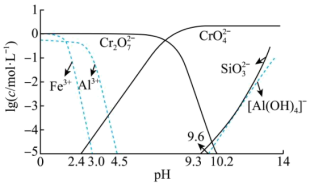
②矿物中相关元素可溶性组分物质的量浓度c与pH的关系如图所示。当溶液中可溶性组分浓度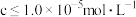 时,可认为已除尽。
时,可认为已除尽。
请回答下列问题:
(1)写出焙烧生成 和
和 的过程中,氧化剂和还原剂物质的量之比为
的过程中,氧化剂和还原剂物质的量之比为_______ 。
(2)水浸滤渣的主要成分是 ,写出生成此滤渣的离子方程式
,写出生成此滤渣的离子方程式___________ 。
(3)中和步骤中理论pH的范围是___________ ,中和后滤渣的主要成分是___________ 、___________ (填化学式)。
(4)酸化时加冰醋酸,简述不能用盐酸的可能原因是___________ 。
(5)工序1加入KCl的作用是___________ 。
(6)可以采用氧化还原滴定法测定产品的纯度,还可以采用分光光度法测定( 溶液的吸光度与其浓度成正比),但测得的质量分数明显偏低,分析原因,发现配制
溶液的吸光度与其浓度成正比),但测得的质量分数明显偏低,分析原因,发现配制 待测液时少加了一种试剂,该试剂可以是___________(填字母)
待测液时少加了一种试剂,该试剂可以是___________(填字母)
 )在实验室和工业上都有广泛应用,如用于制铬矾、制火柴、电镀、有机合成等。工业上。以铬铁矿[主要成分为
)在实验室和工业上都有广泛应用,如用于制铬矾、制火柴、电镀、有机合成等。工业上。以铬铁矿[主要成分为 ,杂质主要为硅、铁、铝的氧化物]制备重铬酸钾的工艺流程如下图所示:
,杂质主要为硅、铁、铝的氧化物]制备重铬酸钾的工艺流程如下图所示:
已知:①焙烧时
 ,中的Fe元素转化为
,中的Fe元素转化为 ,Cr元素转化为
,Cr元素转化为 ;
;②矿物中相关元素可溶性组分物质的量浓度c与pH的关系如图所示。当溶液中可溶性组分浓度
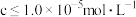 时,可认为已除尽。
时,可认为已除尽。
请回答下列问题:
(1)写出焙烧生成
 和
和 的过程中,氧化剂和还原剂物质的量之比为
的过程中,氧化剂和还原剂物质的量之比为(2)水浸滤渣的主要成分是
 ,写出生成此滤渣的离子方程式
,写出生成此滤渣的离子方程式(3)中和步骤中理论pH的范围是
(4)酸化时加冰醋酸,简述不能用盐酸的可能原因是
(5)工序1加入KCl的作用是
(6)可以采用氧化还原滴定法测定产品的纯度,还可以采用分光光度法测定(
 溶液的吸光度与其浓度成正比),但测得的质量分数明显偏低,分析原因,发现配制
溶液的吸光度与其浓度成正比),但测得的质量分数明显偏低,分析原因,发现配制 待测液时少加了一种试剂,该试剂可以是___________(填字母)
待测液时少加了一种试剂,该试剂可以是___________(填字母)| A.硫酸 | B.氢碘酸 | C.硝酸钾 | D.氢氧化钾 |
您最近一年使用:0次
名校
解题方法
9 . 为探索某工厂的废金属屑(主要成分为Fe、Cu、Al、Al2O3等)的再利用,某化学兴趣小组设计了如下实验流程,用该工厂的合金废料制取氯化铝、胆矾晶体( )和水处理剂高铁酸钾(K2FeO4)。
)和水处理剂高铁酸钾(K2FeO4)。
(1)试剂X可以是___________。(填编号)
(2)试剂Y可以是___________。
(3)关于溶液D的说法正确的是___________。
(4)从CuSO4溶液中获取胆矾晶体的操作是___________ 、___________ 过滤、洗涤。
(5)从AlCl3溶液得到氯化铝固体时要加入适量的盐酸,结合化学用语解释原因___________ 。
(6)在步骤Ⅱ时,小组成员用下图装置进行试验,观察到烧杯中产生的白色沉淀会逐渐减少。为避免固体C减少,你的建议是___________ 。 对K2FeO4生成率有不同影响,由图可知工业生产中最佳条件(温度和
对K2FeO4生成率有不同影响,由图可知工业生产中最佳条件(温度和 的质量浓度)为___________。
的质量浓度)为___________。
(8)在固体F中加入稀硫酸和H2O2来制备CuSO4溶液是一种环保工艺,该反应的总的离子方程式为___________ 。
(9)高铁酸钾(K2FeO4)是一种环保、高效的水处理剂,它能氧化杀菌并能吸附水中悬浮的杂质,有关说法不正确的是___________。
(10)该小组同学取用100.0g该废金属屑,经过实验,最终得到胆矾晶体20.0g,该废料中铜的质量分数约为___________ 。
 )和水处理剂高铁酸钾(K2FeO4)。
)和水处理剂高铁酸钾(K2FeO4)。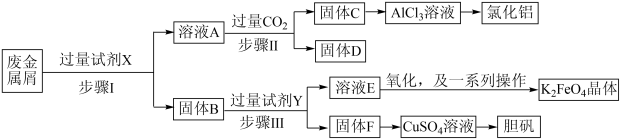
(1)试剂X可以是___________。(填编号)
| A.氨水 | B.氢氧化钠溶液 | C.盐酸 | D.硫酸 |
(2)试剂Y可以是___________。
| A.氨水 | B.氢氧化钠溶液 | C.盐酸 | D.硫酸 |
(3)关于溶液D的说法正确的是___________。
| A.含有碳酸氢钠溶质 |
| B.一定显碱性 |
C.存在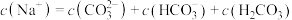 |
D.存在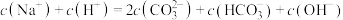 |
(4)从CuSO4溶液中获取胆矾晶体的操作是
(5)从AlCl3溶液得到氯化铝固体时要加入适量的盐酸,结合化学用语解释原因
(6)在步骤Ⅱ时,小组成员用下图装置进行试验,观察到烧杯中产生的白色沉淀会逐渐减少。为避免固体C减少,你的建议是
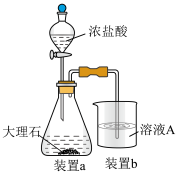
 对K2FeO4生成率有不同影响,由图可知工业生产中最佳条件(温度和
对K2FeO4生成率有不同影响,由图可知工业生产中最佳条件(温度和 的质量浓度)为___________。
的质量浓度)为___________。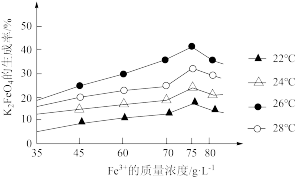
A.22℃, | B.24℃, |
C.26℃, | D.28℃, |
(8)在固体F中加入稀硫酸和H2O2来制备CuSO4溶液是一种环保工艺,该反应的总的离子方程式为
(9)高铁酸钾(K2FeO4)是一种环保、高效的水处理剂,它能氧化杀菌并能吸附水中悬浮的杂质,有关说法不正确的是___________。
| A.高铁酸钾的还原产物易水解形成胶体,可使水中悬浮物凝聚沉降 |
| B.高铁酸钾中含有离子键、极性共价键 |
C.1mol高铁酸钾生成胶粒数等于 |
| D.高铁酸钾中铁元素为+6价 |
(10)该小组同学取用100.0g该废金属屑,经过实验,最终得到胆矾晶体20.0g,该废料中铜的质量分数约为
您最近一年使用:0次
解题方法
10 . 氟化镁( )是用途广泛的无机化工原料。由菱镁矿(主要成分为
)是用途广泛的无机化工原料。由菱镁矿(主要成分为 ,含少量Ca、Si、Fe、Mn和Al等元素)制备氟化镁的流程如下图:
,含少量Ca、Si、Fe、Mn和Al等元素)制备氟化镁的流程如下图: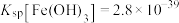 ,
,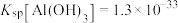 。回答下列问题:
。回答下列问题:
(1)“煅烧”时,菱镁矿主要成分发生反应的化学方程式是___________ 。
(2)“蒸氨”过程中“尾气”的主要成分是___________ (填化学式)。
(3) 溶液除“氧化除锰”外,还有
溶液除“氧化除锰”外,还有___________ 的作用。生产中,所需 用量远超理论值的原因是
用量远超理论值的原因是___________ 。
(4)“除铁铝”过程中,当 恰好沉淀完全时,溶液中
恰好沉淀完全时,溶液中
___________ (计算结果保留两位有效数字)。
(5)“除铁铝”时,用氨水调节溶液的pH,但pH不宜过高,原因是___________ 。
(6)“沉淀”时,发生反应的离子方程式是___________ 。
 )是用途广泛的无机化工原料。由菱镁矿(主要成分为
)是用途广泛的无机化工原料。由菱镁矿(主要成分为 ,含少量Ca、Si、Fe、Mn和Al等元素)制备氟化镁的流程如下图:
,含少量Ca、Si、Fe、Mn和Al等元素)制备氟化镁的流程如下图: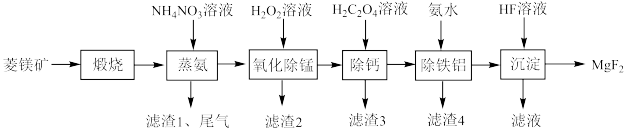
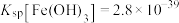 ,
,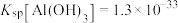 。回答下列问题:
。回答下列问题:(1)“煅烧”时,菱镁矿主要成分发生反应的化学方程式是
(2)“蒸氨”过程中“尾气”的主要成分是
(3)
 溶液除“氧化除锰”外,还有
溶液除“氧化除锰”外,还有 用量远超理论值的原因是
用量远超理论值的原因是(4)“除铁铝”过程中,当
 恰好沉淀完全时,溶液中
恰好沉淀完全时,溶液中
(5)“除铁铝”时,用氨水调节溶液的pH,但pH不宜过高,原因是
(6)“沉淀”时,发生反应的离子方程式是
您最近一年使用:0次



