名校
解题方法
1 . 氯化亚铜(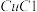 )在化工、印染、电镀等行业应用广泛。
)在化工、印染、电镀等行业应用广泛。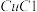 微溶于水,不溶于醇和稀酸,可溶于
微溶于水,不溶于醇和稀酸,可溶于 浓度较大的溶液,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量
浓度较大的溶液,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量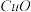 )为原料,采用硝酸铵氧化分解技术生产
)为原料,采用硝酸铵氧化分解技术生产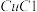 的工艺过程如图。回答下列问题:
的工艺过程如图。回答下列问题:

(1)步骤①中N元素被还原为最低价,写出此反应的离子方程式______________ 。
(2)步骤②中,亚硫酸铵要略保持过量,原因是___________ ,滤液中可循环利用的物质是__________ 。
(3)步骤⑤中,用“醇洗”可快速去除滤渣表面的水,防止滤渣被空气氧化为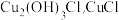 被氧化为
被氧化为 的化学方程式为
的化学方程式为______________________ 。
(4)用 溶液测定氯化亚铜样品纯度(假设杂质不参与反应),步骤如下:准确称取所制备的氯化亚铜样品
溶液测定氯化亚铜样品纯度(假设杂质不参与反应),步骤如下:准确称取所制备的氯化亚铜样品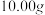 ,将其置于过量的
,将其置于过量的 溶液中,待样品完全溶解后,加入适量稀硫酸配成
溶液中,待样品完全溶解后,加入适量稀硫酸配成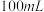 溶液,取溶液
溶液,取溶液 用
用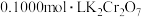 溶液进行滴定,反应中
溶液进行滴定,反应中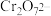 被还原成
被还原成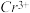 ,相关数据记录如表所示:该样品中
,相关数据记录如表所示:该样品中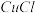 的质量分数
的质量分数__________________ 。
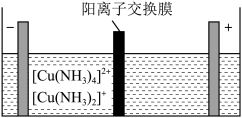
(5)制造印刷电路板产生的废液中含大量 等离子,利用膜电解技术对此废液进行电解,电解装置如图所示。电解后的阴极液中加入适量盐酸并用水稀释可得到
等离子,利用膜电解技术对此废液进行电解,电解装置如图所示。电解后的阴极液中加入适量盐酸并用水稀释可得到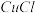 ,电解时阴极的电极反应式为
,电解时阴极的电极反应式为___________ ,生成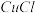 的离子方程式为
的离子方程式为________________________________ 。
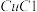 )在化工、印染、电镀等行业应用广泛。
)在化工、印染、电镀等行业应用广泛。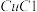 微溶于水,不溶于醇和稀酸,可溶于
微溶于水,不溶于醇和稀酸,可溶于 浓度较大的溶液,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量
浓度较大的溶液,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量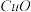 )为原料,采用硝酸铵氧化分解技术生产
)为原料,采用硝酸铵氧化分解技术生产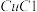 的工艺过程如图。回答下列问题:
的工艺过程如图。回答下列问题:
(1)步骤①中N元素被还原为最低价,写出此反应的离子方程式
(2)步骤②中,亚硫酸铵要略保持过量,原因是
(3)步骤⑤中,用“醇洗”可快速去除滤渣表面的水,防止滤渣被空气氧化为
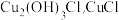 被氧化为
被氧化为 的化学方程式为
的化学方程式为(4)用
 溶液测定氯化亚铜样品纯度(假设杂质不参与反应),步骤如下:准确称取所制备的氯化亚铜样品
溶液测定氯化亚铜样品纯度(假设杂质不参与反应),步骤如下:准确称取所制备的氯化亚铜样品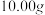 ,将其置于过量的
,将其置于过量的 溶液中,待样品完全溶解后,加入适量稀硫酸配成
溶液中,待样品完全溶解后,加入适量稀硫酸配成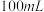 溶液,取溶液
溶液,取溶液 用
用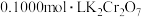 溶液进行滴定,反应中
溶液进行滴定,反应中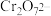 被还原成
被还原成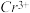 ,相关数据记录如表所示:该样品中
,相关数据记录如表所示:该样品中 的质量分数
的质量分数| 实验编号 | 1 | 2 | 3 |
消耗 溶液的体积/mL 溶液的体积/mL | 14.98 | 16.03 | 15.02 |
 等离子,利用膜电解技术对此废液进行电解,电解装置如图所示。电解后的阴极液中加入适量盐酸并用水稀释可得到
等离子,利用膜电解技术对此废液进行电解,电解装置如图所示。电解后的阴极液中加入适量盐酸并用水稀释可得到 ,电解时阴极的电极反应式为
,电解时阴极的电极反应式为 的离子方程式为
的离子方程式为
您最近一年使用:0次
2020-03-28更新
|
353次组卷
|
3卷引用:山东省六地市部分学校2020届高三下学期3月2日线上考试化学试题
山东省六地市部分学校2020届高三下学期3月2日线上考试化学试题山东省实验中学2020届高三线上诊断测试化学试题(已下线)考点17 化工生产诸要素及流程图分析-2020年高考化学命题预测与模拟试题分类精编
名校
解题方法
2 . 我国古代的青铜器工艺精湛,有很高的艺术价值和历史价值。下列说法不正确的是( )
| A.我国使用青铜器的时间比使用铁器、铝器的时间均要早 |
| B.将青铜器放在银质托盘上,青铜器容易生成铜绿 |
| C.《本草纲目》载有名“铜青”之药物,铜青是铜器上的绿色物质,则铜青就是青铜 |
| D.用蜂蜡做出铜器的蜡模,是古代青铜器的铸造方法之一,蜂蜡的主要成分是有机物 |
您最近一年使用:0次
2020-05-07更新
|
1319次组卷
|
15卷引用:山东省淄博市2020届高三第一次模拟化学试题
山东省淄博市2020届高三第一次模拟化学试题(山东新高考)2020年高考考前45天大冲刺卷 化学一辽宁省葫芦岛协作校2020届高三上学期第二次考试化学试题河北省邢台市2020届高三上学期第四次月考化学试题广东省汕头市潮阳实验学校2020届高三下学期3月线上统一考试理科综合化学试题(已下线)考点01 化学与STSE-2020年高考化学命题预测与模拟试题分类精编(已下线)考点15 金属元素及其化合物-2020年高考化学命题预测与模拟试题分类精编四川省成都龙泉中学2021届高三上学期12月月考理综化学试题(已下线)专题01 传统文化与STSE-2021年高考化学必做热点专题(已下线)解密06 金属及其化合物(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密06 金属及其化合物(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)课时18 铜及其化合物 合金-2022年高考化学一轮复习小题多维练(全国通用)安徽省六安市金寨县青山中学2022届高三上学期开学考试化学试题(已下线)考点16 铜及其金属材料-备战2023年高考化学一轮复习考点帮(全国通用)内蒙古自治区赤峰市2024届高三上学期10月一轮复习大联考化学试题
名校
解题方法
3 . 废旧印刷电路板是一种电子废弃物,某科研小组设计如下工艺流程回收铜并制取胆矾(流程中RH为萃取剂),下列说法正确的是
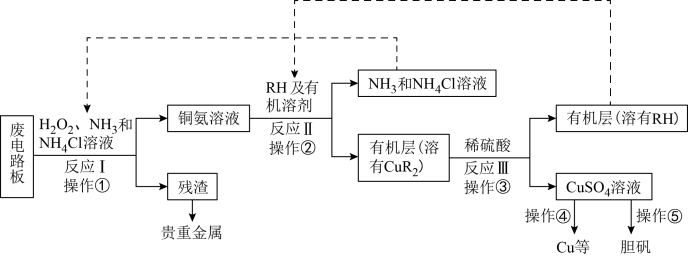

A.反应I的离子方程式为:Cu+H2O2+2NH3+2 ==Cu(NH3) ==Cu(NH3)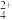 +2H2O +2H2O |
| B.操作②用到的主要仪器为蒸馏烧瓶 |
| C.操作④以石墨为电极电解硫酸铜溶液:阳极产物为O2和H2SO4 |
| D.操作⑤为:蒸发浓缩、冷却结晶、过滤、热水洗涤、干燥 |
您最近一年使用:0次
2020-02-14更新
|
323次组卷
|
5卷引用:山东省青岛市2020届高三上学期期末考试化学试题
13-14高三上·福建泉州·期末
名校
解题方法
4 . 已知NH4CuSO3与足量的1 mol·L-1硫酸溶液混合微热,产生下列现象:①有红色金属生成;②有刺激性气味气体产生;③溶液呈蓝色。据此判断下列说法合理的是
| A.NH4CuSO3中硫元素被氧化了 |
| B.刺激性气味的气体是二氧化硫或氨气 |
| C.该反应中NH4CuSO3既是氧化剂又是还原剂 |
| D.该反应中硫酸既表现为酸性又表现氧化性 |
您最近一年使用:0次
2020-10-07更新
|
1336次组卷
|
29卷引用:山东省济宁市微山县第二中学2018届高三上学期第一次月考化学试题
山东省济宁市微山县第二中学2018届高三上学期第一次月考化学试题山东省淄博市张店区潘庄高级中学2023-2024学年高一下学期第一次月考化学试题(已下线)2013届福建省南安一中高三上学期期末考试化学试卷(已下线)2015届浙江省台州中学高三上学期第一次统练化学试卷2016届宁夏六盘山高级中学高三上学期期中考试化学试卷2017届浙江省温州中学高三上10月高考模拟化学试卷浙江省2018版考前特训(2017年10月)学考70快练:3 化学反应类型及氧化还原反应概念2018届高三一轮复习化学:微考点11-氧化还原反应的概念2019年秋高三化学复习强化练习—— 氮及其化合物河南省信阳市罗山县2020届高三毕业班第一次调研化学试题苏教版(2020)高一必修第一册专题4 总结检测高一必修第二册(人教2019版)第五章 第一节 硫及其化合物 综合训练湖南省长沙市长郡中学2021届高三月考试卷(二)化学试题安徽省定远县育才学校2021届高三上学期第一次月考化学试题(已下线)【浙江新东方】双师(27)(已下线)【浙江新东方】绍兴qw78上海市七宝中学2021届高三下学期3月摸底考试化学试题湖北省公安县第三中学2020-2021学年高三上学期11月月考化学试题课后-5.1.2 硫酸和硫酸根离子的检验 -人教2019必修第二册湖北省荆州市公安县第三中学2022-2023学年高三上学期8月月考化学试题安徽省宿州市第二中学2022-2023学年高一上学期第一次月考化学试题安徽省淮北师范大学附属实验中学2022-2023学年高一下学期第一次月考化学试题安徽省亳州市第一中学2022-2023学年高一下学期第一次月考化学试题河南省郑州外国语学校2022-2023学年高一下学期第一次月考化学试题湖北省武昌实验中学2022-2023学年高一下学期3月月考化学试题湖北省恩施州高中教育联盟2022-2023学年高一下学期期中考试化学试题上海市进才中学2022-2023学年高一下学期5月月考化学试题湖南省衡阳县第四中学2022-2023学年高一下学期第一次(3月)月考化学试题河南省焦作市沁阳市第一中学2022-2023学年高一下学期6月份月考 化学试题
5 . 某废液中含有Fe3+、Cu2+、Ba2+、Cl-四种离子,某化学实验小组设计下列方案对废液进行处理,以回收金属并制备氯化钡、氯化铁晶体。

回答下列问题:
(1)写出向废液中加入过量铁粉发生反应的离子方程式______________________ 。
(2)沉淀A中含有的金属单质是_______________ 。
(3)下列物质中,可以用作试剂X的是_____________ (填写序号)。
A.BaCl2 B.BaCO3 C.NaOH D.Ba(OH)2
(4)向溶液B中通入Cl2的作用是__________________ ;实验过程中该小组同学用NaCl固体、MnO2和浓硫酸混合加热的办法制得Cl2,写出反应的化学方程式________________ ;由于Cl2有毒,某同学建议用双氧水替换,请写出向溶液B中加入双氧水后发生反应的离子方程式__________________ 。

回答下列问题:
(1)写出向废液中加入过量铁粉发生反应的离子方程式
(2)沉淀A中含有的金属单质是
(3)下列物质中,可以用作试剂X的是
A.BaCl2 B.BaCO3 C.NaOH D.Ba(OH)2
(4)向溶液B中通入Cl2的作用是
您最近一年使用:0次
6 . CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法不正确的是
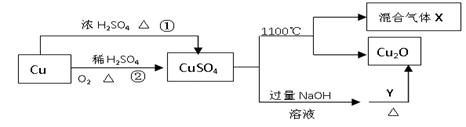

| A.相对于途径①,途径②更好地体现了绿色化学思想 |
| B.Y可以是葡萄糖溶液 |
| C.CuSO4在1100℃分解所得气体X可能是SO2和SO3的混合气体 |
| D.将CuSO4溶液蒸发浓缩,冷却结晶可制得胆矾晶体 |
您最近一年使用:0次
解题方法
7 . 工业上用某矿渣(含有Cu2O(主要)、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下:
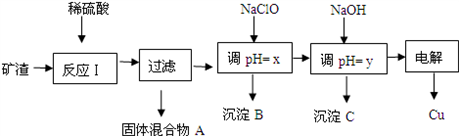
已知:Cu2O+2H+=Cu+Cu2++H2O
(1)固体混合物A中的成分是______________ .
(2)反应Ⅰ完成后,铁元素的存在形式为_____________ .(填离子符号)请写出生成该离子的离子方程式_________________________ .
(3)沉淀B可用于制造铁红,为了保证铁红的质量则x的取值为_____________ 。
(4)书写出由沉淀C制备铝 的化学方程式:___________________ 。

已知:Cu2O+2H+=Cu+Cu2++H2O
| 沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
| 沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
(1)固体混合物A中的成分是
(2)反应Ⅰ完成后,铁元素的存在形式为
(3)沉淀B可用于制造铁红,为了保证铁红的质量则x的取值为
(4)书写出由沉淀C制备
您最近一年使用:0次
12-13高一上·广东·期末
名校
解题方法
8 . 已知下述三个实验均能发生化学反应
①将铁钉放入硫酸铜溶液中 ②向硫酸亚铁溶液中滴入几滴双氧水
③将铜丝放入氯化铁溶液中
下列判断正确的是( )
①将铁钉放入硫酸铜溶液中 ②向硫酸亚铁溶液中滴入几滴双氧水
③将铜丝放入氯化铁溶液中
下列判断正确的是( )
| A.实验①中铁钉做氧化剂 |
| B.实验②中Fe2+具有还原性 |
| C.实验③中发生的是置换反应 |
| D.上述实验证明氧化性Fe3+>Fe2+>Cu2+ |
您最近一年使用:0次
2016-10-21更新
|
327次组卷
|
10卷引用:山东省寿光现代中学2016-2017学年高一下学期第三学段质量监测(期中)化学试题
山东省寿光现代中学2016-2017学年高一下学期第三学段质量监测(期中)化学试题(已下线)2011-2012学年广东省实验中学高一上学期期末考试化学试卷2014-2015辽宁省大连市第二十高中高一上学期期末化学试卷2014-2015吉林省松原市扶余县一中高一上学期期末化学试卷2017届天津市静海一中高三上学期9月调研化学试卷湖南省郴州市2017-2018学年高一上学期期末考试化学试题湖南省长沙市雨花区2018-2019学年高一上学期期末考试化学试题河北省元氏县第四中学2020-2021学年高一10月月考化学试题云南省玉溪第三中学2021-2022学年高一上学期期末考试化学试题云南省开远市第一中学校2023-2024学年高一上学期期中考试化学试题
9 . 现有一份含70% Cu、25% Al、4% Fe及少量Au、Pt等金属的混合物,设计出如下路线制备胆矾和硫酸铝晶体:
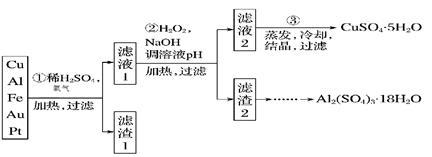
请回答下列问题:
(1)第①步Cu与酸、氧气反应的离子方程式为_____________________________________ ;
(2)第②步加H2O2的作用是( 用离子方程式表示原因)__________________________ ;
(3)由滤渣2制取Al2(SO4)3·18H2O ,探究小组设计了三种方案:

上述三种方案中,甲方案的缺陷是______________________________ ;
等量滤渣生成Al2(SO4)3·18H2O最多的是方案__________ 。

请回答下列问题:
(1)第①步Cu与酸、氧气反应的离子方程式为
(2)第②步加H2O2的作用是( 用离子方程式表示原因)
(3)由滤渣2制取Al2(SO4)3·18H2O ,探究小组设计了三种方案:

上述三种方案中,甲方案的缺陷是
等量滤渣生成Al2(SO4)3·18H2O最多的是方案
您最近一年使用:0次
名校
解题方法
10 . 部分被氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共8.0 g,经如下处理:

下列说法正确的是

下列说法正确的是
| A.滤液A中的阳离子为Fe2+、Fe3+、H+ |
| B.该样品中Cu、O元素的质量比为10:l |
| C.V=448 |
| D.溶解样品时消耗H2SO4的物质的量为0.04 mol |
您最近一年使用:0次
2016-11-28更新
|
1102次组卷
|
3卷引用:2017届山东省临沂市高三上学期期中化学试卷



