(1)在一体积为10L的容器中,通入一定量的CO和H2O,在一定温度时发生反应,4s后达到平衡状态。CO+H2O(g)⇌CO2+H2;△H<0
①CO和H2O的浓度变化如下图所示,则在0~4s时正反应的平均反应速率为v(CO2)=
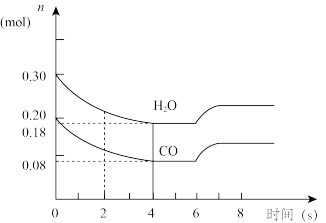
②图中6~7s之间反应向
A.只充入水蒸气 B.只降低温度 C.只使用催化剂
D.只充入惰性气体 E.增大压强 F.只充入CO2
(2)在25℃下,将amol·L-1的醋酸与0.01mol·L-1的NaOH等体积混合,反应平衡时溶液中c(Na+)=c(CH3COO-),则溶液显
(3)氨气的水溶液称为氨水,它的主要存在微粒是NH3·H2O。
已知:a.常温下,醋酸和NH3·H2O的电离平衡常数均为1.74×10-5mol/L
b.CH3COOH+NaHCO3=CH3COONa+CO2↑+H2O
则CH3COONH4溶液呈
(4)已知常温下Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=1.0×10-38。现有0.1mol·L-1的CuCl2溶液中含有Fe3+,调节pH=3.0使Fe3+沉淀完全[即当c(Fe3+)<10-5mol·L-1时认为沉淀完全]此时Cu2+是否开始沉淀
(1)Y的最高价氧化物对应的水化物与Y的氢化物恰好完全反应,生成物的水溶液呈酸性,其原因是
(2)由XW4、Z2和KOH溶液组成的新型燃料电池中,负极上发生反应的电极反应式为
(3)已知:2YZ2(g)⇌Y2Z4(g) ΔH<0。在恒温恒容条件下,将一定量YZ2和Y2Z4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。
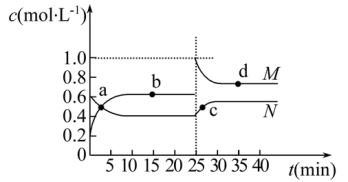
①a、b、c、d四个点中,化学反应处于平衡状态的是点
②25min时,增加了
③a、b、c、d四个点所表示的反应体系中,气体颜色由深到浅的顺序是
(1)CO2可以转化为甲醇:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH=−184 kJ·mol−1。该转化过程正反应的活化能为a kJ·mol−1,则逆反应的活化能为
CH3OH(g)+H2O(g) ΔH=−184 kJ·mol−1。该转化过程正反应的活化能为a kJ·mol−1,则逆反应的活化能为| 化学键 | C=O | C–O | C–H | H–H | O–H |
| 键能/kJ·mol−1 | x | 351 | 415 | 436 | 462 |

(3)中科院上海高等研究院将CO2在Na−Fe3O4/HZSM−5催化下转变为汽油(C5~C11的烃),辛烷值最高含量可达78%左右,该研究成果在《Nature Chemistry》上发表,并已申报中国发明专利和国际PCT专利。反应过程如下图所示。

①若CO2在该条件下转化为辛烷,请写出该反应的化学方程式
②催化剂中的Fe3O4可用铁做电极,稀硫酸为电解质,然后通过电解来制备,写出电解时的阳极反应式:
③下列关于该转化方法的说法合理的是
a.Na−Fe3O4/HZSM−5不参与反应过程,可以降低反应的活化能
b.CO2在该条件下转化为戊烷或辛烷,均需三步反应
c.反应过程中有非极性键的断裂,没有非极性键的生成
d.该方法有助于减少CO2排放,同时减轻对化石燃料的依赖
(1)CO催化脱氮:在一定温度下,向2L的恒容密闭容器中充入4.0molNO2和4.0molCO,在催化制作用下发生反应:2NO2(g)+4CO(g)⇌N2(g)+4CO2(g)△H=-127.8kJ/mol,测得相关数据如下:
| 时间 浓度 | 0min | 5min | 10min | 15min | 20min |
| c(NO2)/mol/L | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
| c(N2)/mol/L | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
②下列表述能说明该反应已达到平衡状态的是
A.CO的化学反应速率为N2的4倍
B.气体的颜色不再变化
C.化学平衡常数K不再变化
D.混合气体的密度不再变化
③有利于提高该反应中NO2平衡转化率的条件是
A.高温低压 B.低温高压 C.高温高压 D.低温低压
(2)CO与Ni发生羰化反应形成的络合物可作为催化烯烃反应的催化剂Ni的羰化反应为:Ni(s)+4CO(g)⇌Ni(CO)4(g)△H<0,T0温度下,将足量的Ni粉和3.7molCO加入到刚性密闭容器中,10min时反应达到平衡,测得体系的压强为原来的
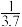 。则:
。则:①0~10min内平均反应速率v(Ni)=
②研究表明,正反应速率v正=k正•x4(CO),逆反应速率v逆=k逆•x[Ni(CO)4](k正和k逆分别表示正反应和逆反应的速率常数,x为物质的量分数),计算T0温度下的
 =
=(3)CH4与CO2经催化反应可制得合成气:CH4(g)+CO2(g)=2CO(g)+2H2(g)ΔH
已知:反应1:CH4(g)=C(s)+2H2(g)ΔH1=+75kJ/mol
反应2:2CO(g)=C(s)+CO2(g)ΔH2=-172kJ/mol则该催化反应的ΔH=
(4)电极生物膜电解脱硝是电化学和微生物工艺的组合。某微生物膜能利用阴极电解产生的活性原子H将碱性溶液中的NO
 还原为N2,工作原理如图所示。
还原为N2,工作原理如图所示。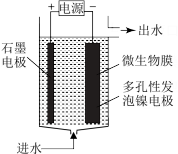
①写出活性原子与NO
 反应的离子方程式
反应的离子方程式②若阳极生成标准状况下2.24L气体,理论上可除去NO
 的物质的量为
的物质的量为(1)工业上可由以下反应制取草酸:
I.4CO(g)+4C4H9OH(l)+O2(g)
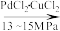 2(COOC4H9)2(l)+2H2O(l)
2(COOC4H9)2(l)+2H2O(l)II.(COOC4H9)2(l)+2H2O(l)
 H2C2O4(l)+2C4H9OH(l)
H2C2O4(l)+2C4H9OH(l)①反应I选择13~15 MPa的高压条件下进行,最主要的原因是为了
②对于反应II,下列能够说明其已经达到平衡状态的是
a.溶液的pH保持不变
b.平衡常数K保持不变
c.丁醇的浓度保持不变
d.反应液的总质量保持不变
(2)草酸溶液中微粒的物质的量分数随溶液pH变化如图所示:

①某温度下,测得0.1 mol·L-1 H2C2O4溶液的pH=1.3,此时草酸的电离方程式为
②向10 mL 0.1 mol·L-1 H2C2O4溶液中逐滴加入0.1 mol·L-1 NaOH溶液,当溶液中c(Na+)=2c(
 )+c(
)+c( )时,加入V(NaOH)
)时,加入V(NaOH)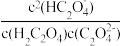 =
=(1)用H2S和天然气生产CS2的反应为CH4(g)+2H2S(g)
 CS2(l)+4H2(g)。
CS2(l)+4H2(g)。已知:I.CH4(g)+4S(s)
 CS2(g)+2H2S(g) ΔH1=akJ·mol-1;
CS2(g)+2H2S(g) ΔH1=akJ·mol-1;II.S(s)+H2(g)
 H2S(g) ΔH2=bkJ·mol-1;
H2S(g) ΔH2=bkJ·mol-1;Ⅲ.CS2(1)
 CS2(g) ΔH3=ckJ·mol-1。
CS2(g) ΔH3=ckJ·mol-1。则反应CH4(g)+2H2S(g)
 CS2(1)+4H2(g)的ΔH=
CS2(1)+4H2(g)的ΔH=(2)800℃时,将一定量的H2S气体充入1L密闭容器中,发生反应H2S(g)
 S(s)+H2(g),tmin后反应达到化学平衡状态,测得容器中H2与H2S的质量浓度分别为0.02g/L、0.34g/L,则H2S的初始浓度
S(s)+H2(g),tmin后反应达到化学平衡状态,测得容器中H2与H2S的质量浓度分别为0.02g/L、0.34g/L,则H2S的初始浓度(3)向恒压密闭容器中充入0.1molCH4和0.2molH2S,发生反应CH4(g)+2H2S(g)
 CS2(g)+4H2(g),测得不同温度下,CH4的平衡转化率(%)与温度(℃)的关系如图所示:
CS2(g)+4H2(g),测得不同温度下,CH4的平衡转化率(%)与温度(℃)的关系如图所示:
①1200℃,反应达到平衡时, H2S的物质的量分数为
②1200℃时,在恒温恒容时,欲提高CH4的平衡转化率,可以采取的措施是
A.使用高效催化剂 B.再充入CH4
C.再充入H2S D.充入He E.移走H2
(4)某溶液中含0.01mol/L Fe2+和某浓度的Mn2+,当S2-浓度至少为
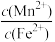 =
=
已知v正=k正χ(CH3COOCH3)·χ(C6H13OH),v逆=k逆χ(CH3COOC6H13)·χ(CH3OH),其中v正、v逆为正、逆反应速率,k正、k逆为速率常数,χ为备组分的物质的量分数。
(1)反应开始时,己醇和乙酸甲酯按物质的量之比1:1投料,测得348K、343K、338K三个温度下乙酸甲酯转化率(α)随时间(t)的变化关系如图所示。

该醇解反应的

在曲线①、②、③中,k正—k逆值最小的曲线是
(2)343K时,乙酸甲酯和己醇按物质的量之比1:1、1:2和2:1进行初始投料。则达到甲衡后,初始投料比
(3)该醇解反应使用离子交换树脂作催化剂,下列关于该催化剂的说法不正确的是
a.参与了醇解反应,但并不改变反应历程 b.使k正和k逆增大相同倍数
c.降低了醇解反应的活化能 d.提高乙酸甲酯的平衡转化率
(1)煤燃烧产生的烟气中含有氮的氧化物,用CH3催化还原NOx可消除氮氧化物的污染。
已知:①CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867.0 kJ·mol-1
②2NO(g)+O2(g)=2NO2(g) △H=-112 kJ·mol-1;
③适量的N2和O2完全反应,每生成5.6 L(标准状况下)NO时,吸收22.5 kJ的热量。则CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=
(2)在汽车排气系统中安装三元催化转化器,可发生下列反应:2NO(g)+2CO(g)
 2CO2(g)+N2(g)。在某恒容密闭容器中通入等物质的量的CO和NO,在不同温度(T)下发生上述反应时,c(CO)随时间(t)的变化曲线如图所示:
2CO2(g)+N2(g)。在某恒容密闭容器中通入等物质的量的CO和NO,在不同温度(T)下发生上述反应时,c(CO)随时间(t)的变化曲线如图所示: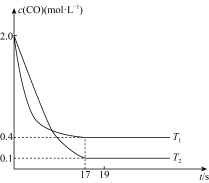
①该反应的逆反应为
②温度为T1时,反应达到平衡时NO的转化率为
③温度为T2时,该反应的平衡常数K=
(3)目前烟气脱硝采用的技术有选择性非催化还原法(SNCR)脱硝技术和选择性催化还原法(SCR)脱硝技术。若用NH3作还原剂,则主要反应可表示为4NH3(g)+4NO(g)+O2(g)
 4N2(g)+6H2O △H<0,其中体系温度对SNCR技术脱硝效率的影响如图所示:
4N2(g)+6H2O △H<0,其中体系温度对SNCR技术脱硝效率的影响如图所示: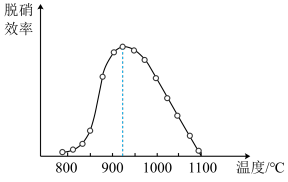
①SNCR技术脱硝的最佳温度为
②由题给信息分析,当体系温度过高时,SNCR技术脱硝效率降低,其可能的原因是
 、炭黑和铝箔等)为原料制备锰酸锂(
、炭黑和铝箔等)为原料制备锰酸锂( )的流程如图所示。
)的流程如图所示。
回答下列问题:
(1)
 中Fe元素的化合价为
中Fe元素的化合价为(2)“碱浸”中发生反应的离子方程式为
(3)“浸取”中加入
 的作用为
的作用为(4)已知碳酸锂的分解温度为
 。当“焙烧”温度达到
。当“焙烧”温度达到 时,开始有
时,开始有 产生,可能的原因是
产生,可能的原因是 可以利用
可以利用 溶液与
溶液与 溶液反应制备,该反应中氧化剂与还原剂的物质的量之比为
溶液反应制备,该反应中氧化剂与还原剂的物质的量之比为(5)写出“焙烧”过程中生成锰酸锂的化学方程式
10 . 合成氨是人类科学技术发展史上的一项重大突破,研究表明液氨是一种良好的储氢物质。
(1)化学家GethardErtl证实了氢气与氮气在固体催化剂表面合成氨的过程,示意如图:

下列说法正确的是
A.①表示N2、H2分子中均是单键
B.②→③需要吸收能量
C.该过程表示了化学变化中包含旧化学键的断裂和新化学键的生成
(2)关于合成氨工艺的理解,下列错误的是
A.合成氨工业常采用的反应温度为500℃左右,可用勒夏特列原理解释
B.使用初始反应速率更快的催化剂Ru,不能提高平衡时NH3的产量
C.合成氨工业采用10MPa一30MPa的高压,是因常压下N2和H2的转化率不高
D.将合成后混合气体中的氨液化,剩余气体可以循环利用
(3)如图为合成氨反应在不同温度和压强、使用相同催化剂条件下,初始时氮气、氢气的体积比为1∶3时,平衡混合物中氨的体积分数[φ(NH3)]。

①若分别用vA(NH3)和vB(NH3)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(NH3)
②在250℃、1.0×104kPa下,N2的转化率为
(4)N2和H2在铁作催化剂作用下从145℃就开始反应,随着温度上升,单位时间内NH3产率增大,但温度高于900℃后,单位时间内NH3产率逐渐下降的原因
(5)研究表明金属催化剂可加速氨气的分解。下表为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率(mmol•min-1)。
催化剂 | Ru | Rh | Ni | Pt | Pd | Fe |
初始速率 | 7.9 | 4.0 | 3.0 | 2.2 | 1.8 | 0.5 |
①不同催化剂存在下,氨气分解反应活化能最大的是
②温度为T,在一体积固定的密闭容器中加入2molNH3,此时压强为P0,用Ru催化氨气分解,若平衡时氨气分解的转化率为50%,则该温度下反应2NH3(g) N2(g)+3H2(g)用平衡分压代替平衡浓度表示的化学平衡常数Kp=
N2(g)+3H2(g)用平衡分压代替平衡浓度表示的化学平衡常数Kp=



