名校
1 . 完成下列问题
(1)已知:①

 ②
②

则

___________ 。
(2)已知:①

 ②
②

则表示氨气燃烧热的热化学方程式为___________ ,该反应可设计为碱性条件下的燃料电池,负极电极反应式为___________ 。
(3)已知几种化学键的键能和热化学方程式如下:

 ,则a=
,则a=___________ 。
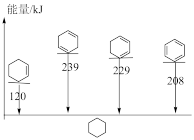
(4)4种不饱和烃分别与氢气发生加成反应生成1mol环己烷(
 )的能量变化如图所示。根据图示判断4种有机反应物中最稳定的是
)的能量变化如图所示。根据图示判断4种有机反应物中最稳定的是
___________ ;反应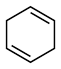 (l)=
(l)= 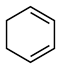 (l)的
(l)的

___________ 。
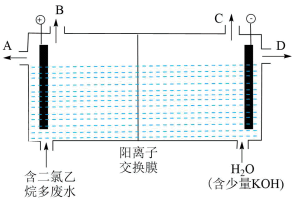
(5)用电解法处理有机废水是目前工业上一种常用手段,电解过程中阳极催化剂表面水被电解产生氧化性强的羟基自由基(
 ),羟基自由基再进一步把有机物氧化为无毒物质。下图为电解二氯乙烷废水的装置图,写出电解池阴极的电极反应式:
),羟基自由基再进一步把有机物氧化为无毒物质。下图为电解二氯乙烷废水的装置图,写出电解池阴极的电极反应式:
___________ ;羟基自由基与二氯乙烷反应的化学方程式为
___________ 。
(1)已知:①

 ②
②

则


(2)已知:①

 ②
②

则表示氨气燃烧热的热化学方程式为
(3)已知几种化学键的键能和热化学方程式如下:
| 化学键 |  |  |  |  |  |
键能/( ) ) | 391 | 193 | 243 | a | 432 |

 ,则a=
,则a=(4)4种不饱和烃分别与氢气发生加成反应生成1mol环己烷(
 )的能量变化如图所示。根据图示判断4种有机反应物中最稳定的是
)的能量变化如图所示。根据图示判断4种有机反应物中最稳定的是 (l)=
(l)=  (l)的
(l)的

(5)用电解法处理有机废水是目前工业上一种常用手段,电解过程中阳极催化剂表面水被电解产生氧化性强的羟基自由基(
 ),羟基自由基再进一步把有机物氧化为无毒物质。下图为电解二氯乙烷废水的装置图,写出电解池阴极的电极反应式:
),羟基自由基再进一步把有机物氧化为无毒物质。下图为电解二氯乙烷废水的装置图,写出电解池阴极的电极反应式:
您最近半年使用:0次
2023-10-26更新
|
539次组卷
|
6卷引用:河南省豫北名校2024届高三毕业班上学期一轮复习联考(二)化学试题
解题方法
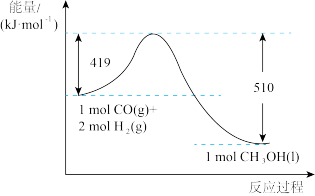
2 . (1)CH3OH是一种可燃性的液体。
已知:① CH3OH (g)+H2O (l)=CO2 (g)+3H2 (g);△H= +93.0KJ·mol-1
② CH3OH (g)+1/2O2 (g)=CO2 (g)+2H2 (g);△H=-192.9KJ·mol-1
③ CH3OH (g)= CH3OH (l);△H=-38.19KJ·mol-1
则表示CH3OH的燃烧热的热化学方程式为_____________
(2)燃料电池是符合绿色化学理念的新型发电装置,CH3OH—空气燃料电池是一种碱性(20%—30%的KOH溶液)燃料电池。电池放电时,负极的电极反应式为______________ 。
(3)右图是一个电解过程示意图,假设使用CH3OH—空气燃料电池作为本过程中的电源,其中a为电解液,X和Y是两块电极板。

①若X和Y均为惰性电极,a为一定浓度的硫酸铜溶液,通电后,Y极板上发生的电极反应式为:__________________ 。
②若X、Y分别为石墨和铜,a为CuSO4溶液,铜片的质量变化128g,则 CH3OH一空气燃料电池理论上消耗标准状况下的空气_____________ L(假设空气中氧气体积分数为20%)
(4)已知高锰酸钾能氧化甲醇,也能氧化草酸。查阅资料,乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸。
①请配平该反应的离子方程式:
______ MnO4-+______ H2C2O4+______ =____ Mn2++______ CO2↑+______ 。
②某兴趣小组同学将2.52 g草酸晶体(H2C2O4·2H2O)加入到100 mL 0.2 mol·L-1的NaOH溶液中充分反应,测得反应后溶液呈酸性,形成的溶液中各离子的浓度由大到小的顺序为___________________ (用离子符号表示)。
已知:① CH3OH (g)+H2O (l)=CO2 (g)+3H2 (g);△H= +93.0KJ·mol-1
② CH3OH (g)+1/2O2 (g)=CO2 (g)+2H2 (g);△H=-192.9KJ·mol-1
③ CH3OH (g)= CH3OH (l);△H=-38.19KJ·mol-1
则表示CH3OH的燃烧热的热化学方程式为
(2)燃料电池是符合绿色化学理念的新型发电装置,CH3OH—空气燃料电池是一种碱性(20%—30%的KOH溶液)燃料电池。电池放电时,负极的电极反应式为
(3)右图是一个电解过程示意图,假设使用CH3OH—空气燃料电池作为本过程中的电源,其中a为电解液,X和Y是两块电极板。

①若X和Y均为惰性电极,a为一定浓度的硫酸铜溶液,通电后,Y极板上发生的电极反应式为:
②若X、Y分别为石墨和铜,a为CuSO4溶液,铜片的质量变化128g,则 CH3OH一空气燃料电池理论上消耗标准状况下的空气
(4)已知高锰酸钾能氧化甲醇,也能氧化草酸。查阅资料,乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸。
①请配平该反应的离子方程式:
②某兴趣小组同学将2.52 g草酸晶体(H2C2O4·2H2O)加入到100 mL 0.2 mol·L-1的NaOH溶液中充分反应,测得反应后溶液呈酸性,形成的溶液中各离子的浓度由大到小的顺序为
您最近半年使用:0次
12-13高二上·贵州遵义·期末
3 . (14分)已知25℃、101kPa下,氢气、甲烷和葡萄糖的燃烧热依次为285.8 kJ/mol、890.3kJ/mol、2800 kJ/mol。
(1)0.1mol甲烷和0.2mol氢气组成的混合气体在25℃、101kPa下完全燃烧释放的热量为______ ;
(2)写出表示葡萄糖燃烧热的热化学方程式:_______________________ ;
(3)有人利用甲烷和氧气的反应设计成如图所示燃料电池,若使用酸性电解质溶液,则两极的电极反应式为:
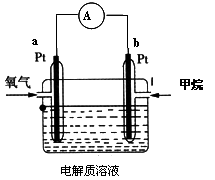
a极:__________ ,b极:___________________ ;
若使用碱性电解质溶液,则b极的电极反应式为:b极:_________________ ;
放电时电极a作____ 极,外电路中电流从____ 流向_____ ,电解质溶液中阳离子移向_______ 极;
(1)0.1mol甲烷和0.2mol氢气组成的混合气体在25℃、101kPa下完全燃烧释放的热量为
(2)写出表示葡萄糖燃烧热的热化学方程式:
(3)有人利用甲烷和氧气的反应设计成如图所示燃料电池,若使用酸性电解质溶液,则两极的电极反应式为:

a极:
若使用碱性电解质溶液,则b极的电极反应式为:b极:
放电时电极a作
您最近半年使用:0次
解题方法
4 . 下列关于氧化还原反应的叙述中,正确的是( )
| A.有单质参加的反应一定是氧化还原反应 |
| B.燃烧反应必须有氧气作氧化剂 |
C.2Fe+3Cl2 2FeCl3; Fe+S 2FeCl3; Fe+S FeS 由此可以判断氧化性:Cl2>S FeS 由此可以判断氧化性:Cl2>S |
| D.Mg在化学反应中失去2个电子,而Al在化学反应中失去3个电子,因此还原性Al>Mg |
您最近半年使用:0次
解题方法
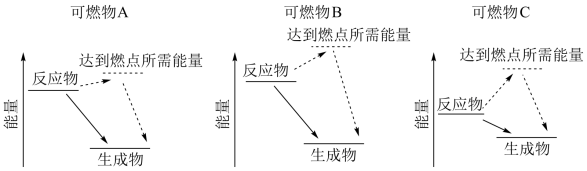
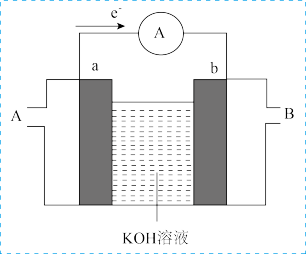
5 . 化学物质在汽车的动力、安全等方面有着极为重要的作用。
(1)某同学根据所查阅的资料,绘制了三种可燃物在空气中发生燃烧反应的能量变化示意图。根据示意图,你认为可燃物_______ (填“A”、“B”或“C”)更适合用作车用燃料。(已知:燃点是指在规定的条件下,应用外部热源使物质表面起火并持续燃烧一定时间所需的最低温度,燃点较低时存在安全隐患。)
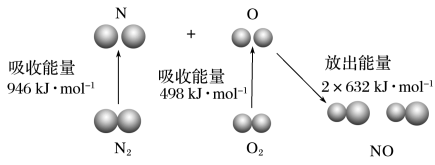
(2)汽车尾气中含有 、
、 等污染物。其中
等污染物。其中 生成过程的能量变化如图,由该图数据计算可得,该反应为
生成过程的能量变化如图,由该图数据计算可得,该反应为_______ (填“吸热”或“放热”)反应。
(3)通过 传感器可监测汽车尾气中
传感器可监测汽车尾气中 的含量,其工作原理如图所示:
的含量,其工作原理如图所示:
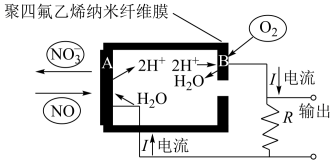
①A电极发生的是_______ 反应(填“氧化”或“还原”)。
②B电极反应为_______ 。
(4)电动汽车普遍使用锂离子电池。某锂离子电池反应为 。
。
①当有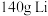 消耗时,电路中转移电子数目为
消耗时,电路中转移电子数目为_______ 。
②根据①的计算思路,分析 做电极优于
做电极优于 的原因是
的原因是_______ 。
(5)安全性是汽车发展需要解决的重要问题。汽车受到强烈撞击时,预置在安全气囊内的化学药剂发生反应产生大量气体,气囊迅速弹出。某种产气药剂主要含有 、
、 、
、 、
、 ,已知
,已知 在猛烈撞击时分解产生两种单质,并放出大量的热。
在猛烈撞击时分解产生两种单质,并放出大量的热。
①药剂中 做冷却剂原因是
做冷却剂原因是_______ 。
②根据产气药剂的组成,在设计气囊中所运用的化学反应时,需要考虑的角度有_______ (填标号)。
A.固体反应物的颜色 B.气体产物的毒性 C.反应的快慢 D.反应的能量变化
(1)某同学根据所查阅的资料,绘制了三种可燃物在空气中发生燃烧反应的能量变化示意图。根据示意图,你认为可燃物

(2)汽车尾气中含有
 、
、 等污染物。其中
等污染物。其中 生成过程的能量变化如图,由该图数据计算可得,该反应为
生成过程的能量变化如图,由该图数据计算可得,该反应为
(3)通过
 传感器可监测汽车尾气中
传感器可监测汽车尾气中 的含量,其工作原理如图所示:
的含量,其工作原理如图所示:
①A电极发生的是
②B电极反应为
(4)电动汽车普遍使用锂离子电池。某锂离子电池反应为
 。
。①当有
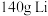 消耗时,电路中转移电子数目为
消耗时,电路中转移电子数目为②根据①的计算思路,分析
 做电极优于
做电极优于 的原因是
的原因是(5)安全性是汽车发展需要解决的重要问题。汽车受到强烈撞击时,预置在安全气囊内的化学药剂发生反应产生大量气体,气囊迅速弹出。某种产气药剂主要含有
 、
、 、
、 、
、 ,已知
,已知 在猛烈撞击时分解产生两种单质,并放出大量的热。
在猛烈撞击时分解产生两种单质,并放出大量的热。①药剂中
 做冷却剂原因是
做冷却剂原因是②根据产气药剂的组成,在设计气囊中所运用的化学反应时,需要考虑的角度有
A.固体反应物的颜色 B.气体产物的毒性 C.反应的快慢 D.反应的能量变化
您最近半年使用:0次
6 . 乙醇( )是重要的基本化工原料,可用于制造乙醛、乙烯等。某同学用弹式热量计(结构如图所示)按以下实验步骤来测量
)是重要的基本化工原料,可用于制造乙醛、乙烯等。某同学用弹式热量计(结构如图所示)按以下实验步骤来测量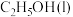 的摩尔燃烧焓。
的摩尔燃烧焓。
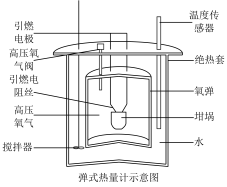
a.用电子天平称量1400.00g纯水,倒入内筒中;
b.用电子天平称量1.00g苯甲酸,置于氧弹内的坩埚上,与点火丝保持微小距离;
c.将试样装入氧弹内,用氧气排空气再注满高纯氧气;
d.打开搅拌器开关,读取纯水温度,当温度不再改变时,记为初始温度;
e.当纯水温度保持不变时,打开引燃电极,读取并记录内筒最高水温;
f.重复实验4次,所得数据如表:
g.用电子天平称量 替换苯甲酸,重复上述实验,测得内筒温度改变的平均值为
替换苯甲酸,重复上述实验,测得内筒温度改变的平均值为 ,
,
已知:① 苯甲酸完全燃烧放出
苯甲酸完全燃烧放出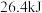 热量;
热量;
②查阅资料得知常温常压时,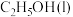 的燃烧热
的燃烧热 。
。
(1)搅拌器适宜的材质为__________ (填标号);氧弹的材质为不锈钢,原因是__________ (答一点即可);氧弹内注满过量高纯氧气的目的是_______ 。
A.铜 B.银 C.陶瓷 D.玻璃纤维
(2)苯甲酸完全燃烧,弹式热量计内筒升高的温度平均为_________  ,该热量绝热套内水温升高
,该热量绝热套内水温升高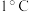 需要的热量为
需要的热量为_____________  。
。
(3)通过以上实验可换算出 完全燃烧放出的热量为
完全燃烧放出的热量为_________ (精确至0.1) ,测得的数据与实际的有偏差的可能原因是
,测得的数据与实际的有偏差的可能原因是________ (填标号)。
a.点燃乙醇时,引燃电阻丝工作时间比引燃苯甲酸的时间更长
b.乙醇未完全燃烧
c.苯甲酸实际质量大于
d.苯甲酸未完全燃烧
 )是重要的基本化工原料,可用于制造乙醛、乙烯等。某同学用弹式热量计(结构如图所示)按以下实验步骤来测量
)是重要的基本化工原料,可用于制造乙醛、乙烯等。某同学用弹式热量计(结构如图所示)按以下实验步骤来测量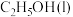 的摩尔燃烧焓。
的摩尔燃烧焓。
a.用电子天平称量1400.00g纯水,倒入内筒中;
b.用电子天平称量1.00g苯甲酸,置于氧弹内的坩埚上,与点火丝保持微小距离;
c.将试样装入氧弹内,用氧气排空气再注满高纯氧气;
d.打开搅拌器开关,读取纯水温度,当温度不再改变时,记为初始温度;
e.当纯水温度保持不变时,打开引燃电极,读取并记录内筒最高水温;
f.重复实验4次,所得数据如表:
实验序号 | 初始温度/℃ | 最高水温/℃ |
① | 25.00 | 28.01 |
② | 24.50 | 27.49 |
③ | 25.55 | 28.55 |
④ | 24.00 | 28.42 |
 替换苯甲酸,重复上述实验,测得内筒温度改变的平均值为
替换苯甲酸,重复上述实验,测得内筒温度改变的平均值为 ,
,已知:①
 苯甲酸完全燃烧放出
苯甲酸完全燃烧放出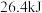 热量;
热量;②查阅资料得知常温常压时,
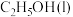 的燃烧热
的燃烧热 。
。(1)搅拌器适宜的材质为
A.铜 B.银 C.陶瓷 D.玻璃纤维
(2)苯甲酸完全燃烧,弹式热量计内筒升高的温度平均为
 ,该热量绝热套内水温升高
,该热量绝热套内水温升高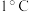 需要的热量为
需要的热量为 。
。(3)通过以上实验可换算出
 完全燃烧放出的热量为
完全燃烧放出的热量为 ,测得的数据与实际的有偏差的可能原因是
,测得的数据与实际的有偏差的可能原因是a.点燃乙醇时,引燃电阻丝工作时间比引燃苯甲酸的时间更长
b.乙醇未完全燃烧
c.苯甲酸实际质量大于

d.苯甲酸未完全燃烧
您最近半年使用:0次
2023-11-08更新
|
85次组卷
|
2卷引用:吉林省部分名校2023-2024学年高二上学期10月联考化学试题
名校
7 . 完成下列问题
(1)已知:①

②

则

___________ 。
(2)已知:①

②

则表示氨气燃烧热的热化学方程式为___________ ,该反应可设计为碱性条件下的燃料电池,负极电极反应式为___________ 。
(3)已知几种化学键的键能和热化学方程式如下:

 ,则a=
,则a=___________ 。
(4)4种不饱和烃分别与氢气发生加成反应生成1mol环己烷(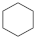 )的能量变化如图所示。根据图示判断4种有机反应物中最稳定的是
)的能量变化如图所示。根据图示判断4种有机反应物中最稳定的是___________ ;反应 (l)=
(l)= (l)的
(l)的
___________ 。

(1)已知:①


②


则


(2)已知:①


②


则表示氨气燃烧热的热化学方程式为
(3)已知几种化学键的键能和热化学方程式如下:
| 化学键 |  |  |  |  |  |
键能/( ) ) | 391 | 193 | 243 | a | 432 |

 ,则a=
,则a=(4)4种不饱和烃分别与氢气发生加成反应生成1mol环己烷(
 )的能量变化如图所示。根据图示判断4种有机反应物中最稳定的是
)的能量变化如图所示。根据图示判断4种有机反应物中最稳定的是 (l)=
(l)= (l)的
(l)的

您最近半年使用:0次
名校
解题方法
8 . 能源是国民经济发展的重要基础,如何合理利用现有能源以及开发新能源一直是研究的重点课题。
(1)根据如图所示的转化关系判断, 和
和 反应生成
反应生成 的反应为
的反应为___________ (填“吸热”或“放热”)反应,
___________ 。
(2)已知反应
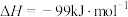 ,此反应中相关的化学键键能(“
,此反应中相关的化学键键能(“ ”表示
”表示 的化学键)数据如下:
的化学键)数据如下:
则X=___________  。
。
(3)如果将燃料燃烧设计成燃料电池就可使化学能转化为电能,某种燃料电池的工作原理示意如图所示,a、b均为惰性电极。
①使用时,空气从___________ 口通入(填“A”或“B”);正极的电极反应式为___________ 。
②假设使用的“燃料”是甲烷 ,a极的电极反应式为
,a极的电极反应式为___________ 。放电一段时间后,电解质溶液的碱性___________ (填“增强”、“减弱”或“不变”)。
(4)在25℃、 时,
时,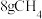 完全燃烧生成液态水时放出的热量是
完全燃烧生成液态水时放出的热量是 。写出
。写出 燃烧的热化学反应方程式
燃烧的热化学反应方程式___________ 。理想状态下,甲烷燃料电池消耗 所能产生的最大电能为
所能产生的最大电能为 ,则该燃料电池的理论效率(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比)为
,则该燃料电池的理论效率(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比)为___________ %。
(1)根据如图所示的转化关系判断,
 和
和 反应生成
反应生成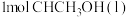 的反应为
的反应为

(2)已知反应

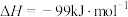 ,此反应中相关的化学键键能(“
,此反应中相关的化学键键能(“ ”表示
”表示 的化学键)数据如下:
的化学键)数据如下:| 化学键 |  |  |  |  |  |
 | 436 | 343 | 1076 | 465 |  |
 。
。(3)如果将燃料燃烧设计成燃料电池就可使化学能转化为电能,某种燃料电池的工作原理示意如图所示,a、b均为惰性电极。

①使用时,空气从
②假设使用的“燃料”是甲烷
 ,a极的电极反应式为
,a极的电极反应式为(4)在25℃、
 时,
时,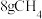 完全燃烧生成液态水时放出的热量是
完全燃烧生成液态水时放出的热量是 。写出
。写出 燃烧的热化学反应方程式
燃烧的热化学反应方程式 所能产生的最大电能为
所能产生的最大电能为 ,则该燃料电池的理论效率(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比)为
,则该燃料电池的理论效率(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比)为
您最近半年使用:0次
9 . 中国的能源特点是“多煤、少油、缺气”,因此“煤制合成天然气(SNG)”合成技术对我国资源合理利用、节能减排具有重要意义。
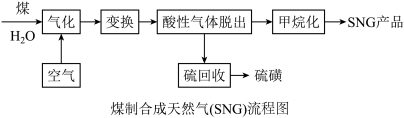
(1)煤主要由碳、氢、氧、硫等元素组成,下列碳及其化合物的性质与用途具有对应关系的是_______
(2)煤、石油、天然气均属于化石燃料,是不可再生资源。下列关于化石燃料的说法不正确 的是_______
(3)已知:几种物质的标准燃烧热如下表所示
①写出能表示 标准燃烧热的热化学方程式:
标准燃烧热的热化学方程式:_______ 。
②燃烧等质量的上述几种物质,放出热量最多得是_______ 。
③气化过程中,需向炭层交替喷入空气和水蒸气,请从能量利用的角度分析喷入空气的目的是_______ 。
(4)一种“酸性气体脱出”并回收硫的技术如下:
第一步,用 溶液吸收
溶液吸收 ;
;
第二步,在 时,用
时,用 溶液氧化NaHS回收单质硫,同时产生
溶液氧化NaHS回收单质硫,同时产生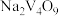 。
。
①第二步发生的反应离子方程式为_______ 。
②脱出 速度主要取决于第二步反应的速率,则反应速率:
速度主要取决于第二步反应的速率,则反应速率: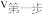
_______  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。

(1)煤主要由碳、氢、氧、硫等元素组成,下列碳及其化合物的性质与用途具有对应关系的是_______
| A.炭能燃烧,可用作除味剂 | B.CO具有还原性,可用于铁的冶炼 |
C. 易溶于水,可用于去除油污 易溶于水,可用于去除油污 | D. 能与碱反应,可用于烘焙糕点 能与碱反应,可用于烘焙糕点 |
| A.甲烷是天然气的主要成分,它是一种高效而洁净的燃料 |
| B.石油的分馏是化学变化 |
| C.石油通过催化裂化过程可获得汽油、煤油等轻质油 |
| D.煤的气化是把煤转化为可燃性气体的过程,该过程属于化学变化 |
 |  |  | |
标准燃烧热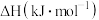 | -393.5 | -283 | -285.8 |
①写出能表示
 标准燃烧热的热化学方程式:
标准燃烧热的热化学方程式:②燃烧等质量的上述几种物质,放出热量最多得是
③气化过程中,需向炭层交替喷入空气和水蒸气,请从能量利用的角度分析喷入空气的目的是
(4)一种“酸性气体脱出”并回收硫的技术如下:
第一步,用
 溶液吸收
溶液吸收 ;
;第二步,在
 时,用
时,用 溶液氧化NaHS回收单质硫,同时产生
溶液氧化NaHS回收单质硫,同时产生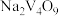 。
。①第二步发生的反应离子方程式为
②脱出
 速度主要取决于第二步反应的速率,则反应速率:
速度主要取决于第二步反应的速率,则反应速率: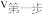
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
您最近半年使用:0次
名校
10 . 硼单质及其化合物有重要的应用。硼晶体熔点为2076℃,可形成多种卤化物。 可与
可与 反应生成
反应生成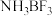 。
。 可与
可与 反应生成乙硼烷
反应生成乙硼烷 (标准燃烧热为
(标准燃烧热为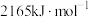 ),其分子中一个硼与周围的四个氢形成正四面体,结构式为
),其分子中一个硼与周围的四个氢形成正四面体,结构式为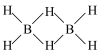 ,具有还原性。乙硼烷易水解生成
,具有还原性。乙硼烷易水解生成 与
与 ,
, 是一种一元弱酸,可作吸水剂。乙硼烷可与
是一种一元弱酸,可作吸水剂。乙硼烷可与 反应生成氨硼烷(
反应生成氨硼烷(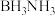 ),其在一定条件下可以脱氢,最终得到BN。乙硼烷也可与NaH反应生成
),其在一定条件下可以脱氢,最终得到BN。乙硼烷也可与NaH反应生成 ,是一种常用的还原剂。下列化学反应表示正确的是
,是一种常用的还原剂。下列化学反应表示正确的是
 可与
可与 反应生成
反应生成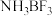 。
。 可与
可与 反应生成乙硼烷
反应生成乙硼烷 (标准燃烧热为
(标准燃烧热为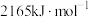 ),其分子中一个硼与周围的四个氢形成正四面体,结构式为
),其分子中一个硼与周围的四个氢形成正四面体,结构式为 ,具有还原性。乙硼烷易水解生成
,具有还原性。乙硼烷易水解生成 与
与 ,
, 是一种一元弱酸,可作吸水剂。乙硼烷可与
是一种一元弱酸,可作吸水剂。乙硼烷可与 反应生成氨硼烷(
反应生成氨硼烷(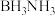 ),其在一定条件下可以脱氢,最终得到BN。乙硼烷也可与NaH反应生成
),其在一定条件下可以脱氢,最终得到BN。乙硼烷也可与NaH反应生成 ,是一种常用的还原剂。下列化学反应表示正确的是
,是一种常用的还原剂。下列化学反应表示正确的是A.乙硼烷的制备: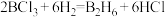 |
B.乙硼烷的水解: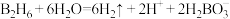 |
C.乙硼烷的燃烧: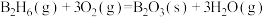  |
D.乙硼烷酸性条件下还原乙酸: |
您最近半年使用:0次
2023-11-13更新
|
336次组卷
|
4卷引用:江苏省苏州市2023-2024学年高三上学期11月期中考试化学试题



