名校
解题方法
1 . I.碰撞理论指出,一定温度下,气体的平均能量一定,但每个气体分子的能量大小不同。
(1)通常把具有足够能量,能够发生___________的分子称为活化分子。
(2)标况下,恒容密闭容器内不同 分子的能量与数目的分布情况如下图表示,其中阴影部分代表活化分子:
分子的能量与数目的分布情况如下图表示,其中阴影部分代表活化分子:
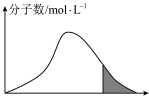
若升高温度,图像将最有可能变成(选填下图中的序号,下同)___________ ;若再继续充入适量 气体,图像将最有可能变成
气体,图像将最有可能变成___________ 。
A. B.
B. C.
C.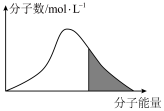
Ⅱ.甲醇除了可以用作燃料外,还可以用于燃料电池中。燃料电池是一种连续地将燃料和氧化剂的化学能直接转化为电能的化学电源。
(3)标况下﹐液态甲醇的燃烧热为-727 。请写出表示甲醇燃烧热的热化学方程式:
。请写出表示甲醇燃烧热的热化学方程式:___________ 。
(4)在甲醇燃料电池中,将甲醇和空气分别通入两个电极,电解质溶液为KOH溶液,则负极的电极反应式为:___________ 。
(1)通常把具有足够能量,能够发生___________的分子称为活化分子。
| A.真实碰撞 | B.活化碰撞 | C.有效碰撞 | D.连续碰撞 |
(2)标况下,恒容密闭容器内不同
 分子的能量与数目的分布情况如下图表示,其中阴影部分代表活化分子:
分子的能量与数目的分布情况如下图表示,其中阴影部分代表活化分子:
若升高温度,图像将最有可能变成(选填下图中的序号,下同)
 气体,图像将最有可能变成
气体,图像将最有可能变成A.
 B.
B. C.
C.
Ⅱ.甲醇除了可以用作燃料外,还可以用于燃料电池中。燃料电池是一种连续地将燃料和氧化剂的化学能直接转化为电能的化学电源。
(3)标况下﹐液态甲醇的燃烧热为-727
 。请写出表示甲醇燃烧热的热化学方程式:
。请写出表示甲醇燃烧热的热化学方程式:(4)在甲醇燃料电池中,将甲醇和空气分别通入两个电极,电解质溶液为KOH溶液,则负极的电极反应式为:
您最近一年使用:0次
2 . “绿水青山就是金山银山”,近年来,绿色发展、生态保护成为中国的新名片.
Ⅰ.已知25℃和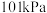 下:
下:
①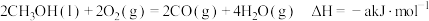
②
③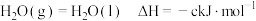
(1)表示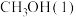 燃烧热的热化学方程式为
燃烧热的热化学方程式为_________________________________ 。
Ⅱ. 和
和 在一定条件下反应可制得合成气,在
在一定条件下反应可制得合成气,在 密闭容器中分别通入
密闭容器中分别通入 和
和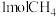 ,发生反应:
,发生反应:
(2)该反应在___________ (填“高温”或“低温”)条件下能自发进行
(3)下列能判断 达到平衡状态的是___________(填序号).
达到平衡状态的是___________(填序号).
Ⅲ.如图所示组成闭合回路,其中甲装置以 和为原料新型电池,稀土金属材料为电极,以熔融碳酸盐为电解质;乙装置中a、b为石墨,b极上有红色物质析出
和为原料新型电池,稀土金属材料为电极,以熔融碳酸盐为电解质;乙装置中a、b为石墨,b极上有红色物质析出
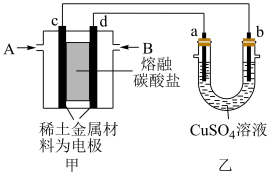
(4)装置中气体A为___________ (填“ ”或“
”或“ 和
和 ”),d极上的电极反应式为
”),d极上的电极反应式为___________ .
(5)乙装置中a极上的电极反应式为_________________________________ .
Ⅳ.工业上可用丙烯加成法制备1,2-二氯丙烷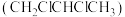 ,主要副产物为3-氯丙烯
,主要副产物为3-氯丙烯 ,反应原理为:
,反应原理为:
①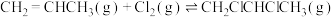
②
一定温度下,向恒容密闭容器中充入等物质的量的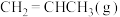 和
和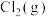 发生反应,容器内气体的压强随时间的变化如表所示:
发生反应,容器内气体的压强随时间的变化如表所示:
(6)用单位时间内气体分压的变化表示反应①的反应速率,即 ;则前
;则前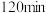 内平均反应速率
内平均反应速率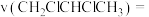
_____________________ .
(7)该温度下,若平衡时 的体积分数为
的体积分数为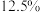 ,反应①的平衡常数
,反应①的平衡常数
___________  (
( 为以分压表示的平衡常数,保留小数点后2位).
为以分压表示的平衡常数,保留小数点后2位).
Ⅰ.已知25℃和
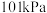 下:
下:①
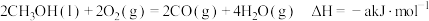
②

③
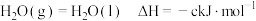
(1)表示
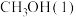 燃烧热的热化学方程式为
燃烧热的热化学方程式为Ⅱ.
 和
和 在一定条件下反应可制得合成气,在
在一定条件下反应可制得合成气,在 密闭容器中分别通入
密闭容器中分别通入 和
和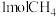 ,发生反应:
,发生反应:
(2)该反应在
(3)下列能判断
 达到平衡状态的是___________(填序号).
达到平衡状态的是___________(填序号).| A.一定温度下,容积固定的容器中,密度保持不变 |
| B.容积固定的绝热容器中,温度保持不变 |
| C.一定温度和容积固定的容器中,平均相对分子质量不变 |
D. 和 和 的物质的量之比不再改变 的物质的量之比不再改变 |
Ⅲ.如图所示组成闭合回路,其中甲装置以
 和为原料新型电池,稀土金属材料为电极,以熔融碳酸盐为电解质;乙装置中a、b为石墨,b极上有红色物质析出
和为原料新型电池,稀土金属材料为电极,以熔融碳酸盐为电解质;乙装置中a、b为石墨,b极上有红色物质析出
(4)装置中气体A为
 ”或“
”或“ 和
和 ”),d极上的电极反应式为
”),d极上的电极反应式为(5)乙装置中a极上的电极反应式为
Ⅳ.工业上可用丙烯加成法制备1,2-二氯丙烷
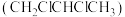 ,主要副产物为3-氯丙烯
,主要副产物为3-氯丙烯 ,反应原理为:
,反应原理为:①
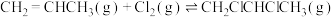
②

一定温度下,向恒容密闭容器中充入等物质的量的
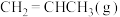 和
和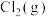 发生反应,容器内气体的压强随时间的变化如表所示:
发生反应,容器内气体的压强随时间的变化如表所示:时间/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
压强/kPa | 80 | 74.2 | 69.2 | 65.2 | 61.6 | 57.6 | 57.6 |
(6)用单位时间内气体分压的变化表示反应①的反应速率,即
 ;则前
;则前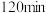 内平均反应速率
内平均反应速率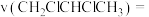
(7)该温度下,若平衡时
 的体积分数为
的体积分数为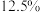 ,反应①的平衡常数
,反应①的平衡常数
 (
( 为以分压表示的平衡常数,保留小数点后2位).
为以分压表示的平衡常数,保留小数点后2位).
您最近一年使用:0次
3 . Ⅰ.已知下列热化学方程式:
①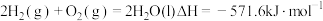
②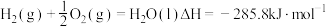
③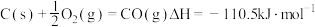
④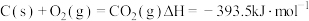
回答下列问题:
(1)上述反应中属于放热反应的是_______ (填序号)。
(2) 的燃烧热为
的燃烧热为_______ 。
(3)写出 燃烧热的热化学方程式
燃烧热的热化学方程式_______ 。
Ⅱ.室温下,有浓度均为 的下列五种溶液,请回答问题。
的下列五种溶液,请回答问题。
① ②
② ③
③ ④
④ ⑤
⑤
资料:室温下电离平衡常数,醋酸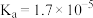 ;碳酸
;碳酸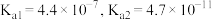 。
。
(4)上述溶液中水的电离被抑制的是_______ (填序号),溶液⑤中溶质与水作用的离子方程式表示为_______ 。
(5)上述②④⑤溶液的 由大到小的顺序为
由大到小的顺序为_______ (填序号)。
(6)比较溶液③和④中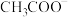 的物质的量浓度:③
的物质的量浓度:③_______ ④(4)(填“<”、“=”或“>”)。
(7)向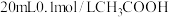 溶液中滴加
溶液中滴加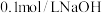 溶液的过程中,
溶液的过程中, 变化如图所示。
变化如图所示。
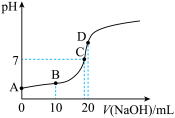
①滴加过程中发生反应的离子方程式是_______ 。
②列说法正确的是_______ 。
a. A、C两点水的电离程度:
b.B点溶液中微粒浓度满足:
c.D点溶液中微粒浓度满足: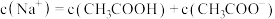
①
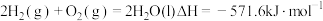
②
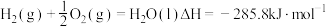
③
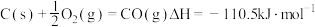
④
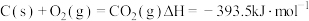
回答下列问题:
(1)上述反应中属于放热反应的是
(2)
 的燃烧热为
的燃烧热为(3)写出
 燃烧热的热化学方程式
燃烧热的热化学方程式Ⅱ.室温下,有浓度均为
 的下列五种溶液,请回答问题。
的下列五种溶液,请回答问题。①
 ②
② ③
③ ④
④ ⑤
⑤
资料:室温下电离平衡常数,醋酸
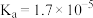 ;碳酸
;碳酸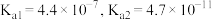 。
。(4)上述溶液中水的电离被抑制的是
(5)上述②④⑤溶液的
 由大到小的顺序为
由大到小的顺序为(6)比较溶液③和④中
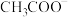 的物质的量浓度:③
的物质的量浓度:③(7)向
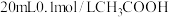 溶液中滴加
溶液中滴加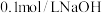 溶液的过程中,
溶液的过程中, 变化如图所示。
变化如图所示。
①滴加过程中发生反应的离子方程式是
②列说法正确的是
a. A、C两点水的电离程度:

b.B点溶液中微粒浓度满足:

c.D点溶液中微粒浓度满足:
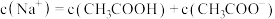
您最近一年使用:0次
名校
解题方法
4 . 某实验小组同学对电化学原理进行了一系列探究活动。回答下列问题:
Ⅰ、可作燃料的物质有甲烷、肼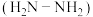 等,燃料电池结构如图所示。
等,燃料电池结构如图所示。
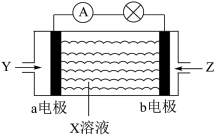
(1)在常温下,甲烷的燃烧热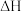 为
为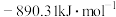 ,写出甲烷燃烧的热化学方程式:
,写出甲烷燃烧的热化学方程式:_____ 。
(2)若 溶液为
溶液为 溶液,
溶液, 发生氧化反应,则
发生氧化反应,则 为
为_____ (填“甲烷”或“氧气”),a电极的电极反应式为_____ 。
(3)若用肼作燃料,负极的电极反应式为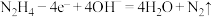 。
。
根据上述肼的电极反应式, 可能是
可能是_____ (填“ ”或“
”或“ ”)。
”)。
Ⅱ、
(4)下图为该实验小组设计的原电池装置,Fe电极发生_____ (填“氧化”或“还原”)反应。反应前,两电极质量相等,一段时间后,两电极质量相差24g,则导线中通过_____ mol电子。
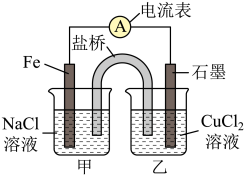
(5)其他条件不变,若将CuCl2溶液换为NH4Cl溶液,则石墨电极的电极反应式为_____ ,该电池电流由_____ (填“铁”或“石墨”,下同)电极经外电路流向_____ 电极。
Ⅰ、可作燃料的物质有甲烷、肼
 等,燃料电池结构如图所示。
等,燃料电池结构如图所示。
(1)在常温下,甲烷的燃烧热
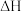 为
为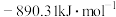 ,写出甲烷燃烧的热化学方程式:
,写出甲烷燃烧的热化学方程式:(2)若
 溶液为
溶液为 溶液,
溶液, 发生氧化反应,则
发生氧化反应,则 为
为(3)若用肼作燃料,负极的电极反应式为
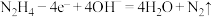 。
。根据上述肼的电极反应式,
 可能是
可能是 ”或“
”或“ ”)。
”)。Ⅱ、
(4)下图为该实验小组设计的原电池装置,Fe电极发生

(5)其他条件不变,若将CuCl2溶液换为NH4Cl溶液,则石墨电极的电极反应式为
您最近一年使用:0次
名校
5 . I.50mL0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液在图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
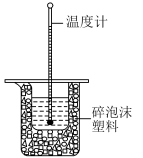
(1)从实验装置上看,图中尚缺少的一种玻璃用品是________ 。
(2)实验中改用60mL0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量_______ (填“相等”、“不相等”),所求中和热______ 。(填“相等”、“不相等”)
(3)化学反应中的能量变化,通常主要表现为热量的变化。下列反应中,属于放热反应的是_____ (填序号)。
a.Ba(OH)2·8H2O与NH4Cl混合搅拌 b.高温煅烧石灰石 c.铝与盐酸反应
(4)已知N2(g)+2O2(g)=2 NO2(g) ΔH =+67.7 kJ·mol-1
N2H4(g)+O2(g)= N2(g)+2H2O (l) ΔH =-534 kJ·mol-1
根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式___________ 。
Ⅱ.CO、SO2、NO均为大气污染物,通过下列反应可以实现可持续发展。已知:
①2CO(g)+SO2(g)=S(g)+2CO2(g) ΔH=+8.0kJ/mol-1
②2H2(g)+SO2(g)=S(g)+2H2O(g) ΔH=+90.4kJ·mol -1
③2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH=-746.5kJ·mol -1
请回答:
(5)反应①属于______  填“吸热”或“放热”
填“吸热”或“放热” 反应。
反应。
(6)反应②生成0.5mol S(g)时,ΔH=________ 。
(7)反应③消耗30g NO(g)时,ΔH=________ 。

(1)从实验装置上看,图中尚缺少的一种玻璃用品是
(2)实验中改用60mL0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量
(3)化学反应中的能量变化,通常主要表现为热量的变化。下列反应中,属于放热反应的是
a.Ba(OH)2·8H2O与NH4Cl混合搅拌 b.高温煅烧石灰石 c.铝与盐酸反应
(4)已知N2(g)+2O2(g)=2 NO2(g) ΔH =+67.7 kJ·mol-1
N2H4(g)+O2(g)= N2(g)+2H2O (l) ΔH =-534 kJ·mol-1
根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式
Ⅱ.CO、SO2、NO均为大气污染物,通过下列反应可以实现可持续发展。已知:
①2CO(g)+SO2(g)=S(g)+2CO2(g) ΔH=+8.0kJ/mol-1
②2H2(g)+SO2(g)=S(g)+2H2O(g) ΔH=+90.4kJ·mol -1
③2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH=-746.5kJ·mol -1
请回答:
(5)反应①属于
 填“吸热”或“放热”
填“吸热”或“放热” 反应。
反应。(6)反应②生成0.5mol S(g)时,ΔH=
(7)反应③消耗30g NO(g)时,ΔH=
您最近一年使用:0次
2024-02-02更新
|
107次组卷
|
2卷引用:四川省泸州市泸县第一中学2023-2024学年高二上学期1月期末化学试题
解题方法
6 . 甲醇是重要的化工原料,应用前景广阔。研究表明,二氧化碳与氢气可以合成甲醇:

一般认为可通过如下两个步骤来实现:
步骤①

步骤②
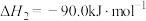
(1)
__________  ,该反应在
,该反应在__________ 条件下能自发进行(填“高温”、“低温”、“任意温度”)。
(2)步骤①为慢反应,下列示意图中能体现上述反应能量变化的是__________。
(3)在恒温恒压条件下,若 和
和 的物质的量之比为
的物质的量之比为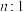 ,相应平衡体系中
,相应平衡体系中 的物质的量分数为x,请在下图中绘制x随n变化的示意图
的物质的量分数为x,请在下图中绘制x随n变化的示意图__________ (不考虑副反应)

(4)恒压条件下,按 和
和 的物质的量之比为
的物质的量之比为 投料,发生反应Ⅰ、Ⅱ。实验测得
投料,发生反应Ⅰ、Ⅱ。实验测得 的平衡转化率和平衡时
的平衡转化率和平衡时 的选择性随温度的变化如下图所示。
的选择性随温度的变化如下图所示。
Ⅰ.

Ⅱ.

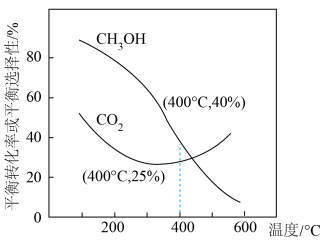
已知: 的选择性=
的选择性= ×100%
×100%
①下列能说明体系已达到平衡状态的是__________ 。
A.混合气体的密度不再变化
B.混合气体的总压强不再变化
C. 的物质的量不再变化
的物质的量不再变化
②温度高于300℃时, 平衡转化率随温度升高而上升的原因:
平衡转化率随温度升高而上升的原因:__________ 。
(5)常温常压下,甲醇作为燃料,每 完全燃烧生成二氧化碳和水时放出的热量为
完全燃烧生成二氧化碳和水时放出的热量为 ,请写出甲醇燃烧热的热化学方程式
,请写出甲醇燃烧热的热化学方程式__________ 。


一般认为可通过如下两个步骤来实现:
步骤①


步骤②

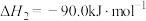
(1)

 ,该反应在
,该反应在(2)步骤①为慢反应,下列示意图中能体现上述反应能量变化的是__________。
A.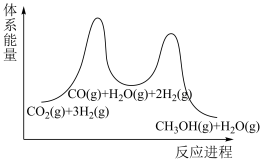 | B.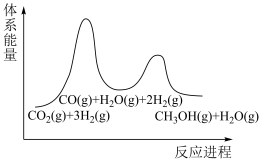 | C.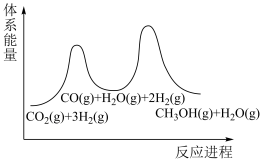 | D.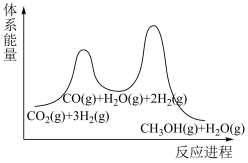 |
(3)在恒温恒压条件下,若
 和
和 的物质的量之比为
的物质的量之比为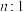 ,相应平衡体系中
,相应平衡体系中 的物质的量分数为x,请在下图中绘制x随n变化的示意图
的物质的量分数为x,请在下图中绘制x随n变化的示意图
(4)恒压条件下,按
 和
和 的物质的量之比为
的物质的量之比为 投料,发生反应Ⅰ、Ⅱ。实验测得
投料,发生反应Ⅰ、Ⅱ。实验测得 的平衡转化率和平衡时
的平衡转化率和平衡时 的选择性随温度的变化如下图所示。
的选择性随温度的变化如下图所示。Ⅰ.


Ⅱ.



已知:
 的选择性=
的选择性= ×100%
×100%①下列能说明体系已达到平衡状态的是
A.混合气体的密度不再变化
B.混合气体的总压强不再变化
C.
 的物质的量不再变化
的物质的量不再变化②温度高于300℃时,
 平衡转化率随温度升高而上升的原因:
平衡转化率随温度升高而上升的原因:(5)常温常压下,甲醇作为燃料,每
 完全燃烧生成二氧化碳和水时放出的热量为
完全燃烧生成二氧化碳和水时放出的热量为 ,请写出甲醇燃烧热的热化学方程式
,请写出甲醇燃烧热的热化学方程式
您最近一年使用:0次
7 . Ⅰ.次磷酸 具有较强的还原性,可用于制药工业。
具有较强的还原性,可用于制药工业。
(1) 是一元酸,25℃时,
是一元酸,25℃时, 。写出其电离方程式:
。写出其电离方程式:___________ 。
(2)用电渗析法制备 的工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过)。
的工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过)。
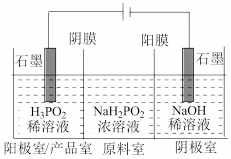
①写出阴极的电极反应:___________ 。
② 的移动方向是:
的移动方向是: 移向
移向___________ (填“阴极室”或“原料室”)。
③阳极室得到 ,
, 的浓度逐渐增大。
的浓度逐渐增大。
a.结合电极反应说明其原因是___________ 。
b.该方法得到的产品 溶液中会混有
溶液中会混有 。产生
。产生 的原因是
的原因是___________ 。
Ⅱ.氢能是极具发展潜力的清洁能源,以氢燃料为代表的燃料电池有良好的应用前景。
(3)298K时,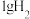 燃烧生成
燃烧生成 放热121kJ,
放热121kJ,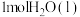 蒸发吸热44kJ,表示
蒸发吸热44kJ,表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为___________ 。
(4)氢氧燃料电池中氢气在___________ (填“正”或“负”)极发生反应。
(5)在允许 自由迁移的固体电解质燃料电池中,
自由迁移的固体电解质燃料电池中,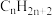 放电的电极反应式为
放电的电极反应式为___________ 。
(6)甲醇燃料电池中,吸附在催化剂表面的甲醇分子逐步脱氢得到CO,四步可能脱氢产物及其相对能量如图,则最可行途径为a→___________ (用b~j等代号表示)。

 具有较强的还原性,可用于制药工业。
具有较强的还原性,可用于制药工业。(1)
 是一元酸,25℃时,
是一元酸,25℃时, 。写出其电离方程式:
。写出其电离方程式:(2)用电渗析法制备
 的工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过)。
的工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过)。
①写出阴极的电极反应:
②
 的移动方向是:
的移动方向是: 移向
移向③阳极室得到
 ,
, 的浓度逐渐增大。
的浓度逐渐增大。a.结合电极反应说明其原因是
b.该方法得到的产品
 溶液中会混有
溶液中会混有 。产生
。产生 的原因是
的原因是Ⅱ.氢能是极具发展潜力的清洁能源,以氢燃料为代表的燃料电池有良好的应用前景。
(3)298K时,
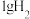 燃烧生成
燃烧生成 放热121kJ,
放热121kJ,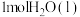 蒸发吸热44kJ,表示
蒸发吸热44kJ,表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为(4)氢氧燃料电池中氢气在
(5)在允许
 自由迁移的固体电解质燃料电池中,
自由迁移的固体电解质燃料电池中,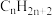 放电的电极反应式为
放电的电极反应式为(6)甲醇燃料电池中,吸附在催化剂表面的甲醇分子逐步脱氢得到CO,四步可能脱氢产物及其相对能量如图,则最可行途径为a→

您最近一年使用:0次
解题方法
8 . 近日内蒙古自治区发布了“十四五”氢能发展规划,全力冲刺氢能产业新赛道。高纯氢的制备是目前的研究热点,包括氢的制备、储存和应用三个环节。
(1)适量 燃烧生成
燃烧生成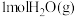 ,释放出
,释放出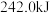 的热量,已知
的热量,已知 的键能为
的键能为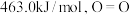 的键能为
的键能为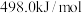 ,则
,则 的键能为
的键能为___________  。又已知
。又已知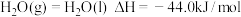 ,请写出表示
,请写出表示 燃烧热的热化学方程式
燃烧热的热化学方程式___________ 。
(2)2023年6月我国首个万吨级新能源制氢项目成功在内蒙古产出第一方“绿氢”。以光伏制氢为氢源,利用太阳能光解水制备 ,下图为水在半导体光催化剂中发生光催化反应的原理示意图。
,下图为水在半导体光催化剂中发生光催化反应的原理示意图。
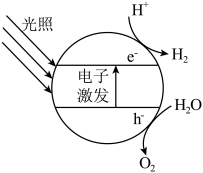
根据图中信息分析:光照催化分解水的能量转化形式为:光能→___________ ;若将该催化剂置于 溶液中,产物之一为
溶液中,产物之一为 ,写出生成另一产物的电极反应
,写出生成另一产物的电极反应___________ 。
(3)氢能的储存是氢能利用的前提,科学家研究出一种储氢合金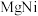 ,已知:
,已知:
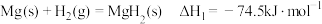

则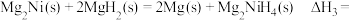
___________ 
(4)2024-2025年内蒙古加速推进氢能发展,预计推广燃料电池汽车10000辆,建成加氢站90座。某氢氧燃料电池的内部结构如下图:

通入气体a的电极为___________ (填“正极”或“负极”),若以 作为电解质溶液,则通入气体b的电极方程式为
作为电解质溶液,则通入气体b的电极方程式为___________ 。
(1)适量
 燃烧生成
燃烧生成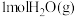 ,释放出
,释放出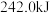 的热量,已知
的热量,已知 的键能为
的键能为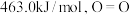 的键能为
的键能为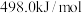 ,则
,则 的键能为
的键能为 。又已知
。又已知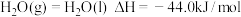 ,请写出表示
,请写出表示 燃烧热的热化学方程式
燃烧热的热化学方程式(2)2023年6月我国首个万吨级新能源制氢项目成功在内蒙古产出第一方“绿氢”。以光伏制氢为氢源,利用太阳能光解水制备
 ,下图为水在半导体光催化剂中发生光催化反应的原理示意图。
,下图为水在半导体光催化剂中发生光催化反应的原理示意图。
根据图中信息分析:光照催化分解水的能量转化形式为:光能→
 溶液中,产物之一为
溶液中,产物之一为 ,写出生成另一产物的电极反应
,写出生成另一产物的电极反应(3)氢能的储存是氢能利用的前提,科学家研究出一种储氢合金
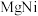 ,已知:
,已知: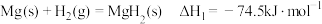

则
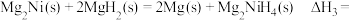

(4)2024-2025年内蒙古加速推进氢能发展,预计推广燃料电池汽车10000辆,建成加氢站90座。某氢氧燃料电池的内部结构如下图:

通入气体a的电极为
 作为电解质溶液,则通入气体b的电极方程式为
作为电解质溶液,则通入气体b的电极方程式为
您最近一年使用:0次
名校
解题方法
9 . 甲烷是最简单的烃,可用来作为燃料,也是一种重要的化工原料。
(1) A.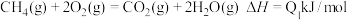
B.
C.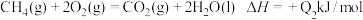
D.
上述热化学方程式中的反应热能正确表示甲烷燃烧热的是___________ 。
(2)以甲烷为原料通过以下反应可以合成甲醇: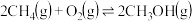
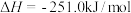
现将 和
和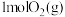 充入密闭容器中,在不同温度和压强下进行上述反应。实验测得平衡时甲醇的物质的量随温度、压强的变化如图所示:
充入密闭容器中,在不同温度和压强下进行上述反应。实验测得平衡时甲醇的物质的量随温度、压强的变化如图所示:
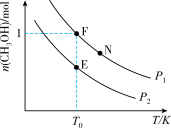
① 时升高温度,
时升高温度,
___________ (填“增大”、“减小”或“不变”);
___________  (填“>”、“<”或“=”);
(填“>”、“<”或“=”);
②E、F、N点对应的化学反应速率由大到小的顺序为___________ (用 表示);
表示);
③下列能提高 平衡转化率的措施是
平衡转化率的措施是___________ (填序号);
a.选择高效催化剂 b.增大 投料比 c.及时分离产物
投料比 c.及时分离产物
④若 点,
点, ,总压强为
,总压强为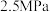 ,则
,则 时
时 点用分压强代替浓度表示的平衡常数
点用分压强代替浓度表示的平衡常数
___________ 。
(1) A.
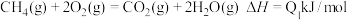
B.

C.
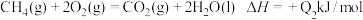
D.

上述热化学方程式中的反应热能正确表示甲烷燃烧热的是
(2)以甲烷为原料通过以下反应可以合成甲醇:
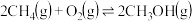
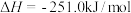
现将
 和
和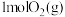 充入密闭容器中,在不同温度和压强下进行上述反应。实验测得平衡时甲醇的物质的量随温度、压强的变化如图所示:
充入密闭容器中,在不同温度和压强下进行上述反应。实验测得平衡时甲醇的物质的量随温度、压强的变化如图所示:
①
 时升高温度,
时升高温度,

 (填“>”、“<”或“=”);
(填“>”、“<”或“=”);②E、F、N点对应的化学反应速率由大到小的顺序为
 表示);
表示);③下列能提高
 平衡转化率的措施是
平衡转化率的措施是a.选择高效催化剂 b.增大
 投料比 c.及时分离产物
投料比 c.及时分离产物④若
 点,
点, ,总压强为
,总压强为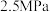 ,则
,则 时
时 点用分压强代替浓度表示的平衡常数
点用分压强代替浓度表示的平衡常数
您最近一年使用:0次
2023-12-15更新
|
222次组卷
|
3卷引用:吉林省通化市梅河口市第五中学2023-2024学年高三上学期1月期末化学试题
名校
解题方法
10 . 完成下列问题
(1)煤油的主要成分为C12H26,已知34g C12H26完全燃烧生成气态水时放出1386.2kJ热量;
 。则表示煤油燃烧热的热化学方程式为
。则表示煤油燃烧热的热化学方程式为___________ 。
(2)已知甲烷能催化还原NO2,得到氮气、二氧化碳和水蒸气,且知反应消耗1.6 g甲烷时,放出热量86.7 kJ,写出甲烷催化还原NO2的热化学方程式___________ 。
(3)已知:N2(g)+O2(g) 2NO(g) ΔH1=+180.5kJ•mol﹣1
2NO(g) ΔH1=+180.5kJ•mol﹣1
C(s)+O2(g) CO2(g) ΔH2=﹣393.5kJ•mol﹣1
CO2(g) ΔH2=﹣393.5kJ•mol﹣1
2C(s)+O2(g) 2CO(g) ΔH3=﹣221.0kJ•mol﹣1
2CO(g) ΔH3=﹣221.0kJ•mol﹣1
请写出NO和CO生成N2和CO2的热化学方程式___________ 。
(4)利用如图所示装置测定中和热的实验步骤如下,回答下列问题:

步骤一:用量筒量取100mL 0.50mol·L-1盐酸倒入小烧杯中,测出盐酸温度;
步骤二:用另一量筒量取100mL 0.55mol·L-1 NaOH溶液,并用同一温度计测出其温度;
步骤三:将NaOH和盐酸溶液一并倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。
①仪器a的名称是___________ 。
②配制100mL 0.55mol/L的氢氧化钠溶液,需要用到的仪器有托盘天平(附砝码)、烧杯、药匙、镊子、玻璃棒、量筒、胶头滴管以及___________ 。
③倒入NaOH和盐酸溶液的正确操作是___________ (填字母)。
A.沿玻璃棒缓慢倒入 B.分三次倒入
C.一次迅速倒入 D.一边搅拌一边滴入
④假设盐酸和氢氧化钠溶液的密度都是1g·cm-3,又知中和反应后生成溶液的比热容c=4.18J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:依据该学生的实验数据计算,该实验测得的中和热ΔH=___________ (结果保留一位小数)。
⑤该同学通过实验测出的中和热有误差,造成这一结果的原因不可能的是 ___________ 。
A.实验装置保温、隔热效果差
B.用量筒量取盐酸时仰视读数
C.分多次将NaOH溶液倒入小烧杯中
D.用测量盐酸的温度计直接测定NaOH溶液的温度
(1)煤油的主要成分为C12H26,已知34g C12H26完全燃烧生成气态水时放出1386.2kJ热量;

 。则表示煤油燃烧热的热化学方程式为
。则表示煤油燃烧热的热化学方程式为(2)已知甲烷能催化还原NO2,得到氮气、二氧化碳和水蒸气,且知反应消耗1.6 g甲烷时,放出热量86.7 kJ,写出甲烷催化还原NO2的热化学方程式
(3)已知:N2(g)+O2(g)
 2NO(g) ΔH1=+180.5kJ•mol﹣1
2NO(g) ΔH1=+180.5kJ•mol﹣1C(s)+O2(g)
 CO2(g) ΔH2=﹣393.5kJ•mol﹣1
CO2(g) ΔH2=﹣393.5kJ•mol﹣12C(s)+O2(g)
 2CO(g) ΔH3=﹣221.0kJ•mol﹣1
2CO(g) ΔH3=﹣221.0kJ•mol﹣1请写出NO和CO生成N2和CO2的热化学方程式
(4)利用如图所示装置测定中和热的实验步骤如下,回答下列问题:

步骤一:用量筒量取100mL 0.50mol·L-1盐酸倒入小烧杯中,测出盐酸温度;
步骤二:用另一量筒量取100mL 0.55mol·L-1 NaOH溶液,并用同一温度计测出其温度;
步骤三:将NaOH和盐酸溶液一并倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。
①仪器a的名称是
②配制100mL 0.55mol/L的氢氧化钠溶液,需要用到的仪器有托盘天平(附砝码)、烧杯、药匙、镊子、玻璃棒、量筒、胶头滴管以及
③倒入NaOH和盐酸溶液的正确操作是
A.沿玻璃棒缓慢倒入 B.分三次倒入
C.一次迅速倒入 D.一边搅拌一边滴入
④假设盐酸和氢氧化钠溶液的密度都是1g·cm-3,又知中和反应后生成溶液的比热容c=4.18J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:依据该学生的实验数据计算,该实验测得的中和热ΔH=
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠溶液 | 混合溶液 | |
| 1 | 20.0 | 20.2 | 23.3 |
| 2 | 20.2 | 20.4 | 23.5 |
| 3 | 20.3 | 20.5 | 25.6 |
A.实验装置保温、隔热效果差
B.用量筒量取盐酸时仰视读数
C.分多次将NaOH溶液倒入小烧杯中
D.用测量盐酸的温度计直接测定NaOH溶液的温度
您最近一年使用:0次
2023-10-30更新
|
156次组卷
|
3卷引用:四川省泸州市四川省泸县第五中学2023-2024学年高二上学期1月期末化学试题



