1 . 工业废气中的硫化氢是一种无色有毒的气体。根据硫化氢的性质,可采取不同的处理方法。
(1)氧化法(克劳斯法),其原理是:
H2S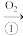 SO2
SO2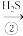 S
S
S(s)+O2(g)=SO2(g) ∆H=-297kJ·mol-1
第②步反应的热化学方程式为___________ 。
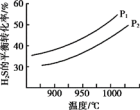
(2)热分解法,其原理是:2H2S(g) S2(?)+2H2(g)。不同温度和压强下,H2S的平衡转化率变化如图。P1
S2(?)+2H2(g)。不同温度和压强下,H2S的平衡转化率变化如图。P1___________ P2(填“>”或“<”),原因是___________ 。
(3)直接电解法,可回收S和H2。

资料:
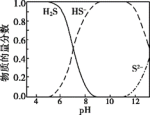
ⅰ.H2S溶液中含硫微粒的物质的量分数随pH变化如图。
ⅱ.(x-1)S+S2− S
S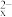 (黄色溶液);S
(黄色溶液);S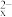 与酸反应生成S。
与酸反应生成S。
①直接电解H2S酸性溶液(pH≈5),容易出现电解反应不能持续进行的情况,结合电极反应式分析其可能的原因___________ 。
②工业上,常用烧碱吸收H2S,将吸收后的溶液(pH=13.2)先进行电解,再用电解后的黄色溶液吸收H2S生成S。反应生成S的离子方程式是___________ 。
(4)间接电解法。先用FeCl3溶液吸收含H2S的工业废气,所得溶液用惰性电极进行电解。
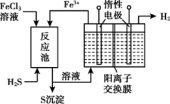
①反应池中发生反应的离子方程式是___________ 。
②该装置实验有两个显著优点:a.H2S的原子利用率100%;b.___________ 。
(5)碱性溶液吸收法。
已知:25℃时,H2S的电离常数Ka1=9.1×10-8、Ka2=1.1×10-12;H2CO3的电离常数Ka1=4.3×10-7、Ka2=5.6×10-11。用Na2CO3溶液吸收含H2S的工业废气,反应的离子方程式是___________ 。
(1)氧化法(克劳斯法),其原理是:
H2S
 SO2
SO2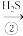 S
S已知:2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) ΔH=-1172kJ·mol-1
S(s)+O2(g)=SO2(g) ∆H=-297kJ·mol-1
第②步反应的热化学方程式为
(2)热分解法,其原理是:2H2S(g)
 S2(?)+2H2(g)。不同温度和压强下,H2S的平衡转化率变化如图。P1
S2(?)+2H2(g)。不同温度和压强下,H2S的平衡转化率变化如图。P1
(3)直接电解法,可回收S和H2。

资料:
ⅰ.H2S溶液中含硫微粒的物质的量分数随pH变化如图。

ⅱ.(x-1)S+S2−
 S
S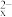 (黄色溶液);S
(黄色溶液);S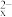 与酸反应生成S。
与酸反应生成S。①直接电解H2S酸性溶液(pH≈5),容易出现电解反应不能持续进行的情况,结合电极反应式分析其可能的原因
②工业上,常用烧碱吸收H2S,将吸收后的溶液(pH=13.2)先进行电解,再用电解后的黄色溶液吸收H2S生成S。反应生成S的离子方程式是
(4)间接电解法。先用FeCl3溶液吸收含H2S的工业废气,所得溶液用惰性电极进行电解。

①反应池中发生反应的离子方程式是
②该装置实验有两个显著优点:a.H2S的原子利用率100%;b.
(5)碱性溶液吸收法。
已知:25℃时,H2S的电离常数Ka1=9.1×10-8、Ka2=1.1×10-12;H2CO3的电离常数Ka1=4.3×10-7、Ka2=5.6×10-11。用Na2CO3溶液吸收含H2S的工业废气,反应的离子方程式是
您最近一年使用:0次
2 .  的转化有助于实现碳循环和碳减排。
的转化有助于实现碳循环和碳减排。
(1)工业用 和
和 在一定条件下分两步反应生产尿素
在一定条件下分两步反应生产尿素 ,其能量变化示意图如下:
,其能量变化示意图如下:
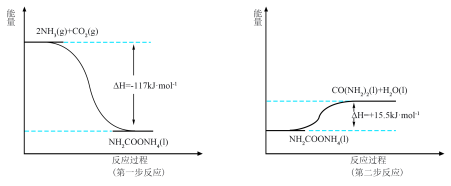
合成尿素总反应的热化学方程式是___________ 。
(2)近年科学家提出“绿色自由”构想。 与
与 在300℃、
在300℃、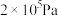 的条件下可生成甲醇,不同温度下,在
的条件下可生成甲醇,不同温度下,在 恒容密闭容器中充入
恒容密闭容器中充入 和
和 ,相同时间内测得
,相同时间内测得 的转化率随温度的变化如图所示:
的转化率随温度的变化如图所示:
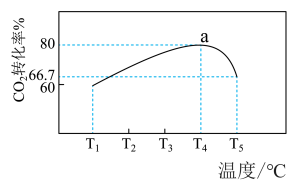
① 阶段温度升高
阶段温度升高 的转化率下降,该反应的
的转化率下降,该反应的
_____ 0(填“ ”或“
”或“ ”),理由是
”),理由是_______ 。
②计算温度为 时a点的平衡常数为
时a点的平衡常数为_______ 。
(3)利用电催化可将 同时转化为多种有机燃料,其原理如图所示。
同时转化为多种有机燃料,其原理如图所示。
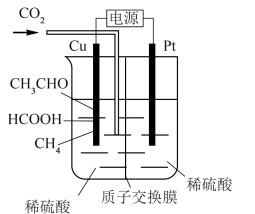
①铜电极上产生 的电极反应式为
的电极反应式为_______ 。
②若铜电极上只生成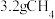 ,则有
,则有____ 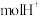 通过质子交换膜。
通过质子交换膜。
③在实际生产中当 过低时,有机燃料产率降低,可能的原因是
过低时,有机燃料产率降低,可能的原因是________ 。
 的转化有助于实现碳循环和碳减排。
的转化有助于实现碳循环和碳减排。(1)工业用
 和
和 在一定条件下分两步反应生产尿素
在一定条件下分两步反应生产尿素 ,其能量变化示意图如下:
,其能量变化示意图如下:
合成尿素总反应的热化学方程式是
(2)近年科学家提出“绿色自由”构想。
 与
与 在300℃、
在300℃、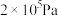 的条件下可生成甲醇,不同温度下,在
的条件下可生成甲醇,不同温度下,在 恒容密闭容器中充入
恒容密闭容器中充入 和
和 ,相同时间内测得
,相同时间内测得 的转化率随温度的变化如图所示:
的转化率随温度的变化如图所示:
①
 阶段温度升高
阶段温度升高 的转化率下降,该反应的
的转化率下降,该反应的
 ”或“
”或“ ”),理由是
”),理由是②计算温度为
 时a点的平衡常数为
时a点的平衡常数为(3)利用电催化可将
 同时转化为多种有机燃料,其原理如图所示。
同时转化为多种有机燃料,其原理如图所示。
①铜电极上产生
 的电极反应式为
的电极反应式为②若铜电极上只生成
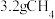 ,则有
,则有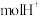 通过质子交换膜。
通过质子交换膜。③在实际生产中当
 过低时,有机燃料产率降低,可能的原因是
过低时,有机燃料产率降低,可能的原因是
您最近一年使用:0次
解题方法
3 . 丙烯是应用广泛的化工原料,工业上两种利用丙烷制备丙烯的反应如下:
I.丙烷直接脱氢: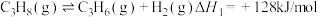
II.氧化丙烷脱氢: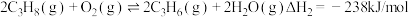
回答下列问题:
(1)反应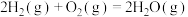 ∆H=
∆H=___________ kJ∙mol-1。
(2)一定条件下,向1L实验容器中充入1mol气态C3H8发生反应Ⅰ。其中主要副反应为:III.丙烷裂解: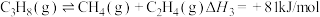 。下图为测得不同温度下C3H6的平衡产率:
。下图为测得不同温度下C3H6的平衡产率:
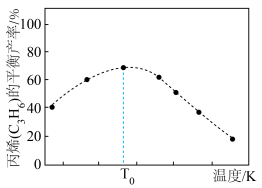
温度高于T0,C3H6的平衡产率随温度升高而减小的原因是___________ 。
(3)运用丙烷直接脱氢法,在相同温度和催化剂条件下,体积均为0.5L的恒容密闭容器中只发生反应I,测得反应的有关数据如下:
①容器a达到平衡时C3H8(g)的平衡浓度为c(C3H8)=___________ ,平衡常数为___________ 。
②容器b经过5分钟达到平衡,则用C3H8(g)表示化学反应速率v(C3H8)=___________ ,反应吸收热量Q为___________ kJ。
③容器c达到平衡时,反应对外___________ (填吸收或放出)热量。
I.丙烷直接脱氢:
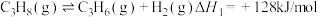
II.氧化丙烷脱氢:
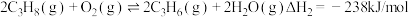
回答下列问题:
(1)反应
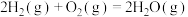 ∆H=
∆H=(2)一定条件下,向1L实验容器中充入1mol气态C3H8发生反应Ⅰ。其中主要副反应为:III.丙烷裂解:
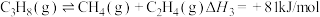 。下图为测得不同温度下C3H6的平衡产率:
。下图为测得不同温度下C3H6的平衡产率:
温度高于T0,C3H6的平衡产率随温度升高而减小的原因是
(3)运用丙烷直接脱氢法,在相同温度和催化剂条件下,体积均为0.5L的恒容密闭容器中只发生反应I,测得反应的有关数据如下:
| 容器 编号 | 起始时各物质物质的量/mol | 达平衡时体系的能量变化 | ||
| C3H8(g) | C3H6(g) | H2(g) | ||
| a | 0 | 1 | 1 | 放热32kJ |
| b | 1 | 0 | 0 | 吸热QkJ |
| c | 0.2 | 0.8 | 0.8 | ∆Hc |
②容器b经过5分钟达到平衡,则用C3H8(g)表示化学反应速率v(C3H8)=
③容器c达到平衡时,反应对外
您最近一年使用:0次
4 .  和
和 是两种造成温室效应的主要气体,高温下可发生干重整反应进行综合利用,反应过程的能量变化如图所示:
是两种造成温室效应的主要气体,高温下可发生干重整反应进行综合利用,反应过程的能量变化如图所示:
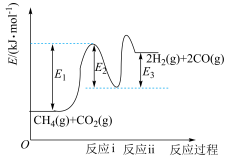
(1)干重整主反应的热化学方程式为_____ (用 、
、 、
、 表示反应热),反应速率由反应决定
表示反应热),反应速率由反应决定_____ (填“ⅰ”或“ⅱ”)。
(2)反应器中还同时存在副反应: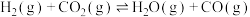
①下图表示投料比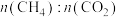 为
为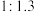 时,不同温度下的反应结果,下列说法中正确的是
时,不同温度下的反应结果,下列说法中正确的是_____ 。(填字母)
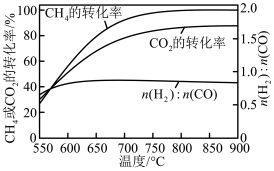
A.加压有利于增大 和
和 反应的速率但不利于提高二者的平衡转化率
反应的速率但不利于提高二者的平衡转化率
B.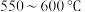 ,升温更有利于主反应,主反应先达到平衡
,升温更有利于主反应,主反应先达到平衡
C.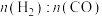 始终低于
始终低于 ,与副反应有关
,与副反应有关
②体系中会发生积炭反应
 ,为研究其热效应,还需要利用反应
,为研究其热效应,还需要利用反应_____ 的 。
。
③添加一定量的载氧剂 ,可避免积炭反应发生,增大
,可避免积炭反应发生,增大 的值,推测可能发生的反应,写出化学反应方程式
的值,推测可能发生的反应,写出化学反应方程式_____ 。
(3)文献中指出 和
和 可以发生反应生成
可以发生反应生成 和
和 ,且反应进行程度较大,但干重整反应器中进行程度小。结合键能数据,从平衡角度阐明理由
,且反应进行程度较大,但干重整反应器中进行程度小。结合键能数据,从平衡角度阐明理由_____ 。
 和
和 是两种造成温室效应的主要气体,高温下可发生干重整反应进行综合利用,反应过程的能量变化如图所示:
是两种造成温室效应的主要气体,高温下可发生干重整反应进行综合利用,反应过程的能量变化如图所示:
(1)干重整主反应的热化学方程式为
 、
、 、
、 表示反应热),反应速率由反应决定
表示反应热),反应速率由反应决定(2)反应器中还同时存在副反应:
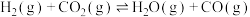
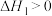
①下图表示投料比
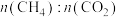 为
为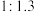 时,不同温度下的反应结果,下列说法中正确的是
时,不同温度下的反应结果,下列说法中正确的是
A.加压有利于增大
 和
和 反应的速率但不利于提高二者的平衡转化率
反应的速率但不利于提高二者的平衡转化率B.
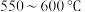 ,升温更有利于主反应,主反应先达到平衡
,升温更有利于主反应,主反应先达到平衡C.
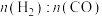 始终低于
始终低于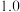 ,与副反应有关
,与副反应有关②体系中会发生积炭反应

 ,为研究其热效应,还需要利用反应
,为研究其热效应,还需要利用反应 。
。③添加一定量的载氧剂
 ,可避免积炭反应发生,增大
,可避免积炭反应发生,增大 的值,推测可能发生的反应,写出化学反应方程式
的值,推测可能发生的反应,写出化学反应方程式(3)文献中指出
 和
和 可以发生反应生成
可以发生反应生成 和
和 ,且反应进行程度较大,但干重整反应器中进行程度小。结合键能数据,从平衡角度阐明理由
,且反应进行程度较大,但干重整反应器中进行程度小。结合键能数据,从平衡角度阐明理由| 化学键 | 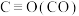 |  |  |  |
键能 | 1072 | 436 | 413 | 464 |
您最近一年使用:0次
5 . 氯苯是工业废水中的常见污染物,将其降解或资源化转化在能源利用、环境保护等方面意义重大。通常,废水中氯苯的处理过程为:

资料:25℃、101kPa时,氯苯、邻苯二酚燃烧反应的热化学方程式如下:
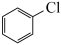 (l)
(l)
 (s)
(s)
(1)25℃、101kPa时,在催化剂作用下,氯苯与 、
、 反应生成邻苯二酚和
反应生成邻苯二酚和 的热化学方程式为
的热化学方程式为___________ 。
(2)可用于检验转化ii后是否有邻苯二酚剩余的试剂为___________ 。
(3)传统处理工艺常用空气将废水中的氯苯吹出,所得空气、氯苯的混合气体通过催化剂表面完成转化i,所得产物在实验条件下均为气态。其他条件不变时,增大通入废水的空气流速,废水中氯苯去除率提高;但i中氯苯的转化率降低。氯苯转化率降低的可能原因是___________ (填字母)。
a.单位时间内通过催化剂表面的混合气体变少
b.混合气体在催化剂表面反应的时间变短
c.i中转化反应的化学平衡常数变小
(4)我国科研人员开发了一种电化学装置(如图),可在更温和的条件下实现转化i、ii。
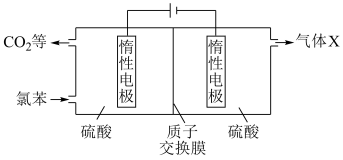
①阳极区发生的电极反应为:___________ 。(补充不完整的反应)

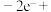 □___________=
□___________= +□___________+□___________
+□___________+□___________


②资料:电解效率
一定时间内,阴极共得到44.8L气体X(标准状况), 。若阳极区
。若阳极区 (
( )=5%,所有邻苯二酚完全转化为
)=5%,所有邻苯二酚完全转化为 ,则
,则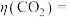
___________ 。
③一段时间后,阴极区溶液pH保持不变,结合化学用语解释其原因:___________ 。

资料:25℃、101kPa时,氯苯、邻苯二酚燃烧反应的热化学方程式如下:
 (l)
(l)
 (s)
(s)
(1)25℃、101kPa时,在催化剂作用下,氯苯与
 、
、 反应生成邻苯二酚和
反应生成邻苯二酚和 的热化学方程式为
的热化学方程式为(2)可用于检验转化ii后是否有邻苯二酚剩余的试剂为
(3)传统处理工艺常用空气将废水中的氯苯吹出,所得空气、氯苯的混合气体通过催化剂表面完成转化i,所得产物在实验条件下均为气态。其他条件不变时,增大通入废水的空气流速,废水中氯苯去除率提高;但i中氯苯的转化率降低。氯苯转化率降低的可能原因是
a.单位时间内通过催化剂表面的混合气体变少
b.混合气体在催化剂表面反应的时间变短
c.i中转化反应的化学平衡常数变小
(4)我国科研人员开发了一种电化学装置(如图),可在更温和的条件下实现转化i、ii。

①阳极区发生的电极反应为:

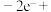 □___________=
□___________= +□___________+□___________
+□___________+□___________

②资料:电解效率

一定时间内,阴极共得到44.8L气体X(标准状况),
 。若阳极区
。若阳极区 (
( )=5%,所有邻苯二酚完全转化为
)=5%,所有邻苯二酚完全转化为 ,则
,则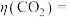
③一段时间后,阴极区溶液pH保持不变,结合化学用语解释其原因:
您最近一年使用:0次
名校
6 . 载人航天工程对科学研究及太空资源开发具有重要意义,载人航天器必须给航天员提供基本的生存条件,其中涉及氧气再生、二氧化碳清除、水处理以及食物供给等。
(1)氢氧燃料电池是短寿命载人航天器电源的一个合适的选择。下图是一种碱性氢氧燃料电池结构示意图。
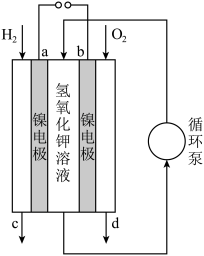
①电池的正极是___________ (填“a”或“b”),该电极上发生的电极反应是___________ 。
②电池工作时产生的水会以水蒸气的形式被反应物气体带出,在出口加装冷凝器可以将水回收。冷凝器应装在出口___________ (填“c”或“d”)处。
③电池工作时,电解质溶液会因稀释及吸收 而变质,此时电解质溶液的
而变质,此时电解质溶液的 将
将___________ (填“升高”或“降低”)。通过循环泵可及时浓缩或更换变质的溶液,维特电池的正常工作。
(2)我国自行研制的“神舟”飞船使用了镍镉蓄电池组,其充放电时发生的反应为: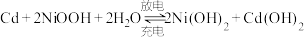 ,其电池装置如图所示,阴离子交换膜两侧均注入
,其电池装置如图所示,阴离子交换膜两侧均注入 溶液。
溶液。
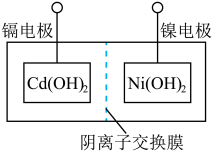
①下列对于该镍镉电池的分析中,正确的是___________ 。
A.图示中的电池应先充电后,再使用
B.充电时, 从镍电极区迁移进入镉电极区
从镍电极区迁移进入镉电极区
C.放电时,镍电极为电池的负极,镉电极为电池的正极
D.充电或放电一段时间后,两电极区溶液中 的物质的量均未改变
的物质的量均未改变
②镍镉电池在充电时,镉电极上发生的电极反应为___________ ;当 和
和 耗尽后仍继续充电,则会在电极发生副反应而造成安全隐患,称为电池过充电。此时镉电极上将生成气体
耗尽后仍继续充电,则会在电极发生副反应而造成安全隐患,称为电池过充电。此时镉电极上将生成气体___________ (填化学式);镍电极上则会发生反应___________ (填电极反应式)而产生 。
。
(3)载人航天器中氧气的再生是一个重要环节。利用萨巴蒂尔反应可将人呼出的二氧化碳转化为甲烷和水,配合太阳能电解水可以实现氧气的再生(大体流程如下图)。
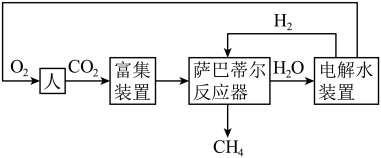
已知:

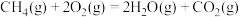
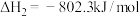
萨巴蒂尔反应: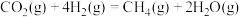

①萨巴蒂尔反应的焓变
___________ 。
②电解水装置中 产生于
产生于___________ (填“正”、“负”、“阴”或“阳”)极。
③通过巴萨尔反应器和电解水装置能否实现H2与 的完全再生?
的完全再生?___________ (填“能”或“否”)
(1)氢氧燃料电池是短寿命载人航天器电源的一个合适的选择。下图是一种碱性氢氧燃料电池结构示意图。

①电池的正极是
②电池工作时产生的水会以水蒸气的形式被反应物气体带出,在出口加装冷凝器可以将水回收。冷凝器应装在出口
③电池工作时,电解质溶液会因稀释及吸收
 而变质,此时电解质溶液的
而变质,此时电解质溶液的 将
将(2)我国自行研制的“神舟”飞船使用了镍镉蓄电池组,其充放电时发生的反应为:
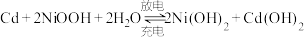 ,其电池装置如图所示,阴离子交换膜两侧均注入
,其电池装置如图所示,阴离子交换膜两侧均注入 溶液。
溶液。
①下列对于该镍镉电池的分析中,正确的是
A.图示中的电池应先充电后,再使用
B.充电时,
 从镍电极区迁移进入镉电极区
从镍电极区迁移进入镉电极区C.放电时,镍电极为电池的负极,镉电极为电池的正极
D.充电或放电一段时间后,两电极区溶液中
 的物质的量均未改变
的物质的量均未改变②镍镉电池在充电时,镉电极上发生的电极反应为
 和
和 耗尽后仍继续充电,则会在电极发生副反应而造成安全隐患,称为电池过充电。此时镉电极上将生成气体
耗尽后仍继续充电,则会在电极发生副反应而造成安全隐患,称为电池过充电。此时镉电极上将生成气体 。
。(3)载人航天器中氧气的再生是一个重要环节。利用萨巴蒂尔反应可将人呼出的二氧化碳转化为甲烷和水,配合太阳能电解水可以实现氧气的再生(大体流程如下图)。

已知:


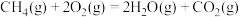
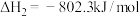
萨巴蒂尔反应:
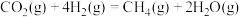

①萨巴蒂尔反应的焓变

②电解水装置中
 产生于
产生于③通过巴萨尔反应器和电解水装置能否实现H2与
 的完全再生?
的完全再生?
您最近一年使用:0次
名校
解题方法
7 . CO2在自然界碳循环中起着重要作用,合理利用CO2是当今科学研究的前沿。
(1)蓝色碳汇技术:利用海洋生物吸收大气中的CO2,将其固定在海洋中。

①海水的CO295%以 形式存在,写出CO2溶于水产生
形式存在,写出CO2溶于水产生 的方程式
的方程式__________ 。
②珊瑚虫是海洋中的一种腔肠动物,经钙化作用可以形成石灰石外壳,示意图如上。写出钙化作用的离子方程式____________________ 。
(2)用CO2生产绿色燃料甲醇:
①用CO2生产绿色燃料甲醇时发生反应A:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
已知:2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) △H=-1365.0kJ/mol
H2(g)+ O2(g)=H2O(g) △H=-241.8kJ/mol
O2(g)=H2O(g) △H=-241.8kJ/mol
则反应A的热化学方程式为___________________________ 。
②在体积为1L的恒容密闭容器中发生反应A,下图为不同投料[n(CO2)和n(H2)分别为1mol,3mol;lmol,6mol]下,CO2平衡转化率随X(温度或压强)的变化曲线。
Ⅰ.曲线a对应的投料是___________ 。
Ⅱ.判断X代表的物理量是______ ,简述理由____________________ 。
Ⅲ.x1时,曲线b对应的化学平衡常数是______________ 。
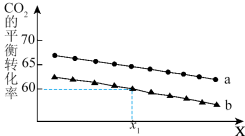
Ⅳ.将CO2和H2按物质的量比1:3混合,以固定流速通过盛放Cu/Zn/Al/Zr催化剂的反应器,在相同时间内,不同温度下的实验数据如下图所示。
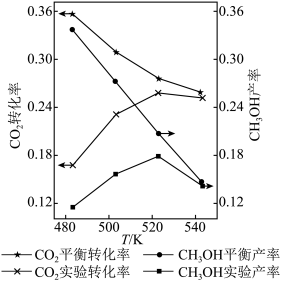
已知:CH3OH产率=
ⅰ.催化剂活性最好的温度为___ (填字母序号)。
a.483K b.503K c.523K d.543K
ⅱ.温度由523K升到543K,CO2的平衡转化率和CH3OH的实验产率均降低,解释原因:____________ 。
(1)蓝色碳汇技术:利用海洋生物吸收大气中的CO2,将其固定在海洋中。

①海水的CO295%以
 形式存在,写出CO2溶于水产生
形式存在,写出CO2溶于水产生 的方程式
的方程式②珊瑚虫是海洋中的一种腔肠动物,经钙化作用可以形成石灰石外壳,示意图如上。写出钙化作用的离子方程式
(2)用CO2生产绿色燃料甲醇:
①用CO2生产绿色燃料甲醇时发生反应A:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)已知:2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) △H=-1365.0kJ/mol
H2(g)+
 O2(g)=H2O(g) △H=-241.8kJ/mol
O2(g)=H2O(g) △H=-241.8kJ/mol则反应A的热化学方程式为
②在体积为1L的恒容密闭容器中发生反应A,下图为不同投料[n(CO2)和n(H2)分别为1mol,3mol;lmol,6mol]下,CO2平衡转化率随X(温度或压强)的变化曲线。
Ⅰ.曲线a对应的投料是
Ⅱ.判断X代表的物理量是
Ⅲ.x1时,曲线b对应的化学平衡常数是

Ⅳ.将CO2和H2按物质的量比1:3混合,以固定流速通过盛放Cu/Zn/Al/Zr催化剂的反应器,在相同时间内,不同温度下的实验数据如下图所示。

已知:CH3OH产率=

ⅰ.催化剂活性最好的温度为
a.483K b.503K c.523K d.543K
ⅱ.温度由523K升到543K,CO2的平衡转化率和CH3OH的实验产率均降低,解释原因:
您最近一年使用:0次
8 . 工业中可用碘硫循环法处理 气体(如下图所示),同时实现零碳排放制氢和硫。下列说法正确的是
气体(如下图所示),同时实现零碳排放制氢和硫。下列说法正确的是
已知: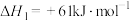

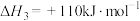

 气体(如下图所示),同时实现零碳排放制氢和硫。下列说法正确的是
气体(如下图所示),同时实现零碳排放制氢和硫。下列说法正确的是已知:
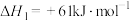

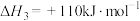

A.反应物B是 |
B.反应①方程式为 |
C.等压条件下,反应①②③反应热之和小于 直接分解的反应热 直接分解的反应热 |
D.碘硫循环法总反应热化学方程式为 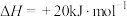 |
您最近一年使用:0次
9 . 在国家“双碳”战略目标的背景下,如何实现碳资源有效利用,成为研究前沿问题。
(1)一碳化学的研究为实际转化提供理论依据和指导。其中关于 的催化氢化涉及到的热化学反应方程式如下:
的催化氢化涉及到的热化学反应方程式如下:
已知:
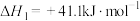

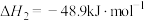
CO的催化氢化对应的热化学方程式为___________ 。
(2)L、M可分别表示温度或压强,进行CO的催化氢化时,根据检测数据绘制CO的平衡转化率关系如图所示:
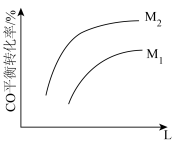
①L为___________ 。
②比较 和
和 的大小,并解释做出判断的原因:
的大小,并解释做出判断的原因:___________ 。
(3)工业上生产新能源二甲醚( )的制备原理之一为:
)的制备原理之一为: 。
。
①相同温度下,在两个容器中进行上述反应,某时刻测得各组分浓度及容器内反应状态如下表汇总(表中所以数据均为mol/L)
填写表中空白处反应状态:___________ 。(填“正向进行”、“达到平衡”或“逆向进行”),结合必要数据写出判断过程:___________ 。
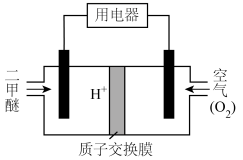
②二甲醚( )中O为-2价,二甲醚可被设计为空气燃料电池,如图所示。写出酸性环境下负极的电极反应式
)中O为-2价,二甲醚可被设计为空气燃料电池,如图所示。写出酸性环境下负极的电极反应式___________ 。
(1)一碳化学的研究为实际转化提供理论依据和指导。其中关于
 的催化氢化涉及到的热化学反应方程式如下:
的催化氢化涉及到的热化学反应方程式如下:已知:

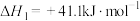

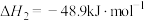
CO的催化氢化对应的热化学方程式为
(2)L、M可分别表示温度或压强,进行CO的催化氢化时,根据检测数据绘制CO的平衡转化率关系如图所示:

①L为
②比较
 和
和 的大小,并解释做出判断的原因:
的大小,并解释做出判断的原因:(3)工业上生产新能源二甲醚(
 )的制备原理之一为:
)的制备原理之一为: 。
。①相同温度下,在两个容器中进行上述反应,某时刻测得各组分浓度及容器内反应状态如下表汇总(表中所以数据均为mol/L)
| 容器 |  | 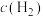 | 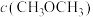 | 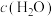 | 反应状态 |
| Ⅰ |  |  |  |  | 达到平衡 |
| Ⅱ |  |  |  |  | _______ |
②二甲醚(
 )中O为-2价,二甲醚可被设计为空气燃料电池,如图所示。写出酸性环境下负极的电极反应式
)中O为-2价,二甲醚可被设计为空气燃料电池,如图所示。写出酸性环境下负极的电极反应式
您最近一年使用:0次
10 . 已知强酸强碱的稀溶液发生中和反应时,生成 放热
放热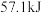 ,若用
,若用 与
与 的稀溶液反应,每
的稀溶液反应,每 完全中和时放热
完全中和时放热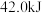 ,下列说法正确的是
,下列说法正确的是
 放热
放热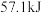 ,若用
,若用 与
与 的稀溶液反应,每
的稀溶液反应,每 完全中和时放热
完全中和时放热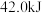 ,下列说法正确的是
,下列说法正确的是A. 是一种强酸 是一种强酸 |
B.浓硫酸与 反应生成 反应生成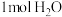 时放热为 时放热为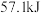 |
C.表示 与 与 中和反应的热化学方程式为: 中和反应的热化学方程式为: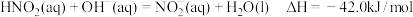 |
D. 电离的热化学方程式为: 电离的热化学方程式为: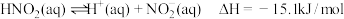 |
您最近一年使用:0次
2023-11-04更新
|
208次组卷
|
3卷引用:北京中国人民大学附属中学2023-2024学年高二上学期期中考试化学试题



