1 . I.电解法可处理氯化钙废液同时,吸收CO2,装置如图所示。_______ 和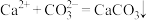 。
。
II.工业含硫烟气污染大气,研究烟气脱硫具有重要意义。
方法一、H2还原脱硫:
(2)300℃,发生反应:①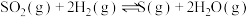

②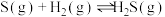

③

请用一个等式来表示三个反应的 之间的关系
之间的关系_______ 。
(3)反应③,在恒温、恒容的密闭容器中,充入 和
和 ,平衡常数
,平衡常数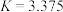 ,测得平衡时
,测得平衡时 和
和 的浓度均为
的浓度均为 ,则平衡时
,则平衡时 的值为
的值为_______ 。
方法二、O2氧化脱硫:
(4)某同学探究活性炭吸附催化氧化 ,以N2作稀释剂,一定温度下,通入
,以N2作稀释剂,一定温度下,通入 、
、 和
和 反应生成
反应生成 ,其中不同温度下,
,其中不同温度下, 在活性炭上的吸附情况如图,下列说法正确的是_______。
在活性炭上的吸附情况如图,下列说法正确的是_______。
(5)在SO2与O2反应过程中掺入少量CH4有利于提高SO2转化成SO3,其中一种解释是甲烷参与氧化反应过程中存在如图机理。原料以一定流速通过反应容器,出口处测SO3的含量,结合机理说明甲烷体积分数增大,SO3体积分数也增大的理由_______ 。
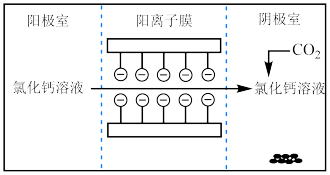
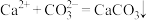 。
。II.工业含硫烟气污染大气,研究烟气脱硫具有重要意义。
方法一、H2还原脱硫:
(2)300℃,发生反应:①
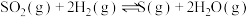

②
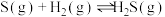

③


请用一个等式来表示三个反应的
 之间的关系
之间的关系(3)反应③,在恒温、恒容的密闭容器中,充入
 和
和 ,平衡常数
,平衡常数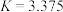 ,测得平衡时
,测得平衡时 和
和 的浓度均为
的浓度均为 ,则平衡时
,则平衡时 的值为
的值为方法二、O2氧化脱硫:
(4)某同学探究活性炭吸附催化氧化
 ,以N2作稀释剂,一定温度下,通入
,以N2作稀释剂,一定温度下,通入 、
、 和
和 反应生成
反应生成 ,其中不同温度下,
,其中不同温度下, 在活性炭上的吸附情况如图,下列说法正确的是_______。
在活性炭上的吸附情况如图,下列说法正确的是_______。
| A.温度越低,SO2的吸附量越高,SO2氧化反应速率越快 |
| B.已知:SO2的物理吸附过程能自发进行,可推断该过程是熵减、放热的过程,温度过高不利 |
| C.原料中水蒸气的含量越大,脱硫速率一定越快 |
D.随着时间的推移,SO2吸附速率降低,可能是由于生成的 占据了吸附位点没及时脱出导致 占据了吸附位点没及时脱出导致 |
(5)在SO2与O2反应过程中掺入少量CH4有利于提高SO2转化成SO3,其中一种解释是甲烷参与氧化反应过程中存在如图机理。原料以一定流速通过反应容器,出口处测SO3的含量,结合机理说明甲烷体积分数增大,SO3体积分数也增大的理由

您最近一年使用:0次
2024-04-24更新
|
251次组卷
|
2卷引用:浙江绍兴市2023-2024学年高三下学期选考科目适应性考试化学试题
2 . 苯与卤素发生取代反应可细分为:
①C6H6(苯)+∙X+X2→C6H5∙+X2+HX △H1
②C6H5∙+X2+HX→C6H5X+HX+∙X △H2
下图1、2表示反应中部分物质的含量(测量反应过程中多个时间点的各物质含量,去除开始时与结束前的极端值后取平均值),已知图1为使用催化剂前,图2为使用催化剂后,下表为相关△H的数据。
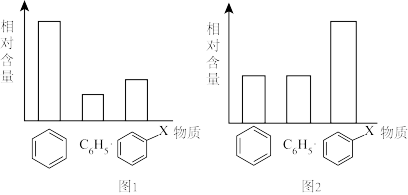
下列说法正确的是
①C6H6(苯)+∙X+X2→C6H5∙+X2+HX △H1
②C6H5∙+X2+HX→C6H5X+HX+∙X △H2
下图1、2表示反应中部分物质的含量(测量反应过程中多个时间点的各物质含量,去除开始时与结束前的极端值后取平均值),已知图1为使用催化剂前,图2为使用催化剂后,下表为相关△H的数据。

X | Cl | Br |
△H1(kJ∙mol-1) | 10 | 20 |
△H2(kJ∙mol-1) | -111 | -100 |
| A.可推知H-Cl键的键能比H-Br键的键能大10 kJ∙mol-1 |
| B.1mol苯与1mol氯气反应将会向环境释放101kJ热量 |
| C.使用催化剂后会改变△H1,但不会改变△H1+△H2 |
| D.反应②为总反应的决速步,催化剂的机理为降低反应②的活化能 |
您最近一年使用:0次
2022-11-10更新
|
584次组卷
|
5卷引用:浙江七彩阳光联盟2022-2023学年高二下学期4月期中考试化学试题
浙江七彩阳光联盟2022-2023学年高二下学期4月期中考试化学试题浙江省普通高校招生2022-2023学年高三上学期10月化学(选考)模拟试题(已下线)热点情景汇编-专题六 化学反应中的热能(已下线)素养卷03 化学反应与能量变化图象-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)(已下线)考点17 化学反应的热效应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
3 . 回答下列问题:
Ⅰ.水体中过量氨氮(以NH3表示)会导致水体富营养化。
(1)用次氯酸钠除去氨氮的一种原理如图1所示。写出该图示的总反应化学方程式___________ 。该反应需控制温度,温度过高时氨氮去除率降低的原因是___________ 。

(2)取一定量的含氨氮废水,改变加入次氯酸钠的用量,反应一段时间后,溶液中氨氮去除率、总氮(溶液中所有可溶性的含氮化合物中氮元素的总量)去除率以及剩余次氯酸钠的含量随m(NaClO):m(NH3)的变化情况如图2所示。当m(NaClO):m(NH3)>7.6时,水体中总氮去除率反而下降,可能的原因是___________

Ⅱ.一定条件下,由CO2和H2制备甲醇的过程中含有下列反应:
反应1: CO2(g)+H2(g) CO(g)+H2O(g) ΔH1
CO(g)+H2O(g) ΔH1
反应2: CO(g)+2H2(g) CH3OH(g) ΔH2
CH3OH(g) ΔH2
反应3: CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH3
CH3OH(g)+H2O(g) ΔH3
其对应的平衡常数分别为K1、K2、K3,它们随温度变化的曲线如图3所示。

(3)从题给信息分析中可知,ΔH3大于ΔH2,理由是_____ 。
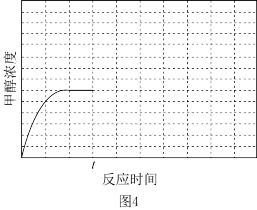
(4)在温度T1时,使体积比为3∶1的H2和CO2在体积恒定的密闭容器内进行反应。T1温度下甲醇浓度随时间变化曲线如图4所示;不改变其他条件,假定t时刻迅速降温到T2,一段时间后体系重新达到平衡。试在图中画出t时刻后甲醇浓度随时间变化至平衡的示意曲线_____ 。
Ⅰ.水体中过量氨氮(以NH3表示)会导致水体富营养化。
(1)用次氯酸钠除去氨氮的一种原理如图1所示。写出该图示的总反应化学方程式

(2)取一定量的含氨氮废水,改变加入次氯酸钠的用量,反应一段时间后,溶液中氨氮去除率、总氮(溶液中所有可溶性的含氮化合物中氮元素的总量)去除率以及剩余次氯酸钠的含量随m(NaClO):m(NH3)的变化情况如图2所示。当m(NaClO):m(NH3)>7.6时,水体中总氮去除率反而下降,可能的原因是

Ⅱ.一定条件下,由CO2和H2制备甲醇的过程中含有下列反应:
反应1: CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH1
CO(g)+H2O(g) ΔH1反应2: CO(g)+2H2(g)
 CH3OH(g) ΔH2
CH3OH(g) ΔH2反应3: CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH3
CH3OH(g)+H2O(g) ΔH3其对应的平衡常数分别为K1、K2、K3,它们随温度变化的曲线如图3所示。

(3)从题给信息分析中可知,ΔH3大于ΔH2,理由是
(4)在温度T1时,使体积比为3∶1的H2和CO2在体积恒定的密闭容器内进行反应。T1温度下甲醇浓度随时间变化曲线如图4所示;不改变其他条件,假定t时刻迅速降温到T2,一段时间后体系重新达到平衡。试在图中画出t时刻后甲醇浓度随时间变化至平衡的示意曲线

您最近一年使用:0次
4 . 合成气(CO+H2)是制备合成油和烯烃等众多化工产品的枢纽原料,而催化甲烷部分氧化是生产合成气的主要工艺之一,涉及的反应为:
①2CH4(g)+O2(g) 2CO(g)+4H2(g) △H
2CO(g)+4H2(g) △H
已知如下反应:
②CH4(g)+2O2(g) CO2(g)+2H2O(g) △H1=-810kJ/mol
CO2(g)+2H2O(g) △H1=-810kJ/mol
③CH4(g)+H2O(g) CO(g)+3H2(g) △H2=+225kJ/mol
CO(g)+3H2(g) △H2=+225kJ/mol
④CO(g)+H2O(g) CO2(g)+H2(g) △H3=-35kJ/mol
CO2(g)+H2(g) △H3=-35kJ/mol
请回答下列问题:
(1)试计算反应①的△H=___ 。
(2)在某体积固定的绝热密闭容器中发生反应④,下列事实能证明反应已达平衡的是___ 。
(3)在某恒容密闭容器中加入一定量的甲烷和氧气发生反应③,使其充分反应,测得不同温度和压强下甲烷的转化率如图1所示,由该图可得出的结论是___ 。

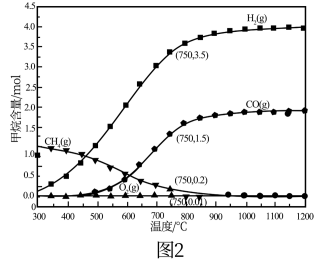
(4)现将2molCH4和1molO2加入某体积可变的密闭容器中,发生反应①。控制压强为1atm,测得不同温度下反应体系中各组分平衡含量如图2所示。实际生产中控制的温度为750℃,则此温度下CO的产率为___ ,若平衡时容器的体积为VL,则该反应的平衡常数K=___ 。(用含V代数式表示,不必化简)。
①2CH4(g)+O2(g)
 2CO(g)+4H2(g) △H
2CO(g)+4H2(g) △H已知如下反应:
②CH4(g)+2O2(g)
 CO2(g)+2H2O(g) △H1=-810kJ/mol
CO2(g)+2H2O(g) △H1=-810kJ/mol③CH4(g)+H2O(g)
 CO(g)+3H2(g) △H2=+225kJ/mol
CO(g)+3H2(g) △H2=+225kJ/mol④CO(g)+H2O(g)
 CO2(g)+H2(g) △H3=-35kJ/mol
CO2(g)+H2(g) △H3=-35kJ/mol请回答下列问题:
(1)试计算反应①的△H=
(2)在某体积固定的绝热密闭容器中发生反应④,下列事实能证明反应已达平衡的是
| A.容器内温度不再变化 | B.混合气体的平均分子量不再变化 |
| C.各组分的物质的量相等 | D.1molH—O键断裂同时有1molH—H键断裂 |

(4)现将2molCH4和1molO2加入某体积可变的密闭容器中,发生反应①。控制压强为1atm,测得不同温度下反应体系中各组分平衡含量如图2所示。实际生产中控制的温度为750℃,则此温度下CO的产率为

您最近一年使用:0次
19-20高一·浙江绍兴·阶段练习
5 . 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。

I.(1)下图是N2(g)和H2(g)反应生成 1mol NH3(g)过程中能量变化示意图,请写出N2和H2反应的热化学方程式:___________ 。
(2)若已知下列数据:
试根据表中及图中数据计算N- H的键能___________ kJ·mol-l。
II.氨的合成是最重要的化工生产之一、已知:N2+3H2 2NH3, 试回答:
2NH3, 试回答:
下列各项能说明该反应已达到平衡状态的是___________ (填写序号字母)。
a.容器内N2、H2、NH3的浓度之比为1:3: 2
b.3v(N2)正= v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
III.直接供氨式碱性燃料电池的电池反应式是4NH3+3O2=2N2+6H2O,电解质溶液一般使用KOH溶液,则负极电极反应式是___________ 。

I.(1)下图是N2(g)和H2(g)反应生成 1mol NH3(g)过程中能量变化示意图,请写出N2和H2反应的热化学方程式:
(2)若已知下列数据:
| 化学键 | H-H | N≡N |
| 键能/kJ·mol-l | 435 | 943 |
试根据表中及图中数据计算N- H的键能
II.氨的合成是最重要的化工生产之一、已知:N2+3H2
 2NH3, 试回答:
2NH3, 试回答:下列各项能说明该反应已达到平衡状态的是
a.容器内N2、H2、NH3的浓度之比为1:3: 2
b.3v(N2)正= v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
III.直接供氨式碱性燃料电池的电池反应式是4NH3+3O2=2N2+6H2O,电解质溶液一般使用KOH溶液,则负极电极反应式是
您最近一年使用:0次
解题方法
6 . 研究NOx、CO2的吸收利用,对促进低碳社会的构建和环境的保护具有重要意义。
(1)已知C2H4(g)+3O2(g)=2CO2(g)+2H2O(g) △H=a kJ·mol-1
N2(g)+O2(g)=2NO(g) △H=b kJ·mol-1
H2O(l)=H2O(g) △H=c kJ·mol-1
则C2H4(g)+6NO(g) 3N2(g)+2CO2(g)+2H2O(l)的反应热△H=
3N2(g)+2CO2(g)+2H2O(l)的反应热△H=______ 。
(2)用NH3催化还原NOx可以消除氮氧化物的污染。如下图,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(脱氮率即氮氧化物的转化率),反应原理为:NO(g)+NO2(g)+2NH3(g) 2N2(g)+3H2O(g) △H<0。
2N2(g)+3H2O(g) △H<0。
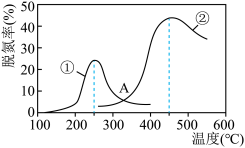
以下说法正确的是______ 。
A.催化剂①、②分别适合于250℃和450℃左右脱氮
B.使用第②种催化剂更有利于提高NOx的平衡转化率
C.相同条件下,改变压强对脱氮率没有影响
D.在交叉点A处,不管使用哪种催化剂,上述反应都未达平衡。
(3)工业合成尿素的反应如下:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(l) △H<0,在恒定温度下,将NH3和CO2按2:1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质的浓度变化曲线如图所示。
CO(NH2)2(l)+H2O(l) △H<0,在恒定温度下,将NH3和CO2按2:1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质的浓度变化曲线如图所示。
①若保持平衡时的温度和压强不变,再向容器中充入3mol的CO2,则此时v(正)______ v(逆)(填>、<或=)。判断的理由是______ 。
②若保持平衡时的温度和体积不变,25min时再向容器中充入2mol的NH3和1 mol CO2,在40min时重新达到平衡,请在图中画出25~50min内NH3的浓度变化曲线。______ 。

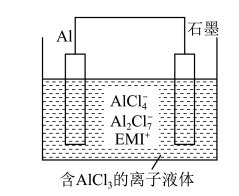
(4)用铝制作的“快速放电铝离子二次电池”的原理如右上图所示(EMI+为有机阳离子、电池工作时离子液体中微粒种类不变)。该电池放电时的负极反应方程式为____________ 。
(1)已知C2H4(g)+3O2(g)=2CO2(g)+2H2O(g) △H=a kJ·mol-1
N2(g)+O2(g)=2NO(g) △H=b kJ·mol-1
H2O(l)=H2O(g) △H=c kJ·mol-1
则C2H4(g)+6NO(g)
 3N2(g)+2CO2(g)+2H2O(l)的反应热△H=
3N2(g)+2CO2(g)+2H2O(l)的反应热△H=(2)用NH3催化还原NOx可以消除氮氧化物的污染。如下图,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(脱氮率即氮氧化物的转化率),反应原理为:NO(g)+NO2(g)+2NH3(g)
 2N2(g)+3H2O(g) △H<0。
2N2(g)+3H2O(g) △H<0。
以下说法正确的是
A.催化剂①、②分别适合于250℃和450℃左右脱氮
B.使用第②种催化剂更有利于提高NOx的平衡转化率
C.相同条件下,改变压强对脱氮率没有影响
D.在交叉点A处,不管使用哪种催化剂,上述反应都未达平衡。
(3)工业合成尿素的反应如下:2NH3(g)+CO2(g)
 CO(NH2)2(l)+H2O(l) △H<0,在恒定温度下,将NH3和CO2按2:1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质的浓度变化曲线如图所示。
CO(NH2)2(l)+H2O(l) △H<0,在恒定温度下,将NH3和CO2按2:1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质的浓度变化曲线如图所示。①若保持平衡时的温度和压强不变,再向容器中充入3mol的CO2,则此时v(正)
②若保持平衡时的温度和体积不变,25min时再向容器中充入2mol的NH3和1 mol CO2,在40min时重新达到平衡,请在图中画出25~50min内NH3的浓度变化曲线。


(4)用铝制作的“快速放电铝离子二次电池”的原理如右上图所示(EMI+为有机阳离子、电池工作时离子液体中微粒种类不变)。该电池放电时的负极反应方程式为
您最近一年使用:0次
2019-10-12更新
|
224次组卷
|
3卷引用:浙江省诸暨市2019-2020学年高二上学期期末考试化学试题
2012高三·浙江绍兴·专题练习
解题方法
7 . 在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。
(1)已知:N2(g)+ O2(g)=2NO(g) △H=+180.5 kJ/mol
2C(s)+ O2(g)=2CO(g) △H=-221.0 kJ/mol
C(s)+ O2(g)=CO2(g) △H=-393.5 kJ/mol
尾气转化的反应之一:2NO(g)+2CO(g)=N2(g)+2CO2(g) △H=____________ 。
(2)某研究性学习小组在技术人员的指导下,在某温度时,按下列流程探究某种催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如表:

请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
①前2s内的平均反应速率v(N2) =___________ 。
②在该温度下,反应的平衡常数K=___________ 。(只写出计算结果)
③对于该可逆反应,通过综合分析以上信息,至少可以说明________ (填字母)。
A.该反应的反应物混合后很不稳定
B.该反应一旦发生将在很短的时间内完成
C.该反应体系达到平衡时至少有一种反应物的百分含量较小
D.该反应在一定条件下能自发进行
E.该反应使用催化剂意义不大
(3)CO分析仪以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。下列说法错误的是__________ 。

A.负极的电极反应式为:CO+O2-―2e-=CO2
B.工作时电极b作正极,O2-由电极a流向电极b
C.工作时电子由电极a通过传感器流向电极b
D.传感器中通过的电流越大,尾气中CO的含量越高
(1)已知:N2(g)+ O2(g)=2NO(g) △H=+180.5 kJ/mol
2C(s)+ O2(g)=2CO(g) △H=-221.0 kJ/mol
C(s)+ O2(g)=CO2(g) △H=-393.5 kJ/mol
尾气转化的反应之一:2NO(g)+2CO(g)=N2(g)+2CO2(g) △H=
(2)某研究性学习小组在技术人员的指导下,在某温度时,按下列流程探究某种催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如表:

请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
①前2s内的平均反应速率v(N2) =
②在该温度下,反应的平衡常数K=
③对于该可逆反应,通过综合分析以上信息,至少可以说明
A.该反应的反应物混合后很不稳定
B.该反应一旦发生将在很短的时间内完成
C.该反应体系达到平衡时至少有一种反应物的百分含量较小
D.该反应在一定条件下能自发进行
E.该反应使用催化剂意义不大
(3)CO分析仪以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。下列说法错误的是

A.负极的电极反应式为:CO+O2-―2e-=CO2
B.工作时电极b作正极,O2-由电极a流向电极b
C.工作时电子由电极a通过传感器流向电极b
D.传感器中通过的电流越大,尾气中CO的含量越高
您最近一年使用:0次



