1 . 已知:①
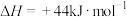
②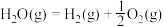
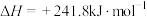
③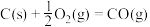
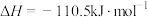
④
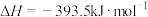
回答下列问题:
(1)上述变化中属于吸热反应的是___________ (填序号)。
(2)写出 燃烧的热化学方程式:
燃烧的热化学方程式:___________ 。
(3)反应 的
的
___________  。
。
(4)相同压强下,质量相等且起始温度相同的两份 与足量的
与足量的 充分反应,分别生成液态水(反应I)和水蒸气(反应Ⅱ),反应I放出的热量
充分反应,分别生成液态水(反应I)和水蒸气(反应Ⅱ),反应I放出的热量___________ (填“>”“<”或“=”)反应Ⅱ放出的热量。
(5)在一定条件下,将 和
和 充入
充入 密闭容器中发生反应生成氨气:
密闭容器中发生反应生成氨气: ,达到平衡时
,达到平衡时 的转化率为
的转化率为 ,放出
,放出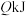 的热量,该反应的平衡常数
的热量,该反应的平衡常数
___________  。写出
。写出 与
与 反应的热化学方程式:
反应的热化学方程式:___________ 。
(6)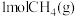 完全燃烧生成气态水的能量变化和
完全燃烧生成气态水的能量变化和 燃烧的能量变化如图所示。在催化剂作用下,
燃烧的能量变化如图所示。在催化剂作用下, 可以还原
可以还原 生成单质
生成单质 、
、 和
和 ,写出该反应的热化学方程式:
,写出该反应的热化学方程式:________ 。


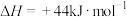
②
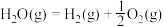
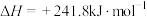
③
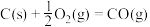
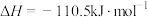
④

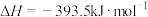
回答下列问题:
(1)上述变化中属于吸热反应的是
(2)写出
 燃烧的热化学方程式:
燃烧的热化学方程式:(3)反应
 的
的
 。
。(4)相同压强下,质量相等且起始温度相同的两份
 与足量的
与足量的 充分反应,分别生成液态水(反应I)和水蒸气(反应Ⅱ),反应I放出的热量
充分反应,分别生成液态水(反应I)和水蒸气(反应Ⅱ),反应I放出的热量(5)在一定条件下,将
 和
和 充入
充入 密闭容器中发生反应生成氨气:
密闭容器中发生反应生成氨气: ,达到平衡时
,达到平衡时 的转化率为
的转化率为 ,放出
,放出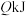 的热量,该反应的平衡常数
的热量,该反应的平衡常数
 。写出
。写出 与
与 反应的热化学方程式:
反应的热化学方程式:(6)
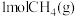 完全燃烧生成气态水的能量变化和
完全燃烧生成气态水的能量变化和 燃烧的能量变化如图所示。在催化剂作用下,
燃烧的能量变化如图所示。在催化剂作用下, 可以还原
可以还原 生成单质
生成单质 、
、 和
和 ,写出该反应的热化学方程式:
,写出该反应的热化学方程式:
您最近一年使用:0次
解题方法
2 . 氮的氧化物是大气污染物之一,用活性炭或一氧化碳还原氮氧化物,可防止空气污染。回答下列问题:
(1)已知: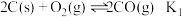

 (其中
(其中 、
、 、
、 为对应化学反应的平衡常数)
为对应化学反应的平衡常数)
①则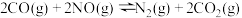 的平衡常数为K,则
的平衡常数为K,则
_______ (用 、
、 、
、 表示)。
表示)。
②在一个恒温恒容的密闭容器中发生反应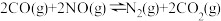 。能表明反应已达到平衡状态的标志有
。能表明反应已达到平衡状态的标志有_______ (填字母)。
A.混合气体的压强保持不变 B.混合气体的密度保持不变
C.混合气体的平均相对分子质量保持不变 D.气体的总质量保持不变
E.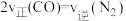 F.
F. 内生成
内生成 同时消耗
同时消耗
(2)向容积为 的密闭容器中加入活性炭(足量)和
的密闭容器中加入活性炭(足量)和 ,发生反应
,发生反应 ,
, 和
和 的物质的量变化如表所示。
的物质的量变化如表所示。
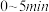 内,以
内,以 表示的平均反应速率
表示的平均反应速率
_______ ,最终达平衡时 的浓度
的浓度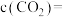
_______ ,平衡时 的转化率
的转化率
_______ ,写出该反应平衡常数的表达式
_______ ,并求该温度 下的平衡常数
下的平衡常数
_______ 。
(1)已知:
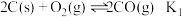

 (其中
(其中 、
、 、
、 为对应化学反应的平衡常数)
为对应化学反应的平衡常数)①则
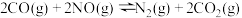 的平衡常数为K,则
的平衡常数为K,则
 、
、 、
、 表示)。
表示)。②在一个恒温恒容的密闭容器中发生反应
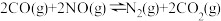 。能表明反应已达到平衡状态的标志有
。能表明反应已达到平衡状态的标志有A.混合气体的压强保持不变 B.混合气体的密度保持不变
C.混合气体的平均相对分子质量保持不变 D.气体的总质量保持不变
E.
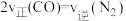 F.
F. 内生成
内生成 同时消耗
同时消耗
(2)向容积为
 的密闭容器中加入活性炭(足量)和
的密闭容器中加入活性炭(足量)和 ,发生反应
,发生反应 ,
, 和
和 的物质的量变化如表所示。
的物质的量变化如表所示。| 条件 | 保持温度为 | ||||||
时间/ | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
物质的量/ | 2.0 | 1.4 | 1.0 | 0.70 | 0.50 | 0.40 | 0.40 |
物质的量/ | 0 | 0.30 | 0.50 | 0.65 | 0.75 | 0.80 | 0.80 |
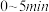 内,以
内,以 表示的平均反应速率
表示的平均反应速率
 的浓度
的浓度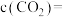
 的转化率
的转化率

 下的平衡常数
下的平衡常数
您最近一年使用:0次
2023-02-18更新
|
135次组卷
|
3卷引用:广西北海市2022-2023学年高二上学期期末考试化学试题
广西北海市2022-2023学年高二上学期期末考试化学试题福建省福州市三校2022-2023学年高二上学期期中联考化学试题(已下线)专题04 可逆反应、化学平衡状态、化学平衡常数【考点清单】(讲+练)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)
名校
3 . 根据要求,回答下列问题:
(1)已知甲烷的燃烧热为 ,
,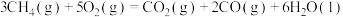
 。写出CO燃烧的热化学方程式:
。写出CO燃烧的热化学方程式:_______ ,若 、
、 键的键能分别为
键的键能分别为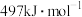 、
、 ,则使1molCO转化为相应的原子时需要的能量是
,则使1molCO转化为相应的原子时需要的能量是_______ ;1mol 按上述方式燃烧时损失的热能是
按上述方式燃烧时损失的热能是_______ (保留1位小数)。
(2)煤的气化反应之一为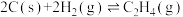

已知:①

②
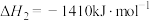
③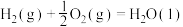

则上述煤的生成 的气化反应的
的气化反应的
_______ 。实际生产中该气化反应需要加入催化剂,其主要原因是_______ (填“速率问题”或“平衡问题”)。
(1)已知甲烷的燃烧热为
 ,
,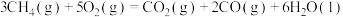
 。写出CO燃烧的热化学方程式:
。写出CO燃烧的热化学方程式: 、
、 键的键能分别为
键的键能分别为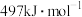 、
、 ,则使1molCO转化为相应的原子时需要的能量是
,则使1molCO转化为相应的原子时需要的能量是 按上述方式燃烧时损失的热能是
按上述方式燃烧时损失的热能是(2)煤的气化反应之一为
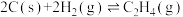

已知:①


②

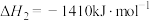
③
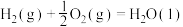

则上述煤的生成
 的气化反应的
的气化反应的
您最近一年使用:0次
2022-12-13更新
|
209次组卷
|
2卷引用:广西北海市2022-2023学年高二上学期期末考试化学试题
4 . 二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。回答下列问题:
(1)二氧化碳加氢制甲醇的总反应可表示为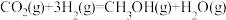 。该反应一般认为通过如下步骤来实现:
。该反应一般认为通过如下步骤来实现:
①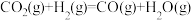
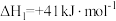
②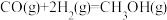
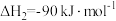
总反应的
___________  ;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是
;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是___________ (填字母),判断的理由是___________ 。
A.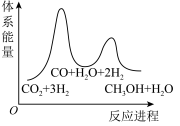 B.
B.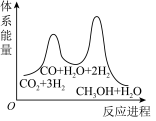 C.
C.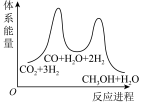 D.
D.
(2) 与
与 反应得到合成气的原理为
反应得到合成气的原理为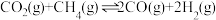 。某小组向体积是
。某小组向体积是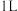 的恒容密闭容器中充入物质的量均为
的恒容密闭容器中充入物质的量均为 的
的 与
与 ,反应过程中
,反应过程中 的平衡转化率与温度、压强的关系如图所示。
的平衡转化率与温度、压强的关系如图所示。

①压强:
___________  (填“>”或“<”)。
(填“>”或“<”)。
②1100℃、 条件下,
条件下, 时反应达到平衡状态,则
时反应达到平衡状态,则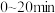 内
内 的反应速率
的反应速率
___________  ,反应的平衡常数
,反应的平衡常数
___________ (用含 的代数式表示,
的代数式表示, 为以分压表示的平衡常数,分压=总压×物质的量分数)。
为以分压表示的平衡常数,分压=总压×物质的量分数)。
(1)二氧化碳加氢制甲醇的总反应可表示为
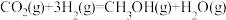 。该反应一般认为通过如下步骤来实现:
。该反应一般认为通过如下步骤来实现:①
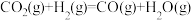
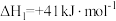
②
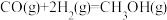
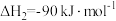
总反应的

 ;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是
;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是A.
 B.
B. C.
C. D.
D.
(2)
 与
与 反应得到合成气的原理为
反应得到合成气的原理为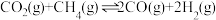 。某小组向体积是
。某小组向体积是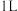 的恒容密闭容器中充入物质的量均为
的恒容密闭容器中充入物质的量均为 的
的 与
与 ,反应过程中
,反应过程中 的平衡转化率与温度、压强的关系如图所示。
的平衡转化率与温度、压强的关系如图所示。
①压强:

 (填“>”或“<”)。
(填“>”或“<”)。②1100℃、
 条件下,
条件下, 时反应达到平衡状态,则
时反应达到平衡状态,则 内
内 的反应速率
的反应速率
 ,反应的平衡常数
,反应的平衡常数
 的代数式表示,
的代数式表示, 为以分压表示的平衡常数,分压=总压×物质的量分数)。
为以分压表示的平衡常数,分压=总压×物质的量分数)。
您最近一年使用:0次
名校
解题方法
5 . 二甲醚是一种重要的清洁燃料,可替代氟利昂作制冷剂,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。请回答下列问题:
(1)利用水煤气合成二甲醚的总反应为:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g);ΔH=-246.4kJ·mol-1
CH3OCH3(g)+CO2(g);ΔH=-246.4kJ·mol-1
它可以分为两步,反应分别如下:
①4H2(g)+2CO(g)=CH3OCH3(g)+H2O(g),ΔH1=-205.1kJ·mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g);ΔH2=__ 。
(2)在一定条件下的密闭容器中,该总反应达到平衡,只改变一个条件能同时提高反应速率和CO转化率的是__ (填字母代号)。
a.降低温度 B.加入催化剂 c.缩小容器体积 D.增加H2的浓度 e.增加CO的浓度
(3)在一体积可变的密闭容器中充入3molH2、3molCO、1molCH3OCH3、1molCO2,在一定温度和压强下发生反应:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g),经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。
CH3OCH3(g)+CO2(g),经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。
问:①反应开始时正、逆反应速率的大小:v(正)__ (填“>”、“<”或“=”)v(逆)。
②平衡时n(CH3OCH3)=__ ,平衡时CO的转化率=__ 。
(1)利用水煤气合成二甲醚的总反应为:3H2(g)+3CO(g)
 CH3OCH3(g)+CO2(g);ΔH=-246.4kJ·mol-1
CH3OCH3(g)+CO2(g);ΔH=-246.4kJ·mol-1它可以分为两步,反应分别如下:
①4H2(g)+2CO(g)=CH3OCH3(g)+H2O(g),ΔH1=-205.1kJ·mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g);ΔH2=
(2)在一定条件下的密闭容器中,该总反应达到平衡,只改变一个条件能同时提高反应速率和CO转化率的是
a.降低温度 B.加入催化剂 c.缩小容器体积 D.增加H2的浓度 e.增加CO的浓度
(3)在一体积可变的密闭容器中充入3molH2、3molCO、1molCH3OCH3、1molCO2,在一定温度和压强下发生反应:3H2(g)+3CO(g)
 CH3OCH3(g)+CO2(g),经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。
CH3OCH3(g)+CO2(g),经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。问:①反应开始时正、逆反应速率的大小:v(正)
②平衡时n(CH3OCH3)=
您最近一年使用:0次
2020-10-29更新
|
636次组卷
|
3卷引用:广西北海市北海中学2019-2020学年高二上学期期中考试化学试题
名校
6 . 钛被称为“第三金属”,其制取原料为金红石( ),制取步骤如下:
),制取步骤如下:
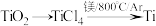
已知:①

②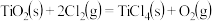

则反应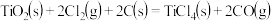 的ΔH为
的ΔH为
 ),制取步骤如下:
),制取步骤如下: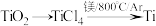
已知:①


②
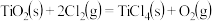

则反应
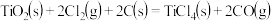 的ΔH为
的ΔH为| A.2ΔH1+2ΔH2 | B.2ΔH1+ΔH2 |
| C.2ΔH1-ΔH2 | D.2ΔH1-2ΔH2 |
您最近一年使用:0次
2020-09-21更新
|
588次组卷
|
5卷引用:广西壮族自治区北海市2019-2020学年高二下学期期末教学质量检测化学试题
名校
解题方法
7 . 碳是形成化合物种类最多的元素,其单质和化合物是人类生活的主要能源物质。
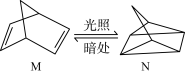
(1)有机物M经过太阳光光照可转化成N,转化过程如下:ΔH =+88.6 kJ·mol-1,则M、N相比,较稳定的是__________
(2)根据下列热化学方程式分析,C(s)的燃烧热△H等于_____________ (用△H1 、△H2、△H3表示)
C(s)+H2O(l)=CO(g)+H2(g); △H1
2CO(g)+O2(g)=2CO2(g); △H2
2H2(g)+O2(g)=2H2O(l); △H3
(3)根据键能数据估算CH4(g)+4F2(g)= CF4(g)+4HF(g)的反应热ΔH=________
(4)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式:____________________________
(1)有机物M经过太阳光光照可转化成N,转化过程如下:ΔH =+88.6 kJ·mol-1,则M、N相比,较稳定的是

(2)根据下列热化学方程式分析,C(s)的燃烧热△H等于
C(s)+H2O(l)=CO(g)+H2(g); △H1
2CO(g)+O2(g)=2CO2(g); △H2
2H2(g)+O2(g)=2H2O(l); △H3
(3)根据键能数据估算CH4(g)+4F2(g)= CF4(g)+4HF(g)的反应热ΔH=
| 化学键 | C—H | C—F | H—F | F—F |
| 键能/(kJ·mol-1) | 414 | 489 | 565 | 155 |
(4)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式:
您最近一年使用:0次



