名校
1 . 工业及汽车尾气已成为城市空气的主要污染源,研究其反应机理对于环境治理有重要意义。
(1)硝酸厂尾气可以回收制备硝酸。已知:
①2NO(g)+O2(g)=2NO2(g) △H1=-113.0 kJ/mol
②3NO2(g)+H2O(g)=2HNO3(g)+NO(g) △H2=-138.0 kJ/mol
4NO2(g)+O2(g)+2H2O(g)=4HNO3(g) △H=___________ kJ/mol。
(2)液氨催化还原NO是重要的烟气脱硝技术。使用Fe2O3为催化剂,可能的反应过程如图所示。___________ 。
②反应过程图中,虚线方框里的过程可描述为___________ 。
③氨氮比会直接影响该方法的脱硝率。350℃时只改变氨气的投放量,NO的百分含量与氨氮比的关系如图所示。当 >1.0时,烟气中NO含量反而增大,主要原因是
>1.0时,烟气中NO含量反而增大,主要原因是___________ 。
NO2被Na2CO3溶液吸收生成的三种盐分别是NaNO2、NaNO3和___________ 。(填化学式)
(4)NSR (NOX储存还原)可有效减少氮氧化物排放。工作原理:通过BaO和Ba(NO3)2的相互转化实现NOX的储存和还原,如图所示。___________ 。
(1)硝酸厂尾气可以回收制备硝酸。已知:
①2NO(g)+O2(g)=2NO2(g) △H1=-113.0 kJ/mol
②3NO2(g)+H2O(g)=2HNO3(g)+NO(g) △H2=-138.0 kJ/mol
4NO2(g)+O2(g)+2H2O(g)=4HNO3(g) △H=
(2)液氨催化还原NO是重要的烟气脱硝技术。使用Fe2O3为催化剂,可能的反应过程如图所示。
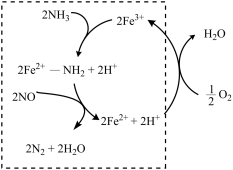
②反应过程图中,虚线方框里的过程可描述为
③氨氮比会直接影响该方法的脱硝率。350℃时只改变氨气的投放量,NO的百分含量与氨氮比的关系如图所示。当
 >1.0时,烟气中NO含量反而增大,主要原因是
>1.0时,烟气中NO含量反而增大,主要原因是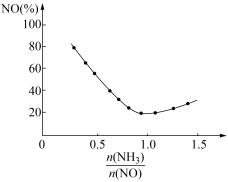
NO2被Na2CO3溶液吸收生成的三种盐分别是NaNO2、NaNO3和
(4)NSR (NOX储存还原)可有效减少氮氧化物排放。工作原理:通过BaO和Ba(NO3)2的相互转化实现NOX的储存和还原,如图所示。
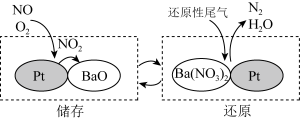
您最近一年使用:0次
名校
2 .  是空气的主要污染物之一,有效去除大气中的
是空气的主要污染物之一,有效去除大气中的 可以保护大气环境。含氮废水氨氮(以
可以保护大气环境。含氮废水氨氮(以 、
、 存在)和态硝氮(以
存在)和态硝氮(以 、
、 存在)引起水体富营养化,需经处理后才能排放。
存在)引起水体富营养化,需经处理后才能排放。
Ⅰ.空气中污染物NO可在催化剂作用下用 还原。
还原。
已知:
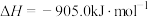


(1)有氧条件下, 与NO反应生成
与NO反应生成 ,相关热化学方程式为
,相关热化学方程式为

_____  。
。
Ⅱ.工业上含氮化合物污染物处理
(2)以 、
、 、熔融
、熔融 组成的燃料电池装置如图所示,在使用过程中石墨Ⅰ电极反应生成一种氧化物Y,则该电池的正极反应式为
组成的燃料电池装置如图所示,在使用过程中石墨Ⅰ电极反应生成一种氧化物Y,则该电池的正极反应式为_____ 。

(3)纳米铁粉可用于处理含氮废水。
①一定条件下,向 溶液中滴加碱性
溶液中滴加碱性 溶液,溶液中
溶液,溶液中 (B元素的化合价为+3)与
(B元素的化合价为+3)与 反应生成纳米铁粉、
反应生成纳米铁粉、 和
和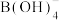 ,其离子方程式为
,其离子方程式为_____ 。
②铁粉与水中 反应的离子方程式为
反应的离子方程式为 。研究发现,若pH偏低将会导致
。研究发现,若pH偏低将会导致 的去除率下降,其原因是
的去除率下降,其原因是_____ 。
③相同条件下,纳米铁粉去除不同水样中 的速率有较大差异(如图所示),产生该差异的可能原因是
的速率有较大差异(如图所示),产生该差异的可能原因是_____ 。

(4)电极生物膜法也能有效去除水体中的 ,进行生物的反硝化反应。其可能反应机理如图所示。以必要的
,进行生物的反硝化反应。其可能反应机理如图所示。以必要的化学用语及文字 来描述此过程为_____ 。

 是空气的主要污染物之一,有效去除大气中的
是空气的主要污染物之一,有效去除大气中的 可以保护大气环境。含氮废水氨氮(以
可以保护大气环境。含氮废水氨氮(以 、
、 存在)和态硝氮(以
存在)和态硝氮(以 、
、 存在)引起水体富营养化,需经处理后才能排放。
存在)引起水体富营养化,需经处理后才能排放。Ⅰ.空气中污染物NO可在催化剂作用下用
 还原。
还原。已知:

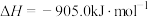


(1)有氧条件下,
 与NO反应生成
与NO反应生成 ,相关热化学方程式为
,相关热化学方程式为

 。
。Ⅱ.工业上含氮化合物污染物处理
(2)以
 、
、 、熔融
、熔融 组成的燃料电池装置如图所示,在使用过程中石墨Ⅰ电极反应生成一种氧化物Y,则该电池的正极反应式为
组成的燃料电池装置如图所示,在使用过程中石墨Ⅰ电极反应生成一种氧化物Y,则该电池的正极反应式为
(3)纳米铁粉可用于处理含氮废水。
①一定条件下,向
 溶液中滴加碱性
溶液中滴加碱性 溶液,溶液中
溶液,溶液中 (B元素的化合价为+3)与
(B元素的化合价为+3)与 反应生成纳米铁粉、
反应生成纳米铁粉、 和
和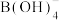 ,其离子方程式为
,其离子方程式为②铁粉与水中
 反应的离子方程式为
反应的离子方程式为 。研究发现,若pH偏低将会导致
。研究发现,若pH偏低将会导致 的去除率下降,其原因是
的去除率下降,其原因是③相同条件下,纳米铁粉去除不同水样中
 的速率有较大差异(如图所示),产生该差异的可能原因是
的速率有较大差异(如图所示),产生该差异的可能原因是
(4)电极生物膜法也能有效去除水体中的
 ,进行生物的反硝化反应。其可能反应机理如图所示。以必要的
,进行生物的反硝化反应。其可能反应机理如图所示。以必要的
您最近一年使用:0次
名校
解题方法
3 . 页岩气中含有CH4、CO2、H2S等气体,是蕴藏于页岩层可供开采的天然气资源。页岩气的有效利用需要处理其中所含的CO2和H2S。
Ⅰ.CO2的处理:
(1)CO2和CH4重整可制合成气(主要成分为CO、H2)。
已知下列热化学反应方程式:C(s)+2H2(g)=CH4(g);ΔH=-74.5kJ·mol-1
CO(g)+H2O(g)=CO2(g)+H2(g);ΔH=-40.0kJ·mol-1
C(s)+H2O(g)=CO(g)+H2(g);ΔH=+132.0kJ·mol-1
反应CO2(g)+CH4(g)=2CO(g)+2H2(g)的ΔH=_______ kJ·mol-1。
(2)Ni催化CO2加H2形成CH4,其历程如图1所示(吸附在催化剂表面的物种用*标注),反应相同时间,含碳产物中CH4的百分含量及CO2的转化率随温度的变化如图2所示。

①260℃时生成主要产物所发生反应的化学方程式为_______ 。
②温度高于320℃,CO2的转化率下降的原因是_______ 。
Ⅱ.H2S的处理:Fe2O3可用作脱除H2S气体的脱硫剂。Fe2O3脱硫和Fe2O3再生的可能反应机理如图3所示。

(3)Fe2O3脱硫和Fe2O3再生过程可以描述为_______ 。
(4)再生时需控制通入O2的浓度和温度。400℃条件下,氧气浓度较大时,会出现脱硫剂再生时质量增大,且所得再生脱硫剂脱硫效果差,原因是_______ 。
Ⅰ.CO2的处理:
(1)CO2和CH4重整可制合成气(主要成分为CO、H2)。
已知下列热化学反应方程式:C(s)+2H2(g)=CH4(g);ΔH=-74.5kJ·mol-1
CO(g)+H2O(g)=CO2(g)+H2(g);ΔH=-40.0kJ·mol-1
C(s)+H2O(g)=CO(g)+H2(g);ΔH=+132.0kJ·mol-1
反应CO2(g)+CH4(g)=2CO(g)+2H2(g)的ΔH=
(2)Ni催化CO2加H2形成CH4,其历程如图1所示(吸附在催化剂表面的物种用*标注),反应相同时间,含碳产物中CH4的百分含量及CO2的转化率随温度的变化如图2所示。

①260℃时生成主要产物所发生反应的化学方程式为
②温度高于320℃,CO2的转化率下降的原因是
Ⅱ.H2S的处理:Fe2O3可用作脱除H2S气体的脱硫剂。Fe2O3脱硫和Fe2O3再生的可能反应机理如图3所示。

(3)Fe2O3脱硫和Fe2O3再生过程可以描述为
(4)再生时需控制通入O2的浓度和温度。400℃条件下,氧气浓度较大时,会出现脱硫剂再生时质量增大,且所得再生脱硫剂脱硫效果差,原因是
您最近一年使用:0次
4 . CO2循环再利用制备甲烷、甲醇等有机燃料,变废为宝历来是化学重要的研究领域。为了减少CO2的排放,可用下列方法把CO2转化成燃料,试回答下列问题:
反应I:

反应II:
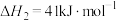
反应III:

(1)计算可知
___________  。
。
(2)某温度下,在固定容积为2.0L的密闭容器中充入0.8mol的CO2和2.4mol的H2,按反应I进行反应,测得CO2和CH3OH的物质的量随时间变化如图1:

①0~2min内,用CH3OH表示的反应速率为___________ ,该反应达到最大限度时H2的转化率为___________ ,此时CH3OH在平衡混合物中的体积分数为___________ 。
②下列措施可以提高该化学反应速率的是___________ (填选项序号)。
A.升高温度 B.容器体积不变,充入He
C.增大容器的体积 D.容器体积不变,充入更多的H2(g)
③下列叙述中能说明上述反应达到平衡状态的是___________ 。
A.反应中CO2与CH3OH的物质的量之比为1:1
B.
C.混合气体的压强不随时间的变化而变化
D.混合气体的密度不再改变
(3)H2还原CO电化学法制备甲醇(见反应III)的工作原理如图2所示:电池工作过程中H+通过质子膜向___________ (填“左”或者“右”)移动,通入CO的一端发生的电极反应式为___________ 。

反应I:


反应II:

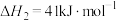
反应III:


(1)计算可知

 。
。(2)某温度下,在固定容积为2.0L的密闭容器中充入0.8mol的CO2和2.4mol的H2,按反应I进行反应,测得CO2和CH3OH的物质的量随时间变化如图1:

①0~2min内,用CH3OH表示的反应速率为
②下列措施可以提高该化学反应速率的是
A.升高温度 B.容器体积不变,充入He
C.增大容器的体积 D.容器体积不变,充入更多的H2(g)
③下列叙述中能说明上述反应达到平衡状态的是
A.反应中CO2与CH3OH的物质的量之比为1:1
B.

C.混合气体的压强不随时间的变化而变化
D.混合气体的密度不再改变
(3)H2还原CO电化学法制备甲醇(见反应III)的工作原理如图2所示:电池工作过程中H+通过质子膜向

您最近一年使用:0次
解题方法
5 . 肼(N2H4)是一种无色油状液体,沸点113.5℃,具有强还原性。能与NaClO剧烈反应生成N2。
(1)N2H4分子中N的化合价为___________
(2)N2H4与O2的相对分子质量相近,但N2H4的熔点(2℃)、沸点(114℃)分别远高于O2的熔点(-218℃)、沸点(-183℃),原因是___________ 。
(3)由碱性NaClO溶液和尿素 反应可获得
反应可获得 ,反应原理为:
,反应原理为: 。实验中反应物的加料方式为
。实验中反应物的加料方式为___________ (填序号)。
A.将尿素滴加到碱性NaClO溶液中 B.将碱性NaClO溶液滴加到尿素中
(4)发射火箭时,肼为燃料,双氧水为氧化剂,两者反应生成氮气与水蒸气。已知32g液态肼在上述反应中放出64.22kJ的热量,该反应的热化学方程式为___________ 。
(5)肼-空气燃料电池是一种新型环保电池,(用KOH溶液作电解液),该电池负极的电极反应式为___________ 。
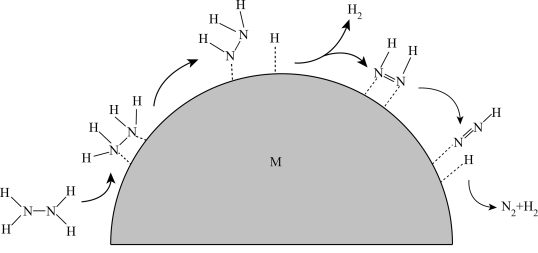
(6)H2是一种理想的绿色清洁能源,N2H4催化分解制氢是能源利用领域的研究热点。在温和条件下,负载型双金属合金M催化N2H4迅速分解,并且制氢选择性可达100%,可能机理如图所示(图中“虚线”表示吸附在催化剂上)。请将N2H4催化分解制氢的机理补充完整:N2H4吸附在(催化剂)M表面,连续断裂___________ 键,形成N2H3、___________ 和N2H等中间产物,直至H原子全部脱去,最终生成___________ 。
(1)N2H4分子中N的化合价为
(2)N2H4与O2的相对分子质量相近,但N2H4的熔点(2℃)、沸点(114℃)分别远高于O2的熔点(-218℃)、沸点(-183℃),原因是
(3)由碱性NaClO溶液和尿素
 反应可获得
反应可获得 ,反应原理为:
,反应原理为: 。实验中反应物的加料方式为
。实验中反应物的加料方式为A.将尿素滴加到碱性NaClO溶液中 B.将碱性NaClO溶液滴加到尿素中
(4)发射火箭时,肼为燃料,双氧水为氧化剂,两者反应生成氮气与水蒸气。已知32g液态肼在上述反应中放出64.22kJ的热量,该反应的热化学方程式为
(5)肼-空气燃料电池是一种新型环保电池,(用KOH溶液作电解液),该电池负极的电极反应式为
(6)H2是一种理想的绿色清洁能源,N2H4催化分解制氢是能源利用领域的研究热点。在温和条件下,负载型双金属合金M催化N2H4迅速分解,并且制氢选择性可达100%,可能机理如图所示(图中“虚线”表示吸附在催化剂上)。请将N2H4催化分解制氢的机理补充完整:N2H4吸附在(催化剂)M表面,连续断裂

您最近一年使用:0次
6 . 利用水煤气(主要成分 、CO)可将
、CO)可将 在高温下还原成硫单质,从而实现脱硫。主要发生了下列反应:
在高温下还原成硫单质,从而实现脱硫。主要发生了下列反应:
反应Ⅰ:
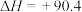 kJ⋅mol
kJ⋅mol
反应Ⅱ: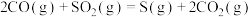
 kJ⋅mol
kJ⋅mol
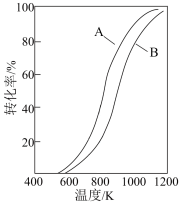
在恒压条件下用水煤气还原 ,起始时
,起始时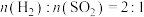 条件下,
条件下, 和
和 的平衡转化率随温度变化的曲线如图所示。下列有关说法正确的是
的平衡转化率随温度变化的曲线如图所示。下列有关说法正确的是
 、CO)可将
、CO)可将 在高温下还原成硫单质,从而实现脱硫。主要发生了下列反应:
在高温下还原成硫单质,从而实现脱硫。主要发生了下列反应:反应Ⅰ:

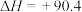 kJ⋅mol
kJ⋅mol
反应Ⅱ:
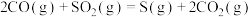
 kJ⋅mol
kJ⋅mol
在恒压条件下用水煤气还原
 ,起始时
,起始时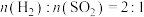 条件下,
条件下, 和
和 的平衡转化率随温度变化的曲线如图所示。下列有关说法正确的是
的平衡转化率随温度变化的曲线如图所示。下列有关说法正确的是
A.反应Ⅰ的平衡常数可表示为 |
B.反应Ⅱ的 |
C.曲线B表示 的平衡转化率随温度的变化 的平衡转化率随温度的变化 |
D. 的 的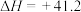 kJ⋅mol kJ⋅mol |
您最近一年使用:0次
7 . 碘与氢气反应的热化学方程式是
①
②
下列说法正确的是
①

②

下列说法正确的是
| A.①的产物比②的产物稳定 |
B. |
| C.②的反应物总能量比①的反应物总能量低 |
D.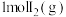 中通入 中通入 ,发生反应时放热9.48kJ ,发生反应时放热9.48kJ |
您最近一年使用:0次
名校
解题方法
8 . 氮的化合物是重要的化工原料,其转化一直是化学研究的热点。
(1)氨催化氧化法是制硝酸的重要步骤,探究氨催化氧化反应的装置如图所示:
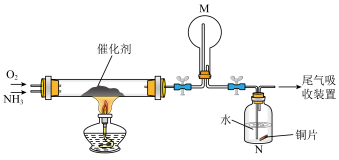
①氨催化氧化时会生成副产物N2O。生成含等物质的量氮元素的NO与N2O时,消耗的O2的物质的量之比为___________ 。
②一段时间后,观察到装置M中有白烟生成,该白烟成分是___________ (写化学式)。
(2)选择性催化还原法(SCR)工艺是以NH3 为还原剂,在催化剂作用下选择性地与NOx发生氧化还原反应生成无害化的N2和H2O。
已知:4NH3(g)+5O2(g)= 4NO(g)+6H2O(g) △H1=-905.8 kJ/mol
N2(g)+ O2(g)=2NO(g) △H2 = +180 kJ/mol
则NH3与NO反应的热化学方程式为:___________ 。
(3)可用ClO2将氮氧化物转化成 。向一定量ClO2的溶液中加入NaOH溶液调节至碱性,ClO2转化为去除氮氧化物效果更好的NaClO2,再通入NO气体进行反应。碱性条件下NaClO2去除NO反应的离子方程式为
。向一定量ClO2的溶液中加入NaOH溶液调节至碱性,ClO2转化为去除氮氧化物效果更好的NaClO2,再通入NO气体进行反应。碱性条件下NaClO2去除NO反应的离子方程式为___________ 。
(4)纳米铁粉可去除水体中的 。
。
①将一定量纳米零价铁和少量铜粉附着在生物炭上,可用于去除水体中 ,其部分反应原理如图所示。与不添加铜粉相比,添加少量铜粉时去除
,其部分反应原理如图所示。与不添加铜粉相比,添加少量铜粉时去除 效率更高,其主要原因是
效率更高,其主要原因是___________ 。
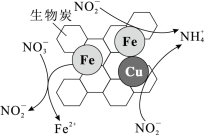
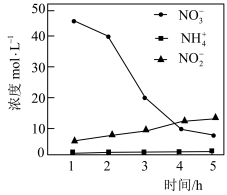
②控制其他条件不变,用纳米铁粉还原水体中的 ,测得溶液中含氮物质(
,测得溶液中含氮物质( 、
、 、
、 )浓度随时间变化如图所示。与初始溶液中
)浓度随时间变化如图所示。与初始溶液中 浓度相比,反应后溶液中所有含氮物质(
浓度相比,反应后溶液中所有含氮物质( 、
、 、
、 )总浓度减小,原因是
)总浓度减小,原因是___________ 。
(1)氨催化氧化法是制硝酸的重要步骤,探究氨催化氧化反应的装置如图所示:

①氨催化氧化时会生成副产物N2O。生成含等物质的量氮元素的NO与N2O时,消耗的O2的物质的量之比为
②一段时间后,观察到装置M中有白烟生成,该白烟成分是
(2)选择性催化还原法(SCR)工艺是以NH3 为还原剂,在催化剂作用下选择性地与NOx发生氧化还原反应生成无害化的N2和H2O。
已知:4NH3(g)+5O2(g)= 4NO(g)+6H2O(g) △H1=-905.8 kJ/mol
N2(g)+ O2(g)=2NO(g) △H2 = +180 kJ/mol
则NH3与NO反应的热化学方程式为:
(3)可用ClO2将氮氧化物转化成
 。向一定量ClO2的溶液中加入NaOH溶液调节至碱性,ClO2转化为去除氮氧化物效果更好的NaClO2,再通入NO气体进行反应。碱性条件下NaClO2去除NO反应的离子方程式为
。向一定量ClO2的溶液中加入NaOH溶液调节至碱性,ClO2转化为去除氮氧化物效果更好的NaClO2,再通入NO气体进行反应。碱性条件下NaClO2去除NO反应的离子方程式为(4)纳米铁粉可去除水体中的
 。
。①将一定量纳米零价铁和少量铜粉附着在生物炭上,可用于去除水体中
 ,其部分反应原理如图所示。与不添加铜粉相比,添加少量铜粉时去除
,其部分反应原理如图所示。与不添加铜粉相比,添加少量铜粉时去除 效率更高,其主要原因是
效率更高,其主要原因是
②控制其他条件不变,用纳米铁粉还原水体中的
 ,测得溶液中含氮物质(
,测得溶液中含氮物质( 、
、 、
、 )浓度随时间变化如图所示。与初始溶液中
)浓度随时间变化如图所示。与初始溶液中 浓度相比,反应后溶液中所有含氮物质(
浓度相比,反应后溶液中所有含氮物质( 、
、 、
、 )总浓度减小,原因是
)总浓度减小,原因是
您最近一年使用:0次
解题方法
9 . 利用甲烷与氯气发生取代反应的副产品生产盐酸的设想在工业上已成为现实。某化学兴趣小组拟在实验室中模拟上述过程,所设计的装置如下图所示:
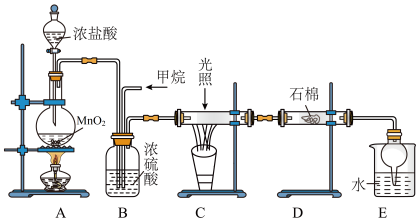
(1)A中制取Cl2反应的化学方程式是_______ 。
(2)B装置有三种功能:①控制气流速度;②均匀混合气体;③_______ 。
(3)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式:_______ 。
(4)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x值为_______ 。
(5)常温常压下,1.6g甲烷完全燃烧生成二氧化碳和水放出89.03kJ热量,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H =_______ kJ·mol-1
(6)图是某种甲烷燃料电池原理示意图:
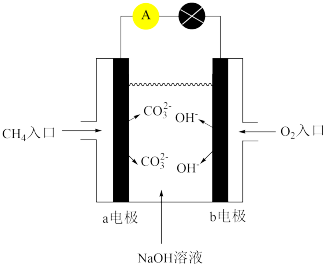
①电池的正极是_______ (填“a”或“b”)电极。
②电池工作一段时间后电解质溶液中c(OH-)_______ (填”增大”“减小”或“不变”)。

(1)A中制取Cl2反应的化学方程式是
(2)B装置有三种功能:①控制气流速度;②均匀混合气体;③
(3)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式:
(4)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x值为
(5)常温常压下,1.6g甲烷完全燃烧生成二氧化碳和水放出89.03kJ热量,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H =
(6)图是某种甲烷燃料电池原理示意图:

①电池的正极是
②电池工作一段时间后电解质溶液中c(OH-)
您最近一年使用:0次
名校
10 . 我国提出了2030年前碳达峰、2060年前碳中和的“双碳”目标。研发二氧化碳被转化为多种基础化学品,如一氧化碳、甲烷、甲醇等是实现“双碳”目标的有效方法。二氧化碳催化加氢部分热化学反应式如下:
Ⅰ.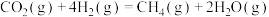
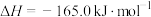
Ⅱ.
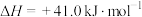
Ⅲ.
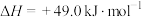
(1)二氧化碳与甲烷反应生成一氧化碳和氢气的热化学方程式为________ ;恒温恒容密闭容器中进行该反应,下列事实能说明反应达到平衡状态的是________ (填选项字母)。
A.相同时间内形成C—H键和H—H键的数目相等
B.相同时间内消耗 和形成CO的分子数目相等
和形成CO的分子数目相等
C.体系内各物质的浓度保持不变
D.体系内气体的密度保持不变
(2)消除NO污染物,在一定条件下,用 将NO还原为
将NO还原为 和
和 。
。
① 还原NO的总反应为
还原NO的总反应为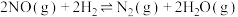 ,其能量变化如图所示。每还原1mol NO,应
,其能量变化如图所示。每还原1mol NO,应___________ (填“释放”或“吸收”)___________ kJ能量。
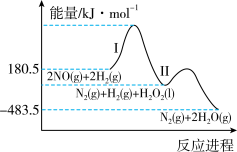
②研究表明上述反应历程分两步:
Ⅰ. ;
;
Ⅱ.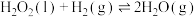
该总反应的反应物的总键能___________ (填>,<或=)生成物的总键能。
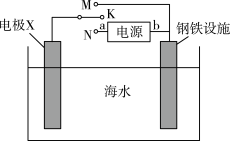
(3)电渗析法淡化海水(在直流电源作用下通过离子交换膜对海水进行处理)
①利用如图所示装置可以减缓海水中钢铁设施的腐蚀。若开关K置于M处,则电极X可选用的物质是___________ (选填“石墨块”、“锌块”或“铜块”),钢铁设施表面发生的电极反应为_______ ;若开关K置于N处,则a极为电源的________ (选填“正极”或“负极”)。
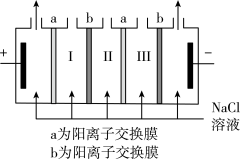
②用NaCl溶液模拟海水淡化,电解装置原理示意图如图所示,淡水从___________ 室(填Ⅰ、Ⅱ或Ⅲ)流出。
Ⅰ.
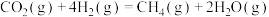
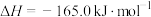
Ⅱ.

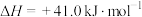
Ⅲ.

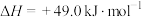
(1)二氧化碳与甲烷反应生成一氧化碳和氢气的热化学方程式为
A.相同时间内形成C—H键和H—H键的数目相等
B.相同时间内消耗
 和形成CO的分子数目相等
和形成CO的分子数目相等C.体系内各物质的浓度保持不变
D.体系内气体的密度保持不变
(2)消除NO污染物,在一定条件下,用
 将NO还原为
将NO还原为 和
和 。
。①
 还原NO的总反应为
还原NO的总反应为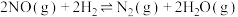 ,其能量变化如图所示。每还原1mol NO,应
,其能量变化如图所示。每还原1mol NO,应
②研究表明上述反应历程分两步:
Ⅰ.
 ;
;Ⅱ.
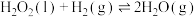
该总反应的反应物的总键能
(3)电渗析法淡化海水(在直流电源作用下通过离子交换膜对海水进行处理)
①利用如图所示装置可以减缓海水中钢铁设施的腐蚀。若开关K置于M处,则电极X可选用的物质是

②用NaCl溶液模拟海水淡化,电解装置原理示意图如图所示,淡水从

您最近一年使用:0次



