1 . 利用水煤气(主要成分 、CO)可将
、CO)可将 在高温下还原成硫单质,从而实现脱硫。主要发生了下列反应:
在高温下还原成硫单质,从而实现脱硫。主要发生了下列反应:
反应Ⅰ:
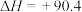 kJ⋅mol
kJ⋅mol
反应Ⅱ: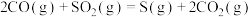
 kJ⋅mol
kJ⋅mol
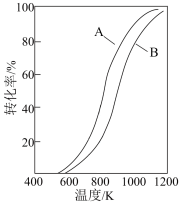
在恒压条件下用水煤气还原 ,起始时
,起始时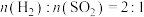 条件下,
条件下, 和
和 的平衡转化率随温度变化的曲线如图所示。下列有关说法正确的是
的平衡转化率随温度变化的曲线如图所示。下列有关说法正确的是
 、CO)可将
、CO)可将 在高温下还原成硫单质,从而实现脱硫。主要发生了下列反应:
在高温下还原成硫单质,从而实现脱硫。主要发生了下列反应:反应Ⅰ:

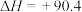 kJ⋅mol
kJ⋅mol
反应Ⅱ:
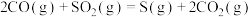
 kJ⋅mol
kJ⋅mol
在恒压条件下用水煤气还原
 ,起始时
,起始时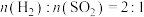 条件下,
条件下, 和
和 的平衡转化率随温度变化的曲线如图所示。下列有关说法正确的是
的平衡转化率随温度变化的曲线如图所示。下列有关说法正确的是
A.反应Ⅰ的平衡常数可表示为 |
B.反应Ⅱ的 |
C.曲线B表示 的平衡转化率随温度的变化 的平衡转化率随温度的变化 |
D. 的 的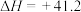 kJ⋅mol kJ⋅mol |
您最近一年使用:0次
名校
解题方法
2 . 回答下列问题
(1)以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:

相关反应的热化学方程式为:
反应Ⅰ: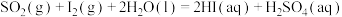 ,
,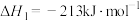
反应Ⅱ: ,
,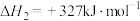
反应Ⅲ: ,
,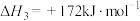
①总反应的热化学方程式为: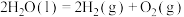 ,
,
___________ 。
②在该过程中 和
和___________ 对总反应起到催化剂作用;使用了催化剂,总反应的
___________ (填“增大”“减小”或“不变”)。
(2)CH4和CO2都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
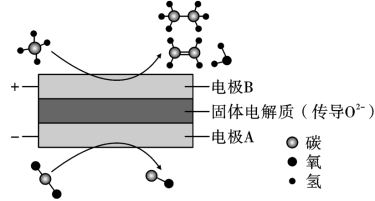
①阴极上的反应式:___________ 。
②若生成的乙烯和乙烷的体积比为2:1,则消耗的CH4和CO2体积比为___________ 。
(3)EF-H2O2-FeOx法可用于水体中有机污染物降解,其反应机理如图所示。X微粒的化学式为___________ ,阴极附近 参与反应的离子方程式为
参与反应的离子方程式为___________ 。

(1)以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:

相关反应的热化学方程式为:
反应Ⅰ:
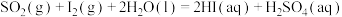 ,
,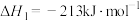
反应Ⅱ:
 ,
,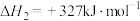
反应Ⅲ:
 ,
,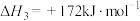
①总反应的热化学方程式为:
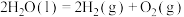 ,
,
②在该过程中
 和
和
(2)CH4和CO2都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:

①阴极上的反应式:
②若生成的乙烯和乙烷的体积比为2:1,则消耗的CH4和CO2体积比为
(3)EF-H2O2-FeOx法可用于水体中有机污染物降解,其反应机理如图所示。X微粒的化学式为
 参与反应的离子方程式为
参与反应的离子方程式为
您最近一年使用:0次
2023-02-22更新
|
405次组卷
|
3卷引用:江苏省常州市第一中学2022-2023学年高二上学期期末考试化学试题
江苏省常州市第一中学2022-2023学年高二上学期期末考试化学试题(已下线)专题13 化学反应原理综合题-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(江苏专用)江苏省扬州中学2023-2024学年高二上学期12月月考化学试题
名校
解题方法
3 . 将 转化为有机燃料是实现碳资源可持续利用的有效途径。
转化为有机燃料是实现碳资源可持续利用的有效途径。
(1)催化加氢制甲醇。向容积为2L的恒容、绝热密闭容器中通入2.0 mol 和3.0 mol
和3.0 mol ,发生反应如下:
,发生反应如下:
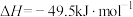
①反应在5min时达平衡,测得此时容器内 与
与 的物质的量之比为
的物质的量之比为 ,则前5min内,该反应的平均反应速率
,则前5min内,该反应的平均反应速率
___________ 。
②下列可用来判断该反应已达到平衡状态的有___________ (填标号)。
A. B.容器中
B.容器中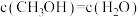
C.混合气体的密度保持不变 D.容器内的温度保持不变
③两分子甲醇可进一步脱水制得二甲醚:
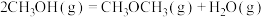
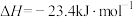
则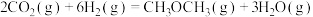 的
的
___________ 。
(2)催化加氢制甲烷。向恒压、密闭容器中通入1mol 和4mol
和4mol ,在催化剂作用下发生如下反应:
,在催化剂作用下发生如下反应:
反应Ⅰ:

反应Ⅱ:
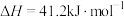
反应Ⅲ:
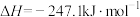
上述反应达平衡时,容器中 、
、 和CO的物质的量随温度的变化关系如图所示。
和CO的物质的量随温度的变化关系如图所示。
①曲线A表示___________ 的物质的量随温度的变化。
②800℃时曲线B代表物质的物质的量远大于400℃时的物质的量,其原因是___________ 。
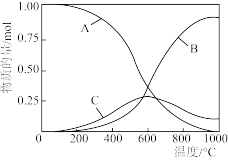
③曲线C代表物质的物质的量随温度的升高,先逐渐增大后逐渐减小。在200-600℃间,曲线C逐渐上升的原因是___________ 。
 转化为有机燃料是实现碳资源可持续利用的有效途径。
转化为有机燃料是实现碳资源可持续利用的有效途径。(1)催化加氢制甲醇。向容积为2L的恒容、绝热密闭容器中通入2.0 mol
 和3.0 mol
和3.0 mol ,发生反应如下:
,发生反应如下:
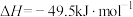
①反应在5min时达平衡,测得此时容器内
 与
与 的物质的量之比为
的物质的量之比为 ,则前5min内,该反应的平均反应速率
,则前5min内,该反应的平均反应速率
②下列可用来判断该反应已达到平衡状态的有
A.
 B.容器中
B.容器中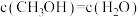
C.混合气体的密度保持不变 D.容器内的温度保持不变
③两分子甲醇可进一步脱水制得二甲醚:
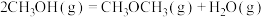
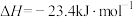
则
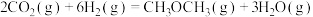 的
的
(2)催化加氢制甲烷。向恒压、密闭容器中通入1mol
 和4mol
和4mol ,在催化剂作用下发生如下反应:
,在催化剂作用下发生如下反应:反应Ⅰ:


反应Ⅱ:

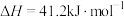
反应Ⅲ:

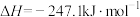
上述反应达平衡时,容器中
 、
、 和CO的物质的量随温度的变化关系如图所示。
和CO的物质的量随温度的变化关系如图所示。①曲线A表示
②800℃时曲线B代表物质的物质的量远大于400℃时的物质的量,其原因是

③曲线C代表物质的物质的量随温度的升高,先逐渐增大后逐渐减小。在200-600℃间,曲线C逐渐上升的原因是
您最近一年使用:0次
2022-06-29更新
|
322次组卷
|
2卷引用:江苏省常州市教育学会2021-2022学年高二下学期期末学业水平监测化学试题
名校
解题方法
4 . 下列说法正确的是
| A.CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=—801.3kJ·mol-1,结论:CH4的燃烧热为—801.3kJ·mol-1 |
B.Sn(灰,s)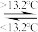 Sn(白,s) ΔH=+2.1kJ·mol-1(灰锡为粉末状),结论:锡制品在寒冷的冬天因易转化为灰锡而损坏 Sn(白,s) ΔH=+2.1kJ·mol-1(灰锡为粉末状),结论:锡制品在寒冷的冬天因易转化为灰锡而损坏 |
| C.稀溶液中有:H+(aq)+OH—(aq)=H2O(l) ΔH=—57.3kJ·mol-1,结论:将盐酸与氨水的稀溶液混合后,若生成1molH2O,则会放出57.3kJ的能量 |
| D.C(石墨,s)+O2(g)=CO2(g) ΔH=—393.5kJ·mol-1、C(金刚石,s)+O2(g)=CO2(g)ΔH=—395kJ·mol-1,结论:相同条件下金刚石比石墨稳定 |
您最近一年使用:0次
2021-11-12更新
|
434次组卷
|
10卷引用:江苏省常州市新桥高级中学2021-2022学年高二上学期期末质量检测化学试题
江苏省常州市新桥高级中学2021-2022学年高二上学期期末质量检测化学试题吉林省长春市第五中学2021-2022学年高一下学期期末考试化学试题内蒙古乌兰察布市北京八中乌兰察布分校2018-2019学年高二上学期第二次月考调研化学试题【懂做原理题】2020届高三化学选修4二轮专题练——中和热及其测定【精编25题】2020届高三化学知识点强化训练—燃烧热江苏省扬州中学2021-2022学年高二上学期10月阶段检测化学试题江苏省徐州市2021-2022学年高二上学期期中考试联考化学(选修)试题广东省江门市培英高级中学2022-2023学年高二上学期10月月考化学试题浙江省舟山市舟山中学2022-2023学年高二上学期阶段性质量监测化学试题山东省临沂市第二中学2021-2022学年高二10月月考化学试题
名校
5 . 完成下列问题
(1)在微生物作用的条件下,NH 经过两步反应被氧化成NO
经过两步反应被氧化成NO 。两步反应的能量变化示意如图:
。两步反应的能量变化示意如图:
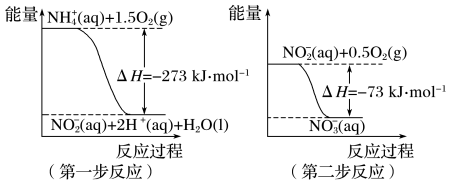
①第一步反应是___________ (填“放热”或“吸热”)反应,判断依据是___________ 。
②1 mol NH (aq)全部氧化成NO
(aq)全部氧化成NO (aq)的热化学方程式是
(aq)的热化学方程式是___________ 。
(2)已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1①
Na2O2(s)+CO2(g)=Na2CO3(s)+ O2(g) ΔH=-226 kJ·mol-1②
O2(g) ΔH=-226 kJ·mol-1②
则CO(g)与Na2O2(s)反应放出509 kJ热量时,生成的O2为___________ L(标况)。
(3)有科学家预言,氢能将成为21世纪的主要能源,而且是一种理想的绿色能源。若1 mol氢气完全燃烧生成1 mol气态水放出241 kJ的热量,已知H—O键能为463 kJ·mol-1,O=O键能为498 kJ·mol-1,计算H—H键能为___________ kJ·mol-1。
(4)氢能的储存是氢能利用的前提,科学家研究出一种储氢合金Mg2Ni,已知:
Mg(s)+H2(g)=MgH2(s) ΔH1=-74.5 kJ·mol-1;
Mg2Ni(s)+2H2(g)=Mg2NiH4(s) ΔH2=-64.4 kJ·mol-1;
Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s) ΔH3。
则ΔH3=___________ kJ·mol-1。
(1)在微生物作用的条件下,NH
 经过两步反应被氧化成NO
经过两步反应被氧化成NO 。两步反应的能量变化示意如图:
。两步反应的能量变化示意如图:
①第一步反应是
②1 mol NH
 (aq)全部氧化成NO
(aq)全部氧化成NO (aq)的热化学方程式是
(aq)的热化学方程式是(2)已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1①
Na2O2(s)+CO2(g)=Na2CO3(s)+
 O2(g) ΔH=-226 kJ·mol-1②
O2(g) ΔH=-226 kJ·mol-1②则CO(g)与Na2O2(s)反应放出509 kJ热量时,生成的O2为
(3)有科学家预言,氢能将成为21世纪的主要能源,而且是一种理想的绿色能源。若1 mol氢气完全燃烧生成1 mol气态水放出241 kJ的热量,已知H—O键能为463 kJ·mol-1,O=O键能为498 kJ·mol-1,计算H—H键能为
(4)氢能的储存是氢能利用的前提,科学家研究出一种储氢合金Mg2Ni,已知:
Mg(s)+H2(g)=MgH2(s) ΔH1=-74.5 kJ·mol-1;
Mg2Ni(s)+2H2(g)=Mg2NiH4(s) ΔH2=-64.4 kJ·mol-1;
Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s) ΔH3。
则ΔH3=
您最近一年使用:0次
2021-10-08更新
|
270次组卷
|
2卷引用:江苏省常州市新桥高级中学2021-2022学年高二上学期期末质量检测化学试题
6 . 雾霾中含有颗粒物(PM2.5)、氮氧化物(NOx)、CO等多种污染物。
(1)NO2和CO的综合治理技术受到广泛关注。
已知:①
②
反应
__ ,在___ (填“高温”或“低温”)条件下能自发进行。
(2)我国学者研究了用NO和CO反应[ ]来治理雾霾中的污染性气体。T℃时,向容积为2L的恒容密闭容器中加入2molNO和2molCO发生上述反应,5min时达到平衡状态,平衡时测得N2的体积分数为
]来治理雾霾中的污染性气体。T℃时,向容积为2L的恒容密闭容器中加入2molNO和2molCO发生上述反应,5min时达到平衡状态,平衡时测得N2的体积分数为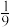 。
。
①T℃时,该反应的化学平衡常数为___ 。
②下列能说明该反应已经达到平衡状态的是___ (填字母)。
A.c(N2)和c(CO2)的浓度比保持不变 B.混合气体的密度保持不变
C.NO的消耗速率等于CO2的生成速率 D.容器内气体压强保持不变
③T℃时,在体积为2L的密闭容器中加入2molNO和2molCO发生上述反应,保持压强不变,达平衡时N2的体积分数___ (填“ ”、“
”、“ ”或“
”或“ ”)
”)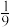 。
。
(3)尿素—SCR技术常用于NOx的脱除,该技术中生成NH3的反应如下:
Ⅰ.
Ⅱ.
体系中c(NH3)随温度变化的关系如图所示。

①无氧体系中,温度高于875℃时,NH3浓度随温度升高而减小的原因是___ 。
②有氧体系中,温度在1125℃以上,NH3浓度接近0uL•L-1的原因是___ 。
(1)NO2和CO的综合治理技术受到广泛关注。
已知:①

②

反应

(2)我国学者研究了用NO和CO反应[
 ]来治理雾霾中的污染性气体。T℃时,向容积为2L的恒容密闭容器中加入2molNO和2molCO发生上述反应,5min时达到平衡状态,平衡时测得N2的体积分数为
]来治理雾霾中的污染性气体。T℃时,向容积为2L的恒容密闭容器中加入2molNO和2molCO发生上述反应,5min时达到平衡状态,平衡时测得N2的体积分数为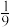 。
。①T℃时,该反应的化学平衡常数为
②下列能说明该反应已经达到平衡状态的是
A.c(N2)和c(CO2)的浓度比保持不变 B.混合气体的密度保持不变
C.NO的消耗速率等于CO2的生成速率 D.容器内气体压强保持不变
③T℃时,在体积为2L的密闭容器中加入2molNO和2molCO发生上述反应,保持压强不变,达平衡时N2的体积分数
 ”、“
”、“ ”或“
”或“ ”)
”)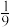 。
。(3)尿素—SCR技术常用于NOx的脱除,该技术中生成NH3的反应如下:
Ⅰ.

Ⅱ.

体系中c(NH3)随温度变化的关系如图所示。

①无氧体系中,温度高于875℃时,NH3浓度随温度升高而减小的原因是
②有氧体系中,温度在1125℃以上,NH3浓度接近0uL•L-1的原因是
您最近一年使用:0次
2021-07-01更新
|
363次组卷
|
2卷引用:江苏省常州市教育学会2020-2021学年高二下学期期末学业水平监测化学试题
21-22高三上·江苏常州·期末
7 . 消除工业废气中的氮氧化物、SO2、H2S等污染物是环境保护的重要研究课题。
Ⅰ.用O3预处理NOx、SO2后用碱液吸收,可减少烟气中NOx、SO2的含量。O3氧化烟气中NOx时主要反应的热化学方程式为:
2NO(g) +O2(g)=2NO2(g) ΔH1= a kJ·mol-1
NO(g) +O3(g)=NO2(g) +O2(g) ΔH2= b kJ·mol-1
4NO2(g) +O2(g) =2N2O5(g) ΔH3= c kJ·mol-1
(1) 反应6NO2 (g) +O3(g)=3N2O5(g) ΔH=______ kJ·mol-1。
(2) 臭氧氧化脱硝的效率受温度等因素影响。研究人员在用臭氧氧化技术脱除锅炉烟气中NOx实验中,对臭氧在三种温度下随时间的分解变化进行了研究,数据如图所示。则臭氧氧化脱硝的适宜温度为______ 。

(3)一定温度下,向NOx/O3混合物中加入一定浓度的SO2气体,进行同时脱硫脱硝实验。实验结果如图所示。由图可知SO2对 NO的氧化率影响很小,下列选项中能解释该结果的是______ (填序号)。

a.O3氧化SO2反应的活化能较大
b.O3与NO反应速率比O3与SO2反应速率快
c.等物质的量的O3与NO反应放出的热量比与SO2反应的多
Ⅱ.脱除H2S的方法很多。
(1) 电化学干法氧化法脱除H2S的原理如图所示。阴极上H2S发生的电极反应为______ 。

(2) 用Fe2(SO4)3吸收液脱除H2S法包含的反应如下:
反应Ⅰ:H2S(g)⇌H2S(aq)
反应Ⅱ:H2S(aq)⇌H++HS-
反应Ⅲ:HS-+2Fe3+=S↓+2Fe2++H+
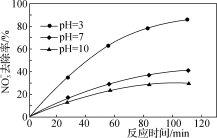
一定条件下测得脱硫率与Fe3+浓度的关系如图所示。

① 吸收液经过滤出S后,滤液需进行再生,较经济的再生方法是______ 。
② 图中当Fe3+的浓度大于10 g·L-1时,浓度越大,脱硫率越低,原因是______ 。
Ⅰ.用O3预处理NOx、SO2后用碱液吸收,可减少烟气中NOx、SO2的含量。O3氧化烟气中NOx时主要反应的热化学方程式为:
2NO(g) +O2(g)=2NO2(g) ΔH1= a kJ·mol-1
NO(g) +O3(g)=NO2(g) +O2(g) ΔH2= b kJ·mol-1
4NO2(g) +O2(g) =2N2O5(g) ΔH3= c kJ·mol-1
(1) 反应6NO2 (g) +O3(g)=3N2O5(g) ΔH=
(2) 臭氧氧化脱硝的效率受温度等因素影响。研究人员在用臭氧氧化技术脱除锅炉烟气中NOx实验中,对臭氧在三种温度下随时间的分解变化进行了研究,数据如图所示。则臭氧氧化脱硝的适宜温度为

(3)一定温度下,向NOx/O3混合物中加入一定浓度的SO2气体,进行同时脱硫脱硝实验。实验结果如图所示。由图可知SO2对 NO的氧化率影响很小,下列选项中能解释该结果的是

a.O3氧化SO2反应的活化能较大
b.O3与NO反应速率比O3与SO2反应速率快
c.等物质的量的O3与NO反应放出的热量比与SO2反应的多
Ⅱ.脱除H2S的方法很多。
(1) 电化学干法氧化法脱除H2S的原理如图所示。阴极上H2S发生的电极反应为

(2) 用Fe2(SO4)3吸收液脱除H2S法包含的反应如下:
反应Ⅰ:H2S(g)⇌H2S(aq)
反应Ⅱ:H2S(aq)⇌H++HS-
反应Ⅲ:HS-+2Fe3+=S↓+2Fe2++H+
一定条件下测得脱硫率与Fe3+浓度的关系如图所示。

① 吸收液经过滤出S后,滤液需进行再生,较经济的再生方法是
② 图中当Fe3+的浓度大于10 g·L-1时,浓度越大,脱硫率越低,原因是
您最近一年使用:0次
解题方法
8 . 通过多种方法对废水废气脱硝,可以减轻含氮物质对环境的污染。
(1)在缺氧条件下,由于兼性脱氮菌的作用,将NO2-和NO还原成N2实现脱硝的过程,称为反硝化。污水处理厂以甲醇作碳源实现硝酸盐的反硝化过程分两步进行:
3NO3-(aq)+CH3OH(l)=3NO2-(aq)+CO2(g)+2H2O(l);ΔH=-398.9 kJ·mol-1
2NO2-(aq)+CH3OH(l)=N2(g)+CO2(g)+H2O(l)+2OH-(aq);ΔH=-91.5 kJ·mol-1
反应6NO3-(aq)+5CH3OH(l)=3N2(g)+5CO2(g)+7H2O(l)+6OH-(aq)的ΔH=______ kJ·mol-1。
(2)在船舶废气的脱硝工艺中,采用无隔膜电解法对海水进行电解,再用循环喷淋模式对船舶废气进行脱硝。
①使用惰性电极对海水电解。由于采用无隔膜电解槽,阳极产物大部分是ClO-,同时会有少量Cl2、ClO3-生成,则电解生成ClO3-的电极反应式为________ 。
②一段时间后,随电解海水中ClO-含量的不断增加,经循环喷淋系统吸收的废气中NO脱除率不断增加,而NO2的脱除率却有所下降,这是由于NO被氧化为NO2,该反应的离子方程式为_________________________ 。
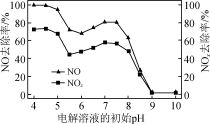
③电解海水溶液的pH对氮氧化物的去除率会产生一定影响,见下图。当电解液pH从5.5下降至4.5过程中,NO和NOx的脱除率快速上升的原因是________________ 。综合考虑脱硝效率、后期处理、设备使用等因素,选择电解海水溶液的最佳pH为________ 。
(3)锅炉的烟气脱硝处理常采用以氨为还原剂进行催化还原,主要反应如下:
4NH3+4NO+O2=4N2+6H2O①
4NH3+6NO=5N2+6H2O②
当反应温度过高时,NH3会发生以下反应:
4NH3+3O2=2N2+6H2O③
4NH3+5O2=4NO+6H2O④
在反应②中当生成1 mol N2时,转移的电子数为________ mol。随着反应温度升高,脱硝效率降低的原因可能是________ 。
(1)在缺氧条件下,由于兼性脱氮菌的作用,将NO2-和NO还原成N2实现脱硝的过程,称为反硝化。污水处理厂以甲醇作碳源实现硝酸盐的反硝化过程分两步进行:
3NO3-(aq)+CH3OH(l)=3NO2-(aq)+CO2(g)+2H2O(l);ΔH=-398.9 kJ·mol-1
2NO2-(aq)+CH3OH(l)=N2(g)+CO2(g)+H2O(l)+2OH-(aq);ΔH=-91.5 kJ·mol-1
反应6NO3-(aq)+5CH3OH(l)=3N2(g)+5CO2(g)+7H2O(l)+6OH-(aq)的ΔH=
(2)在船舶废气的脱硝工艺中,采用无隔膜电解法对海水进行电解,再用循环喷淋模式对船舶废气进行脱硝。
①使用惰性电极对海水电解。由于采用无隔膜电解槽,阳极产物大部分是ClO-,同时会有少量Cl2、ClO3-生成,则电解生成ClO3-的电极反应式为
②一段时间后,随电解海水中ClO-含量的不断增加,经循环喷淋系统吸收的废气中NO脱除率不断增加,而NO2的脱除率却有所下降,这是由于NO被氧化为NO2,该反应的离子方程式为
③电解海水溶液的pH对氮氧化物的去除率会产生一定影响,见下图。当电解液pH从5.5下降至4.5过程中,NO和NOx的脱除率快速上升的原因是

(3)锅炉的烟气脱硝处理常采用以氨为还原剂进行催化还原,主要反应如下:
4NH3+4NO+O2=4N2+6H2O①
4NH3+6NO=5N2+6H2O②
当反应温度过高时,NH3会发生以下反应:
4NH3+3O2=2N2+6H2O③
4NH3+5O2=4NO+6H2O④
在反应②中当生成1 mol N2时,转移的电子数为
您最近一年使用:0次
9 . 烟气(主要污染物SO2、NOx)是大气主要污染物,有效去除大气中的SO2、NOx是环境保护的重要课题。
(1) 用天然碱生产小苏打的母液(主要溶质为碳酸钠)吸收烟气中SO2的相关反应的热化学方程式如下:
2Na2CO3(aq)+SO2(g)+H2O(l)===Na2SO3(aq)+2NaHCO3(aq)ΔH=a kJ·mol-1
2NaHCO3(aq)+SO2(g)===Na2SO3(aq)+2CO2(g)+H2O(l)ΔH=b kJ·mol-1
Na2SO3(aq)+SO2(g)+H2O(l)===2NaHSO3(aq)ΔH=c kJ·mol-1
反应Na2CO3(aq)+SO2(g)===Na2SO3(aq)+CO2(g)的ΔH=________ kJ·mol-1。
(2) 用碳酸钠溶液吸收NO2的过程会产生NaNO2和NaNO3,写出相关化学反应方程式:__________________________________________________ 。
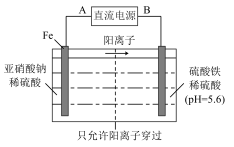
(3) 工业上用电解法治理亚硝酸盐对水体的污染,模拟工艺如图所示,写出电解时铁电极发生的电极反应式:__________________________ 。随后,铁电极附近有无色气体产生,写出有关反应的离子方程式:__________________________________________ 。
(4) 工业上以钛基氧化物涂层材料为阳极、碳纳米管修饰的石墨为阴极,电解硝酸钠和硫酸钠混合溶液,可使NO3-变为NH4+。电极(电催化剂)所处的环境对其催化活性和选择性均起到重要作用。
①其他条件不变,向其中一份电解液中投加一定量NaCl,去除NH4+的效果明显提高,溶液中氮元素含量显著降低。可能原因是______________________________________________ 。
②其他条件不变,只改变溶液的pH,NO3-去除率如图所示,pH升高时,去除率________ ,可能原因是______________________________________ 。
(1) 用天然碱生产小苏打的母液(主要溶质为碳酸钠)吸收烟气中SO2的相关反应的热化学方程式如下:
2Na2CO3(aq)+SO2(g)+H2O(l)===Na2SO3(aq)+2NaHCO3(aq)ΔH=a kJ·mol-1
2NaHCO3(aq)+SO2(g)===Na2SO3(aq)+2CO2(g)+H2O(l)ΔH=b kJ·mol-1
Na2SO3(aq)+SO2(g)+H2O(l)===2NaHSO3(aq)ΔH=c kJ·mol-1
反应Na2CO3(aq)+SO2(g)===Na2SO3(aq)+CO2(g)的ΔH=
(2) 用碳酸钠溶液吸收NO2的过程会产生NaNO2和NaNO3,写出相关化学反应方程式:
(3) 工业上用电解法治理亚硝酸盐对水体的污染,模拟工艺如图所示,写出电解时铁电极发生的电极反应式:

(4) 工业上以钛基氧化物涂层材料为阳极、碳纳米管修饰的石墨为阴极,电解硝酸钠和硫酸钠混合溶液,可使NO3-变为NH4+。电极(电催化剂)所处的环境对其催化活性和选择性均起到重要作用。
①其他条件不变,向其中一份电解液中投加一定量NaCl,去除NH4+的效果明显提高,溶液中氮元素含量显著降低。可能原因是
②其他条件不变,只改变溶液的pH,NO3-去除率如图所示,pH升高时,去除率

您最近一年使用:0次
2019-02-17更新
|
275次组卷
|
2卷引用:【市级联考】江苏省常州市2019届高三上学期期末考试化学试题
10 . 铜及其化合物在工农业生产及日常生活中应用非常广泛。
(1) 由辉铜矿制取铜的反应过程为:
2Cu2S(s)+3O2(g)===2Cu2O(s)+2SO2(g) ΔH=-768.2 kJ·mol-1,
2Cu2O(s)+Cu2S(s)===6Cu(s)+SO2(g) ΔH=+116.0 kJ·mol-1,
①热化学方程式:Cu2S(s)+O2(g)===2Cu(s)+SO2(g) ΔH=________ kJ·mol-1。
②获得的粗铜需电解精炼,精炼时粗铜作________ 极。
(2) 氢化亚铜是一种红色固体,可由下列反应制备:4CuSO4+3H3PO2+6H2O===4CuH↓+4H2SO4+3H3PO4。
①该反应还原剂是____________ (写化学式)。
②该反应每转移3 mol电子,生成CuH的物质的量为________ 。
(3) 氯化铜溶液中铜各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与c(Cl-)的关系如图所示。

①当c(Cl-)=9 mol·L-1时,溶液中主要的3种含铜物种的浓度大小关系为__________________________ 。
②在c(Cl-)=1 mol·L-1的氯化铜溶液中,滴入AgNO3溶液,含铜物种间 转化的离子方程式为___________________________ ,___________________________ (任写两个)。
(1) 由辉铜矿制取铜的反应过程为:
2Cu2S(s)+3O2(g)===2Cu2O(s)+2SO2(g) ΔH=-768.2 kJ·mol-1,
2Cu2O(s)+Cu2S(s)===6Cu(s)+SO2(g) ΔH=+116.0 kJ·mol-1,
①热化学方程式:Cu2S(s)+O2(g)===2Cu(s)+SO2(g) ΔH=
②获得的粗铜需电解精炼,精炼时粗铜作
(2) 氢化亚铜是一种红色固体,可由下列反应制备:4CuSO4+3H3PO2+6H2O===4CuH↓+4H2SO4+3H3PO4。
①该反应还原剂是
②该反应每转移3 mol电子,生成CuH的物质的量为
(3) 氯化铜溶液中铜各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与c(Cl-)的关系如图所示。

①当c(Cl-)=9 mol·L-1时,溶液中主要的3种含铜物种的浓度大小关系为
②在c(Cl-)=1 mol·L-1的氯化铜溶液中,滴入AgNO3溶液,
您最近一年使用:0次



