2023·北京东城·一模
名校
1 . 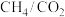 催化重整的反应为
催化重整的反应为
①

其中,积炭是导致催化剂失活的主要原因。产生积炭的反应有:
②
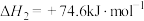
③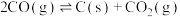
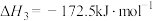
科研人员研究压强对催化剂活性的影响:在1073K时,将恒定组成的 、
、 混合气体,以恒定流速通过反应器,测得数据如下。
混合气体,以恒定流速通过反应器,测得数据如下。

下列分析不正确 的是
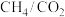 催化重整的反应为
催化重整的反应为①


其中,积炭是导致催化剂失活的主要原因。产生积炭的反应有:
②

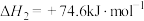
③
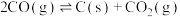
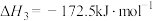
科研人员研究压强对催化剂活性的影响:在1073K时,将恒定组成的
 、
、 混合气体,以恒定流速通过反应器,测得数据如下。
混合气体,以恒定流速通过反应器,测得数据如下。
下列分析
A.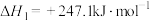 |
| B.压强越大,Ra降低越快,其主要原因是反应①平衡逆向移动 |
C.保持其他条件不变,适当增大投料时 ,可减缓Ra的衰减 ,可减缓Ra的衰减 |
D.研究表明“通入适量 有利于重整反应”,因为 有利于重整反应”,因为 能与C反应并放出热量 能与C反应并放出热量 |
您最近一年使用:0次
2023-11-30更新
|
148次组卷
|
6卷引用:专题15 化学反应速率和化学平衡
2023·河北·三模
2 .  转化为高附加值的产品是应对气候变化和能源高速消耗的有效措施,我国科学家研究
转化为高附加值的产品是应对气候变化和能源高速消耗的有效措施,我国科学家研究 加氢制备甲醇方面取得一定进展。在一定温度和压强下,
加氢制备甲醇方面取得一定进展。在一定温度和压强下, 加氢制备甲醇的过程中主要发生如下三个反应,反应I、II、III对应的平衡常数分别为
加氢制备甲醇的过程中主要发生如下三个反应,反应I、II、III对应的平衡常数分别为 、
、 和
和 。
。
I.
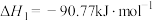
II.

III.
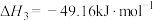
回答下列问题:
(1)
___________ ; 、
、 和
和 三者之间的关系为
三者之间的关系为___________ 。
(2)为提高甲醇的平衡产率,可通过___________ (填“升高”或“降低”)温度,___________ (填“增大”或“减小”)压强来实现。
(3)在两种不同的条件下, 的平衡转化率和
的平衡转化率和 的选择性如下表所示。条件
的选择性如下表所示。条件___________ (填“1”或“2”)中甲醇的产率更高。
(4)T℃时,将 的混合气体充入压强为
的混合气体充入压强为 的恒压密闭容器中,在催化剂的作用下发生如下两个反应:
的恒压密闭容器中,在催化剂的作用下发生如下两个反应:
①
②
反应达到平衡状态时, 和
和 的分压相等,甲醇的选择性是CO的2倍,则
的分压相等,甲醇的选择性是CO的2倍,则 的平衡转化率为
的平衡转化率为___________ ,反应②的
___________  (列出计算式即可,分压=总压×物质的量分数)。
(列出计算式即可,分压=总压×物质的量分数)。
(5)某甲醇燃料电池,电极材料为铂,电解质溶液为KOH溶液。写出负极电极反应式:___________ ;铂电极除了起导电作用外,还起着___________ 作用。
 转化为高附加值的产品是应对气候变化和能源高速消耗的有效措施,我国科学家研究
转化为高附加值的产品是应对气候变化和能源高速消耗的有效措施,我国科学家研究 加氢制备甲醇方面取得一定进展。在一定温度和压强下,
加氢制备甲醇方面取得一定进展。在一定温度和压强下, 加氢制备甲醇的过程中主要发生如下三个反应,反应I、II、III对应的平衡常数分别为
加氢制备甲醇的过程中主要发生如下三个反应,反应I、II、III对应的平衡常数分别为 、
、 和
和 。
。I.

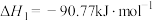
II.


III.

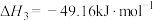
回答下列问题:
(1)

 、
、 和
和 三者之间的关系为
三者之间的关系为(2)为提高甲醇的平衡产率,可通过
(3)在两种不同的条件下,
 的平衡转化率和
的平衡转化率和 的选择性如下表所示。条件
的选择性如下表所示。条件| 条件 |  的平衡转化率/% 的平衡转化率/% |  的选择性/% 的选择性/% |
| 1 | 27 | 68 |
| 2 | 21.3 | 97.7 |
 的混合气体充入压强为
的混合气体充入压强为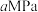 的恒压密闭容器中,在催化剂的作用下发生如下两个反应:
的恒压密闭容器中,在催化剂的作用下发生如下两个反应:①

②

反应达到平衡状态时,
 和
和 的分压相等,甲醇的选择性是CO的2倍,则
的分压相等,甲醇的选择性是CO的2倍,则 的平衡转化率为
的平衡转化率为
 (列出计算式即可,分压=总压×物质的量分数)。
(列出计算式即可,分压=总压×物质的量分数)。(5)某甲醇燃料电池,电极材料为铂,电解质溶液为KOH溶液。写出负极电极反应式:
您最近一年使用:0次
22-23高三上·广东·阶段练习
3 . 工业上,根据氢气来源将氢气分三类:绿氢、蓝氢和灰氢。电解水制得的氢为绿氢,用天然气制得的氢为蓝氢,用煤炭制得的氢为灰氢。
(1)制灰氢时每生成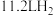 (标准状况)吸收的热量为65.7kJ,写出制备灰氢(氧化产物为CO)的热化学方程式:
(标准状况)吸收的热量为65.7kJ,写出制备灰氢(氧化产物为CO)的热化学方程式:_______ 。
(2)一定温度下,向刚性密闭容器中充入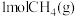 和
和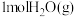 ,初始总压强为20kPa,发生下列反应制备蓝氢。
,初始总压强为20kPa,发生下列反应制备蓝氢。
反应1:
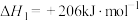
反应2:
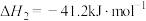
①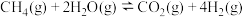

_______  。
。
②达到平衡时, 的转化率为50%,
的转化率为50%, 为0.1mol。此温度下,反应2的平衡常数
为0.1mol。此温度下,反应2的平衡常数
_______ 。(提示:分压=总压×物质的量分数)
(3)在体积可变的密闭容器中充入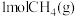 和
和 ,同时发生(2)中的反应1和反应2,测得平衡时体系中
,同时发生(2)中的反应1和反应2,测得平衡时体系中 体积分数与温度、压强关系如图所示。
体积分数与温度、压强关系如图所示。
①
_______ (填“>”“<”或“=”) 。
。
②随着温度升高,曲线斜率增大的主要原因是_______ 。
(4)一种脱除和利用蓝氢中 的方法示意图如下:
的方法示意图如下:
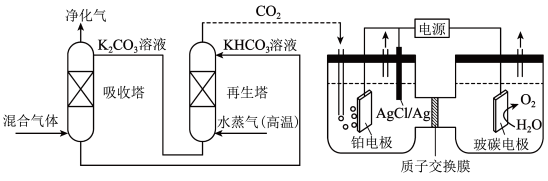
①再生塔中通入水蒸气(高温)的目的是_______ 。
②某温度下,吸收塔中 溶液吸收一定量的
溶液吸收一定量的 后,
后, ,则该溶液的
,则该溶液的
_______ 。(该温度下 的
的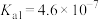 ,
,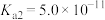 )
)
③利用电化学原理,将 电催化还原为
电催化还原为 ,阴极的电极反应式为
,阴极的电极反应式为_______ 。
(1)制灰氢时每生成
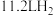 (标准状况)吸收的热量为65.7kJ,写出制备灰氢(氧化产物为CO)的热化学方程式:
(标准状况)吸收的热量为65.7kJ,写出制备灰氢(氧化产物为CO)的热化学方程式:(2)一定温度下,向刚性密闭容器中充入
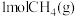 和
和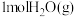 ,初始总压强为20kPa,发生下列反应制备蓝氢。
,初始总压强为20kPa,发生下列反应制备蓝氢。反应1:

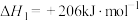
反应2:

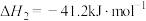
①
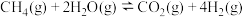

 。
。②达到平衡时,
 的转化率为50%,
的转化率为50%, 为0.1mol。此温度下,反应2的平衡常数
为0.1mol。此温度下,反应2的平衡常数
(3)在体积可变的密闭容器中充入
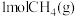 和
和 ,同时发生(2)中的反应1和反应2,测得平衡时体系中
,同时发生(2)中的反应1和反应2,测得平衡时体系中 体积分数与温度、压强关系如图所示。
体积分数与温度、压强关系如图所示。
①

 。
。②随着温度升高,曲线斜率增大的主要原因是
(4)一种脱除和利用蓝氢中
 的方法示意图如下:
的方法示意图如下:
①再生塔中通入水蒸气(高温)的目的是
②某温度下,吸收塔中
 溶液吸收一定量的
溶液吸收一定量的 后,
后, ,则该溶液的
,则该溶液的
 的
的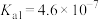 ,
,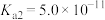 )
)③利用电化学原理,将
 电催化还原为
电催化还原为 ,阴极的电极反应式为
,阴极的电极反应式为
您最近一年使用:0次
2023·北京丰台·一模
名校
4 . 下列三个化学反应焓变、平衡常数与温度的关系分别如下表所示。下列说法正确的是
| 化学反应 | 平衡常数 | 温度 | |
| 973K | 1173K | ||
①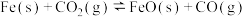  |  | 1.47 | 2.15 |
②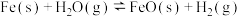  |  | 2.38 | 1.67 |
③  |  | a | b |
A.1173K时,反应①起始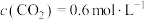 ,平衡时 ,平衡时 约为0.4 约为0.4 |
B.反应②是吸热反应, |
| C.反应③达平衡后,升高温度或缩小反应容器的容积平衡逆向移动 |
D.相同温度下, ; ;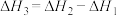 |
您最近一年使用:0次
2023-03-24更新
|
727次组卷
|
7卷引用:专题15 化学反应速率和化学平衡
(已下线)专题15 化学反应速率和化学平衡北京市丰台区2022-2023学年高三下学期第一次模拟练习化学试题北京市第一六一中学2023-2024学年高三上学期12月月考化学试题(已下线)题型13 化学平衡常数的计算及应用-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)北京市顺义区第二中学2023-2024学年高三下学期3月月考化学试题海南省海南中学2023届高三下学期第三次模拟考试化学试题湖北省黄冈市重点校2022-2023学年高一下学期期末综合选拔性联考化学试题
2023·江苏南通·一模
名校
解题方法
5 . 从废脱硝催化剂(主要成分为 、
、 )中回收
)中回收 和
和 ,具有重要意义。
,具有重要意义。
(1)碳氯化—氧化法提取 。将粉碎后的催化剂渣料与过量焦炭混合投入高温氯化炉充分反应,将生成的
。将粉碎后的催化剂渣料与过量焦炭混合投入高温氯化炉充分反应,将生成的 与其他气体分离,并将其氧化得
与其他气体分离,并将其氧化得 。该过程主要涉及以下反应:
。该过程主要涉及以下反应:
反应I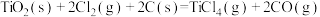

反应Ⅱ

已知常压下 的沸点为136.4℃,C的燃烧热为
的沸点为136.4℃,C的燃烧热为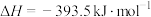 ,CO的燃烧热为
,CO的燃烧热为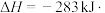
 。
。
①反应I的
_______  。
。
②从反应I的混合体系中分离出 的措施是
的措施是_______ 。
③氯化炉中生成CO比生成 更有利于
更有利于 转化为
转化为 ,其原因是
,其原因是_______ 。
(2)碱溶法回收 和
和 ,部分工艺流程如下:
,部分工艺流程如下:
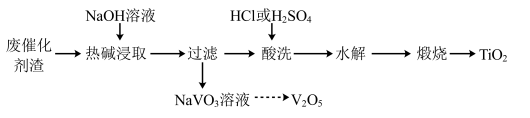
“酸洗”时, 转化为
转化为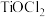 或
或 ,“水解”后得到
,“水解”后得到 。
。
①写出“热碱浸取”时 发生反应的离子方程式:
发生反应的离子方程式:_______ 。
②锐钛型和金红石型是 最常见的两种晶体类型,煅烧
最常见的两种晶体类型,煅烧 过程中,
过程中, 会发生“锐钛型→金红石型”转化,固体质量残留率和晶型转化率随温度变化如图1所示,晶型转化过程中的能量变化如图2所示。设计用“过滤”所得
会发生“锐钛型→金红石型”转化,固体质量残留率和晶型转化率随温度变化如图1所示,晶型转化过程中的能量变化如图2所示。设计用“过滤”所得 制备金红石型
制备金红石型 的操作方案:
的操作方案:_______ ,金红石型 的晶胞结构如图3所示。用“○”圈出所有位于晶胞体内的原子
的晶胞结构如图3所示。用“○”圈出所有位于晶胞体内的原子_______ 。

③为测定回收所得 样品的纯度,进行如下实验:称取2.000g样品,用稀硫酸溶解、定容得100mL
样品的纯度,进行如下实验:称取2.000g样品,用稀硫酸溶解、定容得100mL  溶液。量取20.00mL溶液放入锥形瓶中,加入10.00mL 0.5000
溶液。量取20.00mL溶液放入锥形瓶中,加入10.00mL 0.5000
 溶液(过量),再用0.01000
溶液(过量),再用0.01000
 标准溶液液定至终点,消耗标准溶液24.00mL。滴定过程中发生如下反应(均未配平):
标准溶液液定至终点,消耗标准溶液24.00mL。滴定过程中发生如下反应(均未配平): ;
;
计算 样品的纯度
样品的纯度_______ (写出计算过程)。
 、
、 )中回收
)中回收 和
和 ,具有重要意义。
,具有重要意义。(1)碳氯化—氧化法提取
 。将粉碎后的催化剂渣料与过量焦炭混合投入高温氯化炉充分反应,将生成的
。将粉碎后的催化剂渣料与过量焦炭混合投入高温氯化炉充分反应,将生成的 与其他气体分离,并将其氧化得
与其他气体分离,并将其氧化得 。该过程主要涉及以下反应:
。该过程主要涉及以下反应:反应I
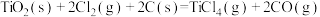

反应Ⅱ


已知常压下
 的沸点为136.4℃,C的燃烧热为
的沸点为136.4℃,C的燃烧热为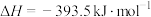 ,CO的燃烧热为
,CO的燃烧热为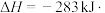
 。
。①反应I的

 。
。②从反应I的混合体系中分离出
 的措施是
的措施是③氯化炉中生成CO比生成
 更有利于
更有利于 转化为
转化为 ,其原因是
,其原因是(2)碱溶法回收
 和
和 ,部分工艺流程如下:
,部分工艺流程如下:
“酸洗”时,
 转化为
转化为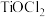 或
或 ,“水解”后得到
,“水解”后得到 。
。①写出“热碱浸取”时
 发生反应的离子方程式:
发生反应的离子方程式:②锐钛型和金红石型是
 最常见的两种晶体类型,煅烧
最常见的两种晶体类型,煅烧 过程中,
过程中, 会发生“锐钛型→金红石型”转化,固体质量残留率和晶型转化率随温度变化如图1所示,晶型转化过程中的能量变化如图2所示。设计用“过滤”所得
会发生“锐钛型→金红石型”转化,固体质量残留率和晶型转化率随温度变化如图1所示,晶型转化过程中的能量变化如图2所示。设计用“过滤”所得 制备金红石型
制备金红石型 的操作方案:
的操作方案: 的晶胞结构如图3所示。用“○”圈出所有位于晶胞体内的原子
的晶胞结构如图3所示。用“○”圈出所有位于晶胞体内的原子
③为测定回收所得
 样品的纯度,进行如下实验:称取2.000g样品,用稀硫酸溶解、定容得100mL
样品的纯度,进行如下实验:称取2.000g样品,用稀硫酸溶解、定容得100mL  溶液。量取20.00mL溶液放入锥形瓶中,加入10.00mL 0.5000
溶液。量取20.00mL溶液放入锥形瓶中,加入10.00mL 0.5000
 溶液(过量),再用0.01000
溶液(过量),再用0.01000
 标准溶液液定至终点,消耗标准溶液24.00mL。滴定过程中发生如下反应(均未配平):
标准溶液液定至终点,消耗标准溶液24.00mL。滴定过程中发生如下反应(均未配平): ;
;
计算
 样品的纯度
样品的纯度
您最近一年使用:0次
2023-02-14更新
|
1336次组卷
|
3卷引用:2023年北京卷高考真题变式题(原理综合题)
23-24高三上·湖北恩施·阶段练习
6 . 尖晶石矿的主要成分为MgAl2O4(含SiO2杂质)。已知:MgAl2O4(s)+4Cl2(g)=MgCl2(s)+2 AlCl3(g)+2O2(g) ΔH>0,该反应难以发生,但采用“加炭氯化法”可以制备MgCl2和AlCl3,同时还可得到副产物SiCl4(SiCl4沸点为58℃,AlCl3在180℃升华):MgAl2O4(s)+4C(s)+4Cl2 MgCl2(s)+2AlCl3(g)+4CO(g)。下列说法错误的是
MgCl2(s)+2AlCl3(g)+4CO(g)。下列说法错误的是
 MgCl2(s)+2AlCl3(g)+4CO(g)。下列说法错误的是
MgCl2(s)+2AlCl3(g)+4CO(g)。下列说法错误的是| A.制备时通入的Cl2要干燥 |
| B.尖晶石矿的主要成分可表示为MgO·Al2O3 |
| C.氯化时加炭,既增大了反应的趋势,又为氯化提供了能量 |
| D.工业上可通过电解熔融的MgCl2和AlCl3得到对应的金属单质 |
您最近一年使用:0次
2023-01-12更新
|
147次组卷
|
3卷引用:2023年北京卷高考真题变式题(选择题11-14)
2023·北京顺义·一模
7 .  是重要的化学试剂,在实验室和实际生产中应用广泛。
是重要的化学试剂,在实验室和实际生产中应用广泛。
I.蒽醌法是工业上合成 的主要方法,蒽醌法的反应过程如下。
的主要方法,蒽醌法的反应过程如下。
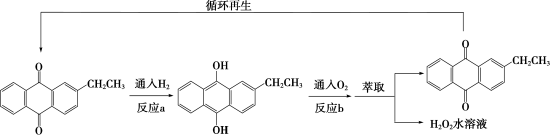
(1)已知:
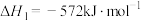
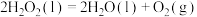
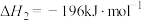
蒽醌法生产 总反应的热化学方程式
总反应的热化学方程式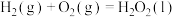

_______ 
(2)反应a的反应类型为_______ 。
(3)向反应b后的溶液可以加入蒸馏水为萃取剂,分析蒸馏水能做萃取剂的原因_______ 。
II.我国科学家设计如下图所示的光电催化体系,该体系利用双极膜既能将 转化为
转化为 所释放的化学能用于驱动阴极
所释放的化学能用于驱动阴极 的高效生成,同时还可以实现烟气脱
的高效生成,同时还可以实现烟气脱 。
。
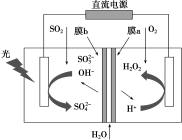
(4)阳极的电极反应为_______ 。
(5)理论上每生成 ,可以实现烟气脱
,可以实现烟气脱 的物质的量为
的物质的量为_______ mol。
III.测定 含量:
含量:
(6)取所得 水溶液amL,用
水溶液amL,用 酸性溶液滴定,消耗
酸性溶液滴定,消耗 酸性溶液vmL。已知:
酸性溶液vmL。已知: 的还原产物是
的还原产物是 。
。
① 酸性溶液与
酸性溶液与 反应的离子方程式为
反应的离子方程式为_______ 。
②所得 水溶液中
水溶液中 的物质的量浓度为
的物质的量浓度为_______  。
。
 是重要的化学试剂,在实验室和实际生产中应用广泛。
是重要的化学试剂,在实验室和实际生产中应用广泛。I.蒽醌法是工业上合成
 的主要方法,蒽醌法的反应过程如下。
的主要方法,蒽醌法的反应过程如下。
(1)已知:

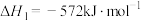
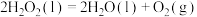
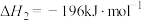
蒽醌法生产
 总反应的热化学方程式
总反应的热化学方程式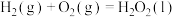


(2)反应a的反应类型为
(3)向反应b后的溶液可以加入蒸馏水为萃取剂,分析蒸馏水能做萃取剂的原因
II.我国科学家设计如下图所示的光电催化体系,该体系利用双极膜既能将
 转化为
转化为 所释放的化学能用于驱动阴极
所释放的化学能用于驱动阴极 的高效生成,同时还可以实现烟气脱
的高效生成,同时还可以实现烟气脱 。
。
(4)阳极的电极反应为
(5)理论上每生成
 ,可以实现烟气脱
,可以实现烟气脱 的物质的量为
的物质的量为III.测定
 含量:
含量:(6)取所得
 水溶液amL,用
水溶液amL,用 酸性溶液滴定,消耗
酸性溶液滴定,消耗 酸性溶液vmL。已知:
酸性溶液vmL。已知: 的还原产物是
的还原产物是 。
。①
 酸性溶液与
酸性溶液与 反应的离子方程式为
反应的离子方程式为②所得
 水溶液中
水溶液中 的物质的量浓度为
的物质的量浓度为 。
。
您最近一年使用:0次
2023-01-09更新
|
493次组卷
|
4卷引用:专题18 原理综合题
22-23高二上·北京顺义·期末
8 . 硫酸工业制法中,反应之一为: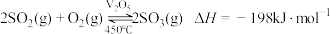 。
。
科学家分析其主要反应机理如下
反应Ⅰ: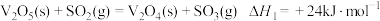
反应Ⅱ:……
反应中的能量变化如图。下列说法中不正确 的是
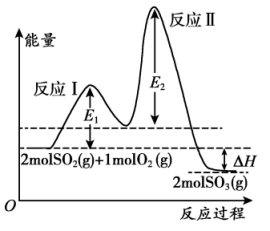
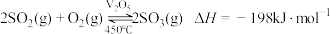 。
。科学家分析其主要反应机理如下
反应Ⅰ:
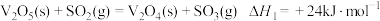
反应Ⅱ:……
反应中的能量变化如图。下列说法中

A.反应Ⅱ的热化学方程式为: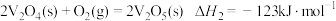 |
B.使用 作为反应催化剂,降低了反应的活化能 作为反应催化剂,降低了反应的活化能 |
C.通入过量空气,可提高 的平衡转化率 的平衡转化率 |
D.温度选择 是综合考虑化学反应速率、化学平衡及催化剂等因素的结果 是综合考虑化学反应速率、化学平衡及催化剂等因素的结果 |
您最近一年使用:0次
2023-01-07更新
|
324次组卷
|
4卷引用:2023年北京卷高考真题变式题(选择题11-14)
(已下线)2023年北京卷高考真题变式题(选择题11-14)北京市顺义区2022-2023学年高二上学期期末质量检测化学试题(已下线)第08讲 化学反应的调控-【暑假自学课】2023年新高二化学暑假精品课(人教版2019选择性必修1)四川省成都市教育科学研究院附属中学2023-2024学年高二上学期10月月考化学试题
22-23高三上·江苏南京·期中
9 . 页岩气中含有CH4、CO2、H2S等气体,是蕴藏于页岩层可供于开采的天然气资源。页岩气的有效利用需要处理其中所含的CO2和H2S。
Ⅰ.CO2的处理:
(1)CO2和CH4重整可制合成气(主要成分为CO、 H2)。
已知下列热化学反应方程式:
C(s)+2H2(g) = CH4(g) ΔH = -74.5 kJ / mol
CO(g)+H2O(g) = CO2(g)+ H2(g) ΔH = - 40.0 kJ / mol
C(s) + H2O(g) = CO(g)+H2(g) ΔH = +132.0 kJ / mol
反应CO2(g) + CH4(g) = 2CO(g)+ 2H2(g)的ΔH=_______ kJ/mol。
(2)Ni催化CO2加 H2形成CH4 ,其历程如图-1所示(吸附在催化剂表面的物种用*标注),反应相同时间,含碳产物中CH4百分含量及CO2的转化率随温度的变化如图-2所示。
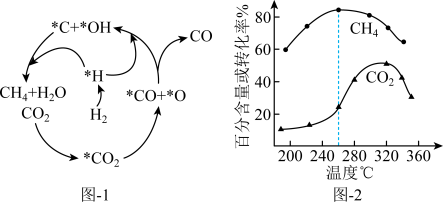
①260℃时,生成生要产物的所发生反应的化学方程式为_______ 。
②温度高于320℃,CO2的转化率下降的原因是_______ 。
③描述CO2转化为CO的反应机理_______ 。
Ⅱ. H2S的处理:
方法一:工业上常采用如图-3电解装置电解K4[Fe(CN)6]和KHCO3混合溶液,电解一段时间后,通入H2S加以处理。利用生成的铁的化合物K3[Fe(CN)6]将气态废弃物中的H2S转化为可利用的硫单质,自身转化为K4[Fe(CN)6]。
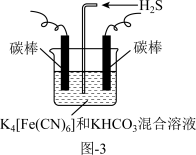
(3)电解时,阳极的电极反应式为_______ 。
方法二:表面喷淋水的活性炭可用于吸附氧化H2S,其原理可用如图-4表示。
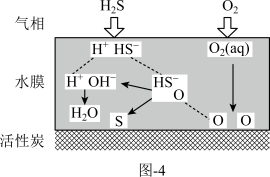
其它条件不变时,水膜的酸碱性与厚度会影响H2S的去除率。
(4)适当增大活性炭表面的水膜pH,H2S的氧化去除率增大的原因是_______ 。
Ⅰ.CO2的处理:
(1)CO2和CH4重整可制合成气(主要成分为CO、 H2)。
已知下列热化学反应方程式:
C(s)+2H2(g) = CH4(g) ΔH = -74.5 kJ / mol
CO(g)+H2O(g) = CO2(g)+ H2(g) ΔH = - 40.0 kJ / mol
C(s) + H2O(g) = CO(g)+H2(g) ΔH = +132.0 kJ / mol
反应CO2(g) + CH4(g) = 2CO(g)+ 2H2(g)的ΔH=
(2)Ni催化CO2加 H2形成CH4 ,其历程如图-1所示(吸附在催化剂表面的物种用*标注),反应相同时间,含碳产物中CH4百分含量及CO2的转化率随温度的变化如图-2所示。

①260℃时,生成生要产物的所发生反应的化学方程式为
②温度高于320℃,CO2的转化率下降的原因是
③描述CO2转化为CO的反应机理
Ⅱ. H2S的处理:
方法一:工业上常采用如图-3电解装置电解K4[Fe(CN)6]和KHCO3混合溶液,电解一段时间后,通入H2S加以处理。利用生成的铁的化合物K3[Fe(CN)6]将气态废弃物中的H2S转化为可利用的硫单质,自身转化为K4[Fe(CN)6]。

(3)电解时,阳极的电极反应式为
方法二:表面喷淋水的活性炭可用于吸附氧化H2S,其原理可用如图-4表示。

其它条件不变时,水膜的酸碱性与厚度会影响H2S的去除率。
(4)适当增大活性炭表面的水膜pH,H2S的氧化去除率增大的原因是
您最近一年使用:0次
21-22高三上·北京海淀·期中
名校
解题方法
10 . 以CO和 为原料合成甲醇是工业上的成熟方法,直接以
为原料合成甲醇是工业上的成熟方法,直接以 为原料生产甲醇是目前的研究热点。我国科学家用
为原料生产甲醇是目前的研究热点。我国科学家用 人工合成淀粉时,第一步就需要将
人工合成淀粉时,第一步就需要将 转化为甲醇。
转化为甲醇。
已知:①
 kJ·mol
kJ·mol
②
 kJ·mol
kJ·mol
③
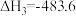 kJ·mol
kJ·mol
下列说法不正确 的是
 为原料合成甲醇是工业上的成熟方法,直接以
为原料合成甲醇是工业上的成熟方法,直接以 为原料生产甲醇是目前的研究热点。我国科学家用
为原料生产甲醇是目前的研究热点。我国科学家用 人工合成淀粉时,第一步就需要将
人工合成淀粉时,第一步就需要将 转化为甲醇。
转化为甲醇。已知:①

 kJ·mol
kJ·mol
②

 kJ·mol
kJ·mol
③

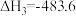 kJ·mol
kJ·mol
下列说法
A.若温度不变,反应①中生成1 mol  时,放出的热量大于90.5 kJ 时,放出的热量大于90.5 kJ |
B. 与 与 合成甲醇的热化学方程式为: 合成甲醇的热化学方程式为:  kJ·mol kJ·mol |
C.通过电解制 和选用高效催化剂,可降低 和选用高效催化剂,可降低 与 与 合成甲醇反应的焓变 合成甲醇反应的焓变 |
D.以 和 和 为原料合成甲醇,同时生成 为原料合成甲醇,同时生成 ,该反应需要吸收能量 ,该反应需要吸收能量 |
您最近一年使用:0次
2022-11-27更新
|
929次组卷
|
7卷引用:2023年北京卷高考真题变式题(选择题11-14)
(已下线)2023年北京卷高考真题变式题(选择题11-14)北京市海淀区2021-2022学年高三上学期期中考试化学试题北京市第二十二中学2021-2022学年高三上学期12月阶段性测试理科化学试题北京市东城区一六六中学2022-2023学年高三上学期期中考试化学试题(已下线)考点17 化学反应的热效应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)化学反应的热效应天津市静海区第一中学2021-2022学年高三上学期12月调研考试化学试题



