名校
解题方法
1 . TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:

资料:TiCl4及所含杂质氯化物的性质
(1)氯化过程: 与
与 难以直接反应,加碳生成CO和
难以直接反应,加碳生成CO和 可使反应得以进行。
可使反应得以进行。
已知:
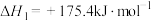


①沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式___________ 。
②氯化过程中CO和CO2可以相互转化,根据如图判断:CO2生成CO反应的
___________ 0(填“>”“<”或“=”)。
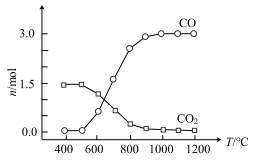
③氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有___________ 。
(2)结构决定物质的性质,请从结构角度解释下列事实的原因。
已知TiCl4分子为正四面体结构。
①TiCl4的沸点高于SiCl4___________ 。
②MgCl2熔点远高于AlCl3___________ 。
(3)根据物质沸点不同可以进行分离提纯。
精制过程:粗TiCl4经两步蒸馏得纯TiCl4。示意图如下:
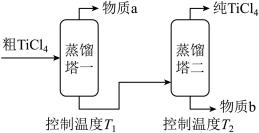
物质a是___________ ,T2应控制在___________ 。

资料:TiCl4及所含杂质氯化物的性质
| 化合物 |  | TiCl4 |  |  |  |
| 沸点/℃ | 58 | 136 | 181(升华) | 316 | 1412 |
| 熔点/℃ | -69 | -25 | 193 | 304 | 714 |
| 在TiCl4的溶解性 | 互溶 | - | 微溶 | 难溶 |
(1)氯化过程:
 与
与 难以直接反应,加碳生成CO和
难以直接反应,加碳生成CO和 可使反应得以进行。
可使反应得以进行。已知:

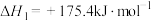


①沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式
②氯化过程中CO和CO2可以相互转化,根据如图判断:CO2生成CO反应的


③氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有
(2)结构决定物质的性质,请从结构角度解释下列事实的原因。
已知TiCl4分子为正四面体结构。
①TiCl4的沸点高于SiCl4
②MgCl2熔点远高于AlCl3
(3)根据物质沸点不同可以进行分离提纯。
精制过程:粗TiCl4经两步蒸馏得纯TiCl4。示意图如下:

物质a是
您最近一年使用:0次
2 . 已知: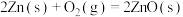
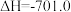 kJ·mol-1
kJ·mol-1

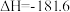 kJ·mol-1
kJ·mol-1
则反应 的
的 为
为
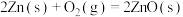
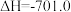 kJ·mol-1
kJ·mol-1
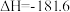 kJ·mol-1
kJ·mol-1则反应
 的
的 为
为| A.+519.4kJ⋅mol-1 | B.-259.7kJ⋅mol-1 | C.+259.7kJ⋅mol-1 | D.-519.4kJ⋅mol-1 |
您最近一年使用:0次
2024-02-07更新
|
351次组卷
|
90卷引用:北京四中2018-2019学年高一下学期期末考试化学试题
北京四中2018-2019学年高一下学期期末考试化学试题(已下线)2011-2012学年黑龙江省牡丹江一中高二上学期期末考试化学试卷(已下线)2011-2012学年浙江省杭州十四中高二上学期期末化学试卷(已下线)2012届陕西省兴平市秦岭中学高三上学期期末练习化学试卷(已下线)2013-2014学年天津市红桥区高二上学期期末考试化学试卷2015-2016学年山东省淄博市淄川一中等三校高二上期末联考化学试卷2015-2016学年河北省沧州一中高一下期末化学试卷黑龙江省大庆市第十中学2016-2017学年高一下学期期末考试化学试题黑龙江省哈尔滨市第三中学2017-2018届高二上学期模块考试(期末)化学试题安徽省滁州市(九校)2017-2018学年高二上学期期末考试化学试题【全国百强校】黑龙江省哈尔滨师范大学附属中学2017-2018学年高一下学期期末考试(理)化学试题黑龙江省牡丹江市第三高级中学2019-2020学年高二上学期期末考试化学试题河南省周口市扶沟县包屯高中2019---2020学年高二上期期末考试化学试题甘肃省张掖市高台县第一中学2018-2019学年高二上学期期末考试理科化学试题河北省张家口市宣化一中2020-2021学年高二上学期期末考试化学试题北京市顺义区第一中学2022-2023学年高二上学期10月月考化学试题青海省西宁市海湖中学2022-2023学年高二上学期期末考试化学试题北京市和平街第一中学2023-2024学年高二上学期10月阶段性练习化学试题北京市首都师范大学附属中学2023-2024学年高二上学期9月检测化学试题宁夏石嘴山三中2015~2016学年度高二上学期期末化学试卷【解析版】广东省江门市新会第一中学2023-2024学年高二上学期期末考试化学试题(已下线)2012届山东省济宁一中高三上学期第二次定时练习化学试卷(已下线)2011-2012学年天津一中高二上学期期中考试化学试卷(已下线)2011-2012学年浙江省嘉兴一中高一下学期期中考试化学试卷(已下线)2011-2012学年天津市天津一中高二上学期期中考试化学试卷(已下线)2012-2013学年江苏省如皋中学高二10月阶段练习化学试卷(已下线)2012-2013学年陕西省三原县北城中学高二第四次月考化学试卷(已下线)2012-2013学年江苏泰州二中高二上学期期中考试化学(选修)试卷(已下线)2013届广东省佛山一中高三第二次段考化学试卷(已下线)2014陕西省西安中学高三上学期第三次质量检测化学试卷(已下线)2014-2015学年湖南省娄底市高二上学期期中联考化学试卷(已下线)2015届吉林省汪清县第六中学高三第三次月考化学试卷(已下线)2014秋安徽省宿州市高二上学期期中化学(理)试卷2014-2015学年黑龙江省伊春市伊春二中高二上学期期中化学试卷2014-2015学年内蒙古巴市一中高二10月月考化学试卷2014-2015学年云南省景洪市第四中学高二下学期期中考试化学试卷2015-2016学年山西太原五中高二上第一周考理科化学试卷2015-2016学年福建省宁德市霞浦七中高二上期中(理)化学试卷2016届福建省三明一中高三上学期第二次月考化学试卷2015-2016学年四川省南充市老林中学高二上学期9月月考化学试卷2015-2016学年福建省福州市文博中学高二上期中化学试卷2017届山东省枣庄三中高三上学期9月质检化学试卷2016-2017学年贵州省湄潭县湄江中学高二上第一次月考化学试卷2016-2017学年河南省南阳市宛东五校高二上第一次联考化学试卷2017届河北邯郸市大名一中高三上学期第二次月考化学试卷2016-2017学年安徽省合肥一中高二上月考一化学试卷2017届福建省柘荣一中、宁德中学高三上联考一化学卷宁夏育才中学2017-2018学年高二9月月考化学试题山东省垦利第一中学2017-2018学年高二上学期第一次月考化学试题河北省邢台第三中学2017-2018学年高二9月月考化学试题湖北省武汉市武昌区2017_2018学年高二化学上学期期中化学试题人教版高二化学选修四专题:化学反应热的计算同步练习卷【全国百强校】福建省上杭县第一中学2018-2019学年高二上学期10月月考化学试题【全国百强校】贵州省铜仁市第一中学2018-2019学年高二上学期期中考试化学试题福建省莆田市第八中学2018-2019学年高二(理)上学期期中考试化学试题海南省海口市第四中学2020届高三上学期摸底考试化学试题福建省福州市长乐高级中学2019-2020学年高二上学期第一次月考化学(学考)试题福建省福州市长乐高级中学2019-2020学年高二上学期第一次月考化学(选考)试题河南省周口中英文学校2019-2020学年高二上学期第一次月考化学试题河南省郑州市106中学2019-2020学年高二9月月考化学(理)试题甘肃省永昌四中2019-2020学年高二上学期期中考试化学试题云南省曲靖市会泽县茚旺高级中学2020届高三上学期11月月考化学试题步步为赢 高二化学寒假作业:作业一 化学反应中的能量变化安徽省涡阳县第一中学2019-2020学年高二12月月考化学试题西藏自治区日喀则市南木林高级中学2019-2020学年高二上学期期中化学试题辽宁省凌源市第三中学2019-2020学年高二下学期第一次月考化学试题宁夏银川市宁夏大学附属中学2019-2020学年高二下期第二次月考化学试题(已下线)1.3.2 反应热的计算(基础练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)山东省滕州市第一中学2020-2021学年高二9月开学收心考试化学试题四川省成都市蓉城高中教育联盟2019-2020学年高二上学期期中联考化学试题福建省漳州市平和县第一中学2021届高三上学期期中考试化学试题吉林油田第十一中学2020-2021学年高二上学期期中考试化学试题四川省达州市宣汉县第二中学2020-2021学年高二上学期期中考试理综化学试题广东省江门市第二中学2020-2021学年高二上学期第二次考试(期中)化学试题海南省海南鑫源高级中学2019-2020学年高二上学期期中考试化学试题2011年普通高等学校招生全国统一考试化学(海南卷)广东省揭阳市揭西县河婆中学2020-2021学年高二上学期第一次月考化学试题黑龙江省牡丹江市第三高级中学2021-2022学年高三上学期第四次月考化学试题四川省峨眉第二中学校2021-2022学年高二下学期5月月考化学试题四川省广安第二中学校2021-2022学年高二上学期第一次月考化学试题辽宁省阜新市第二高级中学2022-2023学年高二上学期9月月考化学试题海南省鑫源中学2021-2022学年高二上学期期中考试化学试题新疆喀什第二中学2022-2023学年高二上学期期中考试化学试题海南省临高县新盈中学2021-2022学年高二上学期(1-4班)期中考试化学试题第3课时 反应焓变的计算第一章 第二节 反应热的计算四川省眉山市仁寿第一中学校(北校区)2023-2024学年高二上学期11月期中化学试题云南省宣威市第三中学2023-2024学年高二上学期第四次月考化学试题四川省泸州市泸县第四中学2023-2024学年高二下学期开学化学试题山东省菏泽市外国语学校2023-2024学年高二上学期化学10月份月考试题
3 .  的转化有助于实现碳循环和碳减排。
的转化有助于实现碳循环和碳减排。
(1)工业用 和
和 在一定条件下分两步反应生产尿素
在一定条件下分两步反应生产尿素 ,其能量变化示意图如下:
,其能量变化示意图如下:
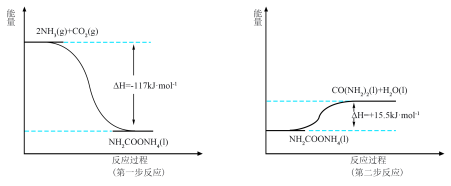
合成尿素总反应的热化学方程式是___________ 。
(2)近年科学家提出“绿色自由”构想。 与
与 在300℃、
在300℃、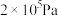 的条件下可生成甲醇,不同温度下,在
的条件下可生成甲醇,不同温度下,在 恒容密闭容器中充入
恒容密闭容器中充入 和
和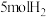 ,相同时间内测得
,相同时间内测得 的转化率随温度的变化如图所示:
的转化率随温度的变化如图所示:
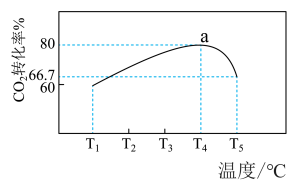
① 阶段温度升高
阶段温度升高 的转化率下降,该反应的
的转化率下降,该反应的
_____ 0(填“ ”或“
”或“ ”),理由是
”),理由是_______ 。
②计算温度为 时a点的平衡常数为
时a点的平衡常数为_______ 。
(3)利用电催化可将 同时转化为多种有机燃料,其原理如图所示。
同时转化为多种有机燃料,其原理如图所示。
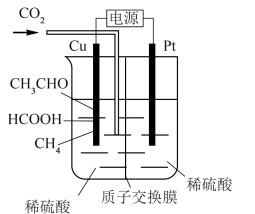
①铜电极上产生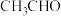 的电极反应式为
的电极反应式为_______ 。
②若铜电极上只生成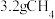 ,则有
,则有____ 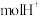 通过质子交换膜。
通过质子交换膜。
③在实际生产中当 过低时,有机燃料产率降低,可能的原因是
过低时,有机燃料产率降低,可能的原因是________ 。
 的转化有助于实现碳循环和碳减排。
的转化有助于实现碳循环和碳减排。(1)工业用
 和
和 在一定条件下分两步反应生产尿素
在一定条件下分两步反应生产尿素 ,其能量变化示意图如下:
,其能量变化示意图如下:
合成尿素总反应的热化学方程式是
(2)近年科学家提出“绿色自由”构想。
 与
与 在300℃、
在300℃、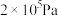 的条件下可生成甲醇,不同温度下,在
的条件下可生成甲醇,不同温度下,在 恒容密闭容器中充入
恒容密闭容器中充入 和
和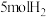 ,相同时间内测得
,相同时间内测得 的转化率随温度的变化如图所示:
的转化率随温度的变化如图所示:
①
 阶段温度升高
阶段温度升高 的转化率下降,该反应的
的转化率下降,该反应的
 ”或“
”或“ ”),理由是
”),理由是②计算温度为
 时a点的平衡常数为
时a点的平衡常数为(3)利用电催化可将
 同时转化为多种有机燃料,其原理如图所示。
同时转化为多种有机燃料,其原理如图所示。
①铜电极上产生
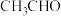 的电极反应式为
的电极反应式为②若铜电极上只生成
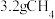 ,则有
,则有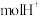 通过质子交换膜。
通过质子交换膜。③在实际生产中当
 过低时,有机燃料产率降低,可能的原因是
过低时,有机燃料产率降低,可能的原因是
您最近一年使用:0次
解题方法
4 . 丙烯是应用广泛的化工原料,工业上两种利用丙烷制备丙烯的反应如下:
I.丙烷直接脱氢: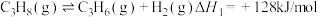
II.氧化丙烷脱氢: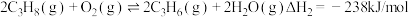
回答下列问题:
(1)反应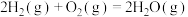 ∆H=
∆H=___________ kJ∙mol-1。
(2)一定条件下,向1L实验容器中充入1mol气态C3H8发生反应Ⅰ。其中主要副反应为:III.丙烷裂解: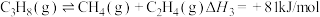 。下图为测得不同温度下C3H6的平衡产率:
。下图为测得不同温度下C3H6的平衡产率:
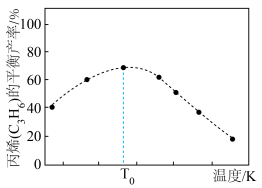
温度高于T0,C3H6的平衡产率随温度升高而减小的原因是___________ 。
(3)运用丙烷直接脱氢法,在相同温度和催化剂条件下,体积均为0.5L的恒容密闭容器中只发生反应I,测得反应的有关数据如下:
①容器a达到平衡时C3H8(g)的平衡浓度为c(C3H8)=___________ ,平衡常数为___________ 。
②容器b经过5分钟达到平衡,则用C3H8(g)表示化学反应速率v(C3H8)=___________ ,反应吸收热量Q为___________ kJ。
③容器c达到平衡时,反应对外___________ (填吸收或放出)热量。
I.丙烷直接脱氢:
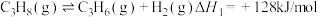
II.氧化丙烷脱氢:
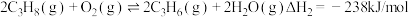
回答下列问题:
(1)反应
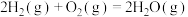 ∆H=
∆H=(2)一定条件下,向1L实验容器中充入1mol气态C3H8发生反应Ⅰ。其中主要副反应为:III.丙烷裂解:
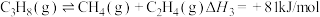 。下图为测得不同温度下C3H6的平衡产率:
。下图为测得不同温度下C3H6的平衡产率:
温度高于T0,C3H6的平衡产率随温度升高而减小的原因是
(3)运用丙烷直接脱氢法,在相同温度和催化剂条件下,体积均为0.5L的恒容密闭容器中只发生反应I,测得反应的有关数据如下:
| 容器 编号 | 起始时各物质物质的量/mol | 达平衡时体系的能量变化 | ||
| C3H8(g) | C3H6(g) | H2(g) | ||
| a | 0 | 1 | 1 | 放热32kJ |
| b | 1 | 0 | 0 | 吸热QkJ |
| c | 0.2 | 0.8 | 0.8 | ∆Hc |
②容器b经过5分钟达到平衡,则用C3H8(g)表示化学反应速率v(C3H8)=
③容器c达到平衡时,反应对外
您最近一年使用:0次
5 .  和
和 是两种造成温室效应的主要气体,高温下可发生干重整反应进行综合利用,反应过程的能量变化如图所示:
是两种造成温室效应的主要气体,高温下可发生干重整反应进行综合利用,反应过程的能量变化如图所示:
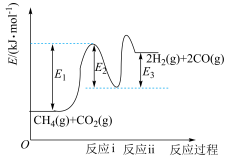
(1)干重整主反应的热化学方程式为_____ (用 、
、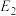 、
、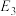 表示反应热),反应速率由反应决定
表示反应热),反应速率由反应决定_____ (填“ⅰ”或“ⅱ”)。
(2)反应器中还同时存在副反应: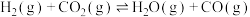
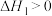
①下图表示投料比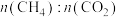 为
为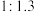 时,不同温度下的反应结果,下列说法中正确的是
时,不同温度下的反应结果,下列说法中正确的是_____ 。(填字母)
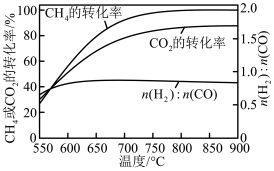
A.加压有利于增大 和
和 反应的速率但不利于提高二者的平衡转化率
反应的速率但不利于提高二者的平衡转化率
B.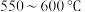 ,升温更有利于主反应,主反应先达到平衡
,升温更有利于主反应,主反应先达到平衡
C.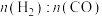 始终低于
始终低于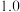 ,与副反应有关
,与副反应有关
②体系中会发生积炭反应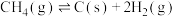
 ,为研究其热效应,还需要利用反应
,为研究其热效应,还需要利用反应_____ 的 。
。
③添加一定量的载氧剂 ,可避免积炭反应发生,增大
,可避免积炭反应发生,增大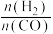 的值,推测可能发生的反应,写出化学反应方程式
的值,推测可能发生的反应,写出化学反应方程式_____ 。
(3)文献中指出 和
和 可以发生反应生成
可以发生反应生成 和
和 ,且反应进行程度较大,但干重整反应器中进行程度小。结合键能数据,从平衡角度阐明理由
,且反应进行程度较大,但干重整反应器中进行程度小。结合键能数据,从平衡角度阐明理由_____ 。
 和
和 是两种造成温室效应的主要气体,高温下可发生干重整反应进行综合利用,反应过程的能量变化如图所示:
是两种造成温室效应的主要气体,高温下可发生干重整反应进行综合利用,反应过程的能量变化如图所示:
(1)干重整主反应的热化学方程式为
 、
、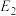 、
、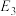 表示反应热),反应速率由反应决定
表示反应热),反应速率由反应决定(2)反应器中还同时存在副反应:
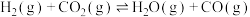
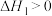
①下图表示投料比
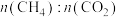 为
为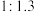 时,不同温度下的反应结果,下列说法中正确的是
时,不同温度下的反应结果,下列说法中正确的是
A.加压有利于增大
 和
和 反应的速率但不利于提高二者的平衡转化率
反应的速率但不利于提高二者的平衡转化率B.
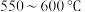 ,升温更有利于主反应,主反应先达到平衡
,升温更有利于主反应,主反应先达到平衡C.
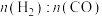 始终低于
始终低于 ,与副反应有关
,与副反应有关②体系中会发生积炭反应
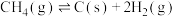
 ,为研究其热效应,还需要利用反应
,为研究其热效应,还需要利用反应 。
。③添加一定量的载氧剂
 ,可避免积炭反应发生,增大
,可避免积炭反应发生,增大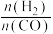 的值,推测可能发生的反应,写出化学反应方程式
的值,推测可能发生的反应,写出化学反应方程式(3)文献中指出
 和
和 可以发生反应生成
可以发生反应生成 和
和 ,且反应进行程度较大,但干重整反应器中进行程度小。结合键能数据,从平衡角度阐明理由
,且反应进行程度较大,但干重整反应器中进行程度小。结合键能数据,从平衡角度阐明理由| 化学键 | 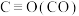 |  |  |  |
键能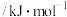 | 1072 | 436 | 413 | 464 |
您最近一年使用:0次
6 . 氯苯是工业废水中的常见污染物,将其降解或资源化转化在能源利用、环境保护等方面意义重大。通常,废水中氯苯的处理过程为:

资料:25℃、101kPa时,氯苯、邻苯二酚燃烧反应的热化学方程式如下:
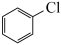 (l)
(l)
 (s)
(s)
(1)25℃、101kPa时,在催化剂作用下,氯苯与 、
、 反应生成邻苯二酚和
反应生成邻苯二酚和 的热化学方程式为
的热化学方程式为___________ 。
(2)可用于检验转化ii后是否有邻苯二酚剩余的试剂为___________ 。
(3)传统处理工艺常用空气将废水中的氯苯吹出,所得空气、氯苯的混合气体通过催化剂表面完成转化i,所得产物在实验条件下均为气态。其他条件不变时,增大通入废水的空气流速,废水中氯苯去除率提高;但i中氯苯的转化率降低。氯苯转化率降低的可能原因是___________ (填字母)。
a.单位时间内通过催化剂表面的混合气体变少
b.混合气体在催化剂表面反应的时间变短
c.i中转化反应的化学平衡常数变小
(4)我国科研人员开发了一种电化学装置(如图),可在更温和的条件下实现转化i、ii。
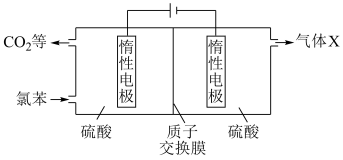
①阳极区发生的电极反应为:___________ 。(补充不完整的反应)

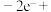 □___________=
□___________= +□___________+□___________
+□___________+□___________


②资料:电解效率
一定时间内,阴极共得到44.8L气体X(标准状况), 。若阳极区
。若阳极区 (
( )=5%,所有邻苯二酚完全转化为
)=5%,所有邻苯二酚完全转化为 ,则
,则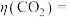
___________ 。
③一段时间后,阴极区溶液pH保持不变,结合化学用语解释其原因:___________ 。

资料:25℃、101kPa时,氯苯、邻苯二酚燃烧反应的热化学方程式如下:
 (l)
(l)
 (s)
(s)
(1)25℃、101kPa时,在催化剂作用下,氯苯与
 、
、 反应生成邻苯二酚和
反应生成邻苯二酚和 的热化学方程式为
的热化学方程式为(2)可用于检验转化ii后是否有邻苯二酚剩余的试剂为
(3)传统处理工艺常用空气将废水中的氯苯吹出,所得空气、氯苯的混合气体通过催化剂表面完成转化i,所得产物在实验条件下均为气态。其他条件不变时,增大通入废水的空气流速,废水中氯苯去除率提高;但i中氯苯的转化率降低。氯苯转化率降低的可能原因是
a.单位时间内通过催化剂表面的混合气体变少
b.混合气体在催化剂表面反应的时间变短
c.i中转化反应的化学平衡常数变小
(4)我国科研人员开发了一种电化学装置(如图),可在更温和的条件下实现转化i、ii。

①阳极区发生的电极反应为:

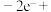 □___________=
□___________= +□___________+□___________
+□___________+□___________

②资料:电解效率

一定时间内,阴极共得到44.8L气体X(标准状况),
 。若阳极区
。若阳极区 (
( )=5%,所有邻苯二酚完全转化为
)=5%,所有邻苯二酚完全转化为 ,则
,则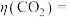
③一段时间后,阴极区溶液pH保持不变,结合化学用语解释其原因:
您最近一年使用:0次
名校
解题方法
7 .  与ICl的反应机理如下:
与ICl的反应机理如下:
反应①: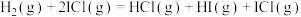 ;
;
反应②: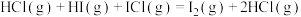 ,
,
其能量曲线如下图所示。不正确 的是
 与ICl的反应机理如下:
与ICl的反应机理如下:反应①:
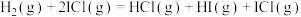 ;
;反应②:
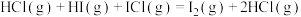 ,
,其能量曲线如下图所示。

A.反应①的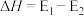 |
| B.反应①②均是放热反应 |
C. 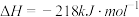 |
| D.该反应的反应速率主要取决于②的快慢 |
您最近一年使用:0次
2024-01-20更新
|
187次组卷
|
3卷引用:北京市顺义区2023-2024学年高二上学期期末质量监测化学试题
解题方法
8 . 甲醇是一种重要的化工原料,具有广阔的开发和应用前景。工业上使用水煤气(CO与H2的混合气体)转化成甲醇(CH3OH)。
(1)已知一定条件下,发生反应: ,
,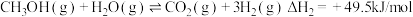 ,该条件下,水煤气转化成甲醇的热化学方程式是
,该条件下,水煤气转化成甲醇的热化学方程式是________ 。
(2)在体积可变的恒压密闭容器中投入0.5 mol CO和0.75 mol H2,不同条件下发生上述反应。实验测得平衡时CH3OH的物质的量(n)随温度(T)、压强(p)的变化如图1所示。
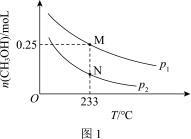
①p1____ p2(填“<”或“>”)。
②M点对应的平衡混合气体的体积为1 L,则233 ℃时,该反应的平衡常数K=_______ ,H2的转化率为______ (保留1位小数)。
③下列叙述能说明上述反应在p1条件下达到化学平衡状态的是_______ (填字母)。
a.单位时间内消耗1 mol CO的同时生成1 mol CH3OH
b.CH3OH的体积分数不再改变
c.密闭容器的体积不再改变
(3)工业上可利用甲醇羰基化法进一步制取甲酸甲酯: 。在容积不变的密闭容器中,投入等物质的量的CH3OH和CO,相同时间内CO的转化率随温度变化如图2所示(不考虑其他副反应)。
。在容积不变的密闭容器中,投入等物质的量的CH3OH和CO,相同时间内CO的转化率随温度变化如图2所示(不考虑其他副反应)。
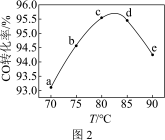
①b、c、d三点中,尚未达到化学平衡状态的点是________ 。
②该反应是_______ (填“放热”或“吸热”)反应。
③曲线ac段和de段的变化趋势不同。试从反应速率和平衡角度说明理由:________ 。
(1)已知一定条件下,发生反应:
 ,
,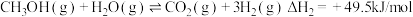 ,该条件下,水煤气转化成甲醇的热化学方程式是
,该条件下,水煤气转化成甲醇的热化学方程式是(2)在体积可变的恒压密闭容器中投入0.5 mol CO和0.75 mol H2,不同条件下发生上述反应。实验测得平衡时CH3OH的物质的量(n)随温度(T)、压强(p)的变化如图1所示。

①p1
②M点对应的平衡混合气体的体积为1 L,则233 ℃时,该反应的平衡常数K=
③下列叙述能说明上述反应在p1条件下达到化学平衡状态的是
a.单位时间内消耗1 mol CO的同时生成1 mol CH3OH
b.CH3OH的体积分数不再改变
c.密闭容器的体积不再改变
(3)工业上可利用甲醇羰基化法进一步制取甲酸甲酯:
 。在容积不变的密闭容器中,投入等物质的量的CH3OH和CO,相同时间内CO的转化率随温度变化如图2所示(不考虑其他副反应)。
。在容积不变的密闭容器中,投入等物质的量的CH3OH和CO,相同时间内CO的转化率随温度变化如图2所示(不考虑其他副反应)。
①b、c、d三点中,尚未达到化学平衡状态的点是
②该反应是
③曲线ac段和de段的变化趋势不同。试从反应速率和平衡角度说明理由:
您最近一年使用:0次
名校
解题方法
9 . 我国科学家研发的“液态阳光”计划通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢制备甲醇。制备甲醇过程中主要存在以下反应:
主反应ⅰ:
(1)请结合反应: ,写出一个生成
,写出一个生成 的副反应ⅱ的热化学方程式:
的副反应ⅱ的热化学方程式:_______ 。
(2)将 和
和 按物质的量比
按物质的量比 混合,以固定流速通过盛放
混合,以固定流速通过盛放 催化剂的反应器,在相同时间内,其中
催化剂的反应器,在相同时间内,其中 的平衡转化率
的平衡转化率 的选择性
的选择性 随温度、压强变化如图所示:
随温度、压强变化如图所示:

已知: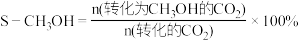
①请判断 的大小关系:
的大小关系:
_______  (填“>”或“<”)。
(填“>”或“<”)。
② 左右,体系发生的反应主要是
左右,体系发生的反应主要是_______ (填“i”或“ii”)。
③若只发生主反应ⅰ和副反应ⅱ,平衡时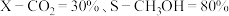 ,则
,则 的转化率为
的转化率为_______  。
。
(3)使用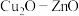 薄膜电极作阴极,通过电催化法可以将二氧化碳转化为甲醇。
薄膜电极作阴极,通过电催化法可以将二氧化碳转化为甲醇。
①将铜箔放入煮沸的饱和硫酸铜溶液中,制得 薄膜电极。反应的离子方程式为
薄膜电极。反应的离子方程式为_______ 。
②用 薄膜电极作阴极,
薄膜电极作阴极,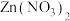 溶液作电解液,采用电沉积法制备
溶液作电解液,采用电沉积法制备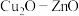 薄膜电极,制备完成后电解液中检测到了
薄膜电极,制备完成后电解液中检测到了 。制备
。制备 薄膜的电极反应式为
薄膜的电极反应式为_______ 。
③电催化法制备甲醇如图所示。若忽略电解液体积变化,电解过程中阴极室溶液的 基本不变,结合电极反应解释原因:
基本不变,结合电极反应解释原因:_______ 。
主反应ⅰ:

(1)请结合反应:
 ,写出一个生成
,写出一个生成 的副反应ⅱ的热化学方程式:
的副反应ⅱ的热化学方程式:(2)将
 和
和 按物质的量比
按物质的量比 混合,以固定流速通过盛放
混合,以固定流速通过盛放 催化剂的反应器,在相同时间内,其中
催化剂的反应器,在相同时间内,其中 的平衡转化率
的平衡转化率 的选择性
的选择性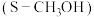 随温度、压强变化如图所示:
随温度、压强变化如图所示:
已知:
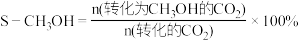
①请判断
 的大小关系:
的大小关系:
 (填“>”或“<”)。
(填“>”或“<”)。②
 左右,体系发生的反应主要是
左右,体系发生的反应主要是③若只发生主反应ⅰ和副反应ⅱ,平衡时
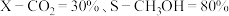 ,则
,则 的转化率为
的转化率为 。
。(3)使用
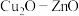 薄膜电极作阴极,通过电催化法可以将二氧化碳转化为甲醇。
薄膜电极作阴极,通过电催化法可以将二氧化碳转化为甲醇。①将铜箔放入煮沸的饱和硫酸铜溶液中,制得
 薄膜电极。反应的离子方程式为
薄膜电极。反应的离子方程式为②用
 薄膜电极作阴极,
薄膜电极作阴极,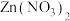 溶液作电解液,采用电沉积法制备
溶液作电解液,采用电沉积法制备 薄膜电极,制备完成后电解液中检测到了
薄膜电极,制备完成后电解液中检测到了 。制备
。制备 薄膜的电极反应式为
薄膜的电极反应式为③电催化法制备甲醇如图所示。若忽略电解液体积变化,电解过程中阴极室溶液的
 基本不变,结合电极反应解释原因:
基本不变,结合电极反应解释原因:
您最近一年使用:0次
名校
解题方法
10 . 已知:2H2O(l)=2H2(g)+O2(g) ΔH=+571.0 kJ/mol。以太阳能为热源分解Fe3O4,经热化学铁氧化合物循环分解水制H2的过程如下:
过程Ⅰ:2Fe3O4(s)=6FeO(s)+O2(g) ΔH=+313.2 kJ/mol
过程Ⅱ:…
过程Ⅰ:2Fe3O4(s)=6FeO(s)+O2(g) ΔH=+313.2 kJ/mol
过程Ⅱ:…
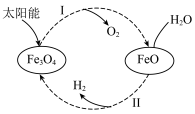
| A.过程Ⅰ中每消耗232 g Fe3O4转移2 mol电子 |
| B.过程Ⅱ的热化学方程式为3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) ΔH=+128.9 kJ/mol |
| C.过程Ⅰ、Ⅱ中能量转化的形式依次是太阳能→化学能→热能 |
| D.铁氧化合物循环制H2具有成本低、产物易分离等优点 |
您最近一年使用:0次
2023-09-19更新
|
359次组卷
|
25卷引用:【区级联考】北京市石景山区2019届高三第一学期期末考试化学试题
【区级联考】北京市石景山区2019届高三第一学期期末考试化学试题辽宁省锦州市滨海实验中学2019-2020学年高三上学期期末考试化学试题海南省海南中学2019-2020学年高二上学期期末考试化学试题(已下线)《2020年新高考政策解读与配套资源》模拟试题10-2020年北京新高考化学模拟试题河北省安平中学2020-2021学年高一下学期第四次月考(期末)化学试题(已下线)专题九 化学能与热能(提分特训)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训甘肃省天水市甘谷第一中学2019-2020学年高二下学期开学考试化学试题鲁科版(2019)选择性必修1第1章 化学反应与能量转化 第1节综合训练高中必刷题高二选择性必修1第一章 化学反应的热效应 第二节 反应热的计算 第二节综合训练河北省沧州市泊头市第一中学2020-2021学年高二上学期第一次月考化学试题山东省德州市夏津第一中学2020-2021学年高二上学期9月月考化学试题辽源市第五中学2019-2020学年高一下学期第二次月考化学试题湖南省中方一中2020-2021学年高二上学期期中考试化学试题河北省沧州市黄骅中学2020-2021学年高二上学期第三次月考化学试题河南省鹤壁市高级中学2020-2021学年高二上学期尖子生联赛调研二化学试题(已下线)模块七 化学反应与能量(模块检测)-2022年高考化学一轮复习小题多维练(全国通用)(已下线)第一单元培优练-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)贵州省黔西南州赛文高级中学 2021-2022学年高二上学期期中考试化学试题河北省沧州市泊头市第一中学2021-2022学年高二上学期第一次月考化学试题天津市第二中学2022-2023学年高二上学期期中检测化学试题(已下线)第七章 化学反应速率与化学平衡 热点强化12 化学反应历程、机理的分析应用(已下线)题型98 结合反应能量图示或物质循环图示书写热化学方程式山东省烟台市招远第一中学2022-2023学年高一下学期期中考试化学(等级考)试题(已下线)章末综合评价(六)河南省洛阳市宜阳县第一高级中学清北园2023-2024学年高一上学期第七次能力达标测试化学试卷



