1 . 以二氧化碳为原料制备尿素工艺被广泛研究。其反应机理为:
反应Ⅰ:CO2(g)+2NH3(g)⇌NH2COONH4(l) ∆H1=-117.2 kJ·mol−1
反应Ⅱ:NH2COONH4(l)⇌NH2CONH2(l)+H2O(l) ∆H2= +15.0 kJ·mol−1
(1)反应Ⅰ平衡常数K的表达式为_____________ 。
(2)由CO2(g)和NH3(g)合成尿素NH2CONH2(l)的热化学方程式是__________ 。
(3)在恒容容器中按物质的量之比1∶2通入CO2和NH3,下列不能说明合成尿素反应达平衡状态的是_________ 。
A.容器中气体平均相对分子质量不再变化
B.容器中气体密度不再变化
C.NH3的体积分数不再变化
D.容器内压强不再变化
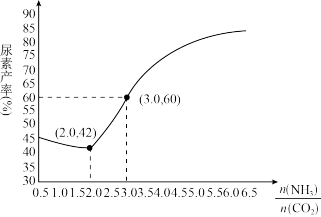
(4)通过实验发现,其他条件不变时,改变NH3、CO2的物质的量之比可增加尿素的产率,如图为 与尿素产率的关系曲线。通过曲线可知:
与尿素产率的关系曲线。通过曲线可知:______________ 过量对尿素产率的影响比较小。若在固定容器中按 等于3.0通入CO2和NH3,则合成尿素反应达平衡后,混合气体中CO2的物质的量分数为
等于3.0通入CO2和NH3,则合成尿素反应达平衡后,混合气体中CO2的物质的量分数为________ (精确到0.1%)。
(5)探究发现,温度、压强、n(H2O)条件对合成尿素反应的影响如图1、图2,根据图象回答下列问题:


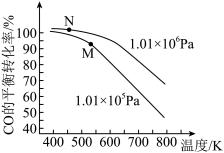
①其他条件不变时,对于合成尿素的反应,若通入CO2物质的量一定,按三种投料比[分别为 3.0、3.5、4.0]投料时,得到如图1的横轴对CO2的平衡转化率的影响曲线。曲线A对应的投料比是________ 。
②图2中a、b、c、d 四条曲线中的两条代表压强分别为20 MPa、25 MPa时CO2平衡转化率曲线,其中表示20MPa的是_________ (填字母)。在实际生产中采用图2中M点而不是N点对应的反应条件,运用化学反应速率和平衡知识,同时考虑生产实际,说明选择该反应条件的主要原因是________ 。
反应Ⅰ:CO2(g)+2NH3(g)⇌NH2COONH4(l) ∆H1=-117.2 kJ·mol−1
反应Ⅱ:NH2COONH4(l)⇌NH2CONH2(l)+H2O(l) ∆H2= +15.0 kJ·mol−1
(1)反应Ⅰ平衡常数K的表达式为
(2)由CO2(g)和NH3(g)合成尿素NH2CONH2(l)的热化学方程式是
(3)在恒容容器中按物质的量之比1∶2通入CO2和NH3,下列不能说明合成尿素反应达平衡状态的是
A.容器中气体平均相对分子质量不再变化
B.容器中气体密度不再变化
C.NH3的体积分数不再变化
D.容器内压强不再变化
(4)通过实验发现,其他条件不变时,改变NH3、CO2的物质的量之比可增加尿素的产率,如图为
 与尿素产率的关系曲线。通过曲线可知:
与尿素产率的关系曲线。通过曲线可知: 等于3.0通入CO2和NH3,则合成尿素反应达平衡后,混合气体中CO2的物质的量分数为
等于3.0通入CO2和NH3,则合成尿素反应达平衡后,混合气体中CO2的物质的量分数为
(5)探究发现,温度、压强、n(H2O)条件对合成尿素反应的影响如图1、图2,根据图象回答下列问题:


①其他条件不变时,对于合成尿素的反应,若通入CO2物质的量一定,按三种投料比[分别为 3.0、3.5、4.0]投料时,得到如图1的横轴对CO2的平衡转化率的影响曲线。曲线A对应的投料比是
②图2中a、b、c、d 四条曲线中的两条代表压强分别为20 MPa、25 MPa时CO2平衡转化率曲线,其中表示20MPa的是
您最近一年使用:0次
名校
解题方法
2 . TiO2和TiCl4均为重要的化工原料,已知:
Ⅰ.TiCl4(g)+O2(g) TiO2(s)+2Cl2(g) ΔH=-175.4kJ/mol
TiO2(s)+2Cl2(g) ΔH=-175.4kJ/mol
Ⅱ.2C(s)+O2(g) 2CO(g) ΔH=-220.9kJ/mol
2CO(g) ΔH=-220.9kJ/mol
请回答下列问题:
(1)TiCl4(g)+2CO(g) TiO2(s)+2C(s)+2Cl2(g)的ΔH=
TiO2(s)+2C(s)+2Cl2(g)的ΔH=___ kJ/mol。
(2)t℃时,向10L恒容密闭容器中充入1molTiCl4和2molO2,发生反应I,4min达到平衡时测得TiO2的物质的量为0.2mol。
①反应0~4min末的平均速率v(Cl2)=_ ,该温度下K=_ (用分数表示),O2的平衡转化率=__ 。
②下列措施,既能加快正反应速率,又能增大O2的平衡转化率的是_ 。
A.缩小容器的体积
B.加入催化剂
C.分离出部分TiO2
D.增加O2的浓度
E.减低温度
F.以上方法均不可以
③t℃时,向10L恒容密闭容器中充入3molTiCl4和一定量的O2,发生反应I,两种气体的平衡转化率(a%)与起始的物质的量之比(TiCl4/O2)的关系如图1所示:能表示O2的平衡转化率的曲线为___ (填“L1”或“L2”),M点的坐标为___ (用整数或分数表示)。

(3)CO是有毒气体,测定空气中CO含量常用的方法之一是电化学气敏传感器法。其中CO传感器的工作原理如图2所示,则工作电极的反应式为___ ;为减少对环境造成的影响,用CO和H2可以制备甲醇(CH3OH),以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)若电解质溶液中KOH的物质的量为0.8mol,当有0.5mol甲醇参与反应时,电解质溶液中溶质的主要成分是___ (写化学式)。

Ⅰ.TiCl4(g)+O2(g)
 TiO2(s)+2Cl2(g) ΔH=-175.4kJ/mol
TiO2(s)+2Cl2(g) ΔH=-175.4kJ/molⅡ.2C(s)+O2(g)
 2CO(g) ΔH=-220.9kJ/mol
2CO(g) ΔH=-220.9kJ/mol请回答下列问题:
(1)TiCl4(g)+2CO(g)
 TiO2(s)+2C(s)+2Cl2(g)的ΔH=
TiO2(s)+2C(s)+2Cl2(g)的ΔH=(2)t℃时,向10L恒容密闭容器中充入1molTiCl4和2molO2,发生反应I,4min达到平衡时测得TiO2的物质的量为0.2mol。
①反应0~4min末的平均速率v(Cl2)=
②下列措施,既能加快正反应速率,又能增大O2的平衡转化率的是
A.缩小容器的体积
B.加入催化剂
C.分离出部分TiO2
D.增加O2的浓度
E.减低温度
F.以上方法均不可以
③t℃时,向10L恒容密闭容器中充入3molTiCl4和一定量的O2,发生反应I,两种气体的平衡转化率(a%)与起始的物质的量之比(TiCl4/O2)的关系如图1所示:能表示O2的平衡转化率的曲线为

(3)CO是有毒气体,测定空气中CO含量常用的方法之一是电化学气敏传感器法。其中CO传感器的工作原理如图2所示,则工作电极的反应式为

您最近一年使用:0次
2020-04-13更新
|
193次组卷
|
2卷引用:湖北省武汉外国语学校2022-2023学年高二上学期第五次阶段性测试化学试题
3 . “低碳经济”已成为全世界科学家研究的重要课题。为减小和消除 CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对 CO2 创新利用的研究。
(1)已知:①CO(g)+H2O(g) H2(g)+CO2(g) △H=-41kJ/mol
H2(g)+CO2(g) △H=-41kJ/mol
②C(s)+2H2(g) CH4(g) △H=-73kJ/mol
CH4(g) △H=-73kJ/mol
③2CO(g) C(s)+CO2(g) △H=-171kJ/mol
C(s)+CO2(g) △H=-171kJ/mol
写出CO2与H2反应生成CH4和H2O(g)的热化学方程式:_____ 。
(2)目前工业上有一种方法是用 CO2来生产燃料甲醇。为探究该反应原理,在容积为 2L密闭容器中,充入1molCO2和 3.25molH2在一定条件下发生反应,测得 CO2、CH3OH(g)和 H2O(g)的物质的量(n)随时间的变化如图所示:
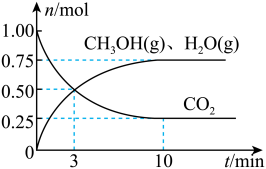
①从反应开始到平衡,氢气的平均反应速率v(H2)=____ 。
②下列措施一定不能使CO2的平衡转化率增大的是____ (填字母)。
A.在原容器中再充入1molCO2
B.在原容器中再充入1molH2
C.在原容器中充入1mol氦气
D.使用更有效的催化剂
E.缩小容器的容积
F.将水蒸气从体系中分离
(3)煤化工通常研究不同条件下CO转化率以解决实际问题。已知在催化剂存在条件下反应:CO(g)+H2O(g)⇌H2(g)+CO2(g)的平衡转化率随p(H2O)/p(CO)及温度变化关系如图所示:
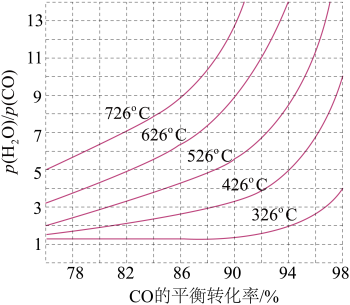
①上述反应的正反应方向是____ (填“吸热”或“放热”)反应;
②对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作 Kp),则在恒温密闭容器中,该反应的Kp与Kc的关系是_______ ,如果提高p(H2O)/p(CO),则Kp_______ (填“变大”“变小”或“不变”);使用铁镁催化剂的实际工业流程中,一般采用400℃左右,p(H2O)/p(CO) =3~5,采取此条件的原因可能是 _________ 。
(4)科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置实现了用CO2和H2O合成CH4。下列关于该电池的叙述正确的是____ (填字母)。
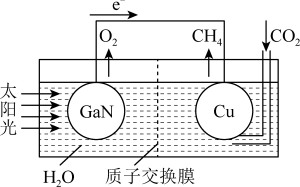
A.该装置能量转化形式仅存在太阳能转化为电能
B.铜电极为正极,电极反应式为CO2+8e-+8H+=CH4+2H2O
C.电池内部H+透过质子交换膜从左向右移动
D.反应结束后,理论上溶液的 pH 值保持不变
(1)已知:①CO(g)+H2O(g)
 H2(g)+CO2(g) △H=-41kJ/mol
H2(g)+CO2(g) △H=-41kJ/mol②C(s)+2H2(g)
 CH4(g) △H=-73kJ/mol
CH4(g) △H=-73kJ/mol③2CO(g)
 C(s)+CO2(g) △H=-171kJ/mol
C(s)+CO2(g) △H=-171kJ/mol写出CO2与H2反应生成CH4和H2O(g)的热化学方程式:
(2)目前工业上有一种方法是用 CO2来生产燃料甲醇。为探究该反应原理,在容积为 2L密闭容器中,充入1molCO2和 3.25molH2在一定条件下发生反应,测得 CO2、CH3OH(g)和 H2O(g)的物质的量(n)随时间的变化如图所示:

①从反应开始到平衡,氢气的平均反应速率v(H2)=
②下列措施一定不能使CO2的平衡转化率增大的是
A.在原容器中再充入1molCO2
B.在原容器中再充入1molH2
C.在原容器中充入1mol氦气
D.使用更有效的催化剂
E.缩小容器的容积
F.将水蒸气从体系中分离
(3)煤化工通常研究不同条件下CO转化率以解决实际问题。已知在催化剂存在条件下反应:CO(g)+H2O(g)⇌H2(g)+CO2(g)的平衡转化率随p(H2O)/p(CO)及温度变化关系如图所示:

①上述反应的正反应方向是
②对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作 Kp),则在恒温密闭容器中,该反应的Kp与Kc的关系是
(4)科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置实现了用CO2和H2O合成CH4。下列关于该电池的叙述正确的是

A.该装置能量转化形式仅存在太阳能转化为电能
B.铜电极为正极,电极反应式为CO2+8e-+8H+=CH4+2H2O
C.电池内部H+透过质子交换膜从左向右移动
D.反应结束后,理论上溶液的 pH 值保持不变
您最近一年使用:0次
4 . 火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会对环境造成严重影响。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。
利用甲烷催化还原NOx:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160 kJ/mol
则甲烷直接将NO2还原为N2的热化学方程式为________________ 。
(2)脱碳。
将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
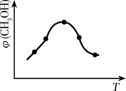
①取五份等体积的CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后 ,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图所示,则上述CO2转化为甲醇的反应热△H3_____ 0(填“>”、“<”或“=”),该反应的平衡常数表达式为_______________ 。
②在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图所示,试回答:
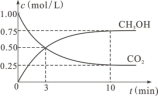
0~10 min内,氢气的平均反应速率为___________________ mol/(L·min)。第10 min后,若向该容器中再充入1 mol CO2和3 mol H2,则再次达到平衡时CH3OH(g)的体积分数____________ (填“增大”、“减小”或“不变”,下同),反应的平衡常数_____________________ 。
(3)脱硫。
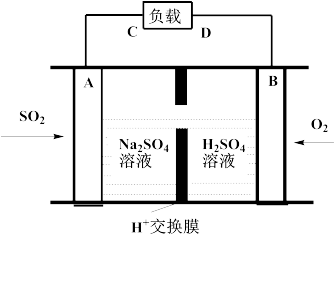
①有学者想利用如图所示装置用原电池原理将SO2转化为重要的化工原料。A、B是惰性电极,A极的电极反应式为:_________ 。
②某种脱硫工艺中将废气处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物,可作为化肥。常温下,将NH4NO3 溶解于水中,为了使该溶液中的NH4+ 和 NO3-离子的物质的量浓度之比等于1 : 1,可以采取的正确措施为_________ 。
A.加入适量的硝酸,抑制 NH4+的水解
B.加入适量的氨水,使溶液的 PH = 7
C.加入适量的 NaOH 溶液,使溶液的PH = 7
D.加入适量的NH4NO3
(1)脱硝。
利用甲烷催化还原NOx:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160 kJ/mol
则甲烷直接将NO2还原为N2的热化学方程式为
(2)脱碳。
将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3①取五份等体积的CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应

②在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图所示,试回答:

0~10 min内,氢气的平均反应速率为
(3)脱硫。
①有学者想利用如图所示装置用原电池原理将SO2转化为重要的化工原料。A、B是惰性电极,A极的电极反应式为:

②某种脱硫工艺中将废气处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物,可作为化肥。常温下,将NH4NO3 溶解于水中,为了使该溶液中的NH4+ 和 NO3-离子的物质的量浓度之比等于1 : 1,可以采取的正确措施为
A.加入适量的硝酸,抑制 NH4+的水解
B.加入适量的氨水,使溶液的 PH = 7
C.加入适量的 NaOH 溶液,使溶液的PH = 7
D.加入适量的NH4NO3
您最近一年使用:0次
名校
解题方法
5 . 新旧动能转换工程之一是新能源新材料的挖掘和应用。乙二醇是重要的化工原料, 煤基合成气(CO、H2)间接制乙二醇具有转化率高、回收率高等优点,是我国一项拥有自主知识产权的世界首创技术,制备过程如下:
反应 I:4NO(g)+4CH3OH(g)+O2(g) 4CH3ONO(g)+2H2O(g) △H1 =akJ·mol-1
4CH3ONO(g)+2H2O(g) △H1 =akJ·mol-1
反应Ⅱ:2CO(g)+2CH3ONO(g) CH3OOCCOOCH3(l)+2NO(g) △H2=b kJ·mol-1
CH3OOCCOOCH3(l)+2NO(g) △H2=b kJ·mol-1
反应 Ⅲ:CH3OOCCOOCH3(1)+4H2(g) HOCH2CH2OH(1)+2CH3OH(g) △H3=c kJ·mol-1
HOCH2CH2OH(1)+2CH3OH(g) △H3=c kJ·mol-1
(1)请写出煤基合成气[n(CO):n(H2)= 1:2]与氧气间接合成乙二醇的总热化学方程式:__ ,该反应在较低温条件下能自发进行,则ΔH___ 0(填“>”、“<”或“=”)。
(2)一定温度下,在2L的密闭容器中投入物质的量均为0.4mol的CO和CH3ONO发生反应Ⅱ,10min达到平衡时CO的体积分数与NO的体积分数相等。
①下列选项能判断反应已达到化学平衡状态的是____ 。
a.CO的质量不再变化
b.混合气体的密度不再变化
c.单位时间内生成CO和NO的物质的量相等
d.CO和CH3ONO的浓度比不再变化
②若此时向容器中再通入0.4molNO,一段时间后,达到新平衡时NO的体积分数与原平衡时相比__ (填“增大”“相等”“减小”或“不能确定”)。
③若该反应△H<0,在恒容的密闭容器中,反应达平衡后,改变某一条件,下列示意图正确的是____ (填字母)。
a. b.
b. 
c.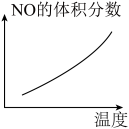 d.
d. 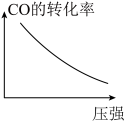
反应 I:4NO(g)+4CH3OH(g)+O2(g)
 4CH3ONO(g)+2H2O(g) △H1 =akJ·mol-1
4CH3ONO(g)+2H2O(g) △H1 =akJ·mol-1反应Ⅱ:2CO(g)+2CH3ONO(g)
 CH3OOCCOOCH3(l)+2NO(g) △H2=b kJ·mol-1
CH3OOCCOOCH3(l)+2NO(g) △H2=b kJ·mol-1反应 Ⅲ:CH3OOCCOOCH3(1)+4H2(g)
 HOCH2CH2OH(1)+2CH3OH(g) △H3=c kJ·mol-1
HOCH2CH2OH(1)+2CH3OH(g) △H3=c kJ·mol-1(1)请写出煤基合成气[n(CO):n(H2)= 1:2]与氧气间接合成乙二醇的总热化学方程式:
(2)一定温度下,在2L的密闭容器中投入物质的量均为0.4mol的CO和CH3ONO发生反应Ⅱ,10min达到平衡时CO的体积分数与NO的体积分数相等。
①下列选项能判断反应已达到化学平衡状态的是
a.CO的质量不再变化
b.混合气体的密度不再变化
c.单位时间内生成CO和NO的物质的量相等
d.CO和CH3ONO的浓度比不再变化
②若此时向容器中再通入0.4molNO,一段时间后,达到新平衡时NO的体积分数与原平衡时相比
③若该反应△H<0,在恒容的密闭容器中,反应达平衡后,改变某一条件,下列示意图正确的是
a.
 b.
b. 
c.
 d.
d. 
您最近一年使用:0次
名校
解题方法
6 . Cu2O广泛用作颜料和化工生产的催化剂。
Ⅰ.制备Cu2O
(1)电解法:工业上用铜作阳极,钛片为阴极,电解一定浓度的NaOH 溶液可制备氧化亚铜,写出阳极的电极反应式为_____________________
(2)微乳液-还原法:在 100 Cu(NO3)2的水溶液中加入一定体积的 NaOH 水溶液,并搅拌使之混合均匀, 再逐滴加入水合肼的水溶液,直至产生红色沉淀,经抽滤、洗涤和真空干燥,得到Cu2O 粉末。
Cu(NO3)2的水溶液中加入一定体积的 NaOH 水溶液,并搅拌使之混合均匀, 再逐滴加入水合肼的水溶液,直至产生红色沉淀,经抽滤、洗涤和真空干燥,得到Cu2O 粉末。
已知: N2H4(l)+O2(g)=N2(g)+2H2O(l)△H= -akJ/mol
Cu(OH)2(s)=CuO(s)+H2O(l)△H= +bkJ/mol
4CuO(s)=2Cu2O(s)+O2(g)△H= +ckJ/mol
则由N2H4和Cu(OH)2反应制备Cu2O的热化学方程式为________________________ 。
Ⅱ.工业上用Cu2O 与 ZnO 组成的催化剂可用于工业上合成甲醇: CO(g)+2H2(g) CH3OH(g) △H = -90.8 kJ/mol,回答下列问题:
CH3OH(g) △H = -90.8 kJ/mol,回答下列问题:
(1)能说明反应CO(g)+2H2(g) CH3OH(g)已达平衡状态的是
CH3OH(g)已达平衡状态的是( )
A.当反应的热效应△H = -90.8 kJ/mol 时反应达到平衡状态
B.在恒温恒压的容器中,混合气体的密度保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒容的容器中,气体的平均摩尔质量不再变化
(2)在 T1℃时,体积为 2 L 的恒容容器中充入物质的量之和为 3mol 的 H2和CO,当起始 n(H2)/n(CO)= 2 时,经过 5min 达到平衡,CO 的转化率为 0.6,则0~5min 内平均反应速率 v (H2)=___ ;该温度下的平衡常数为__________________ ;若此时再向容器中加入CO(g) 和 CH3OH(g)各 0.4mol,达新平衡时 H2的转化率将 ______ (填“增大”、 “减小”或“不变”);
(3)工业实际合成 CH3OH 生产中,采用下图M点而不是N点对应的反应条件,运用化学反应速率和化学平衡知识,同时考虑生产实际,说明选择该反应条件的理由:________ 。
Ⅰ.制备Cu2O
(1)电解法:工业上用铜作阳极,钛片为阴极,电解一定浓度的NaOH 溶液可制备氧化亚铜,写出阳极的电极反应式为
(2)微乳液-还原法:在 100
 Cu(NO3)2的水溶液中加入一定体积的 NaOH 水溶液,并搅拌使之混合均匀, 再逐滴加入水合肼的水溶液,直至产生红色沉淀,经抽滤、洗涤和真空干燥,得到Cu2O 粉末。
Cu(NO3)2的水溶液中加入一定体积的 NaOH 水溶液,并搅拌使之混合均匀, 再逐滴加入水合肼的水溶液,直至产生红色沉淀,经抽滤、洗涤和真空干燥,得到Cu2O 粉末。已知: N2H4(l)+O2(g)=N2(g)+2H2O(l)△H= -akJ/mol
Cu(OH)2(s)=CuO(s)+H2O(l)△H= +bkJ/mol
4CuO(s)=2Cu2O(s)+O2(g)△H= +ckJ/mol
则由N2H4和Cu(OH)2反应制备Cu2O的热化学方程式为
Ⅱ.工业上用Cu2O 与 ZnO 组成的催化剂可用于工业上合成甲醇: CO(g)+2H2(g)
 CH3OH(g) △H = -90.8 kJ/mol,回答下列问题:
CH3OH(g) △H = -90.8 kJ/mol,回答下列问题:(1)能说明反应CO(g)+2H2(g)
 CH3OH(g)已达平衡状态的是
CH3OH(g)已达平衡状态的是A.当反应的热效应△H = -90.8 kJ/mol 时反应达到平衡状态
B.在恒温恒压的容器中,混合气体的密度保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒容的容器中,气体的平均摩尔质量不再变化
(2)在 T1℃时,体积为 2 L 的恒容容器中充入物质的量之和为 3mol 的 H2和CO,当起始 n(H2)/n(CO)= 2 时,经过 5min 达到平衡,CO 的转化率为 0.6,则0~5min 内平均反应速率 v (H2)=
(3)工业实际合成 CH3OH 生产中,采用下图M点而不是N点对应的反应条件,运用化学反应速率和化学平衡知识,同时考虑生产实际,说明选择该反应条件的理由:
您最近一年使用:0次
2019-01-01更新
|
239次组卷
|
3卷引用:湖北省孝感市汉川市第一高级中学2019-2020学年高二下学期摸底测试化学试题
7 . 氮的氧化物是大气污染物之一,用活性炭或一氧化碳还原氮氧化物,可防止空气污染。回答下列问题:
已知:2C(s)+O2(g)=2CO(g) ΔH=- 221 kJ/mol
C(s)+O2(g)=CO2(g) ΔH=- 393.5 kJ/mol
N2(g)+O2(g)=2NO(g) ΔH= +181 kJ/mol
(1)若某反应的平衡常数表达式为K=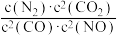 ,请写出此反应的热化学方程式:
,请写出此反应的热化学方程式:_______ ;下列措施能够增大此反应中NO的转化率的是(填字母代号)_______ 。
a.增大容器压强 b.升高温度 c.使用优质催化剂 d.增大CO的浓度
(2)向容积为2L的密闭容器中加入活性炭(足量)和NO,发生反应C(s)+2NO(g) N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。
N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。
①T1℃,0~5min内,以CO2表示的该反应速率v(CO2)=_______ ,该条件下的平衡常数K=_______ 。
②第15 min后,温度调整到T2,数据变化如上表所示,则T1_______ T2(填“>”、“<”或“=”)。
③若30min时,保持T2不变,向该容器中再加入该四种反应混合物各2 mol,则此时反应_______ 移动(填“正向”、“逆向”或“不”);最终达平衡时NO的转化率a=_______ 。
已知:2C(s)+O2(g)=2CO(g) ΔH=- 221 kJ/mol
C(s)+O2(g)=CO2(g) ΔH=- 393.5 kJ/mol
N2(g)+O2(g)=2NO(g) ΔH= +181 kJ/mol
(1)若某反应的平衡常数表达式为K=
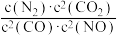 ,请写出此反应的热化学方程式:
,请写出此反应的热化学方程式:a.增大容器压强 b.升高温度 c.使用优质催化剂 d.增大CO的浓度
(2)向容积为2L的密闭容器中加入活性炭(足量)和NO,发生反应C(s)+2NO(g)
 N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。
N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。| 物质的量/mol | T1/℃ | T2/℃ | |||||
| 0 | 5 min | 10 min | 15 min | 20 min | 15 min | 30 min | |
| NO | 2.0 | 1.16 | 0.80 | 0.80 | 0.50 | 0.40 | 0.40 |
| N2 | 0 | 0.42 | 0.60 | 0.60 | 0.75 | 0.80 | 0.80 |
②第15 min后,温度调整到T2,数据变化如上表所示,则T1
③若30min时,保持T2不变,向该容器中再加入该四种反应混合物各2 mol,则此时反应
您最近一年使用:0次
2018-09-10更新
|
353次组卷
|
6卷引用:湖北省随州市第二高级中学2018-2019学年高二9月起点考试(B+C班)化学试题
8 . 铅及其化合物在工业生产、生活中具有非常广泛的用途。
(1)瓦纽科夫法熔炼铅,其相关反应的热化学方程式如下:
①2PbS(s)+3O2(g)=2PbO(s)+2SO2(g) △H1=akJ·mol-1
②PbS(s)2PbO(s)=3Pb(s)+SO2(g) △H2=b kJ·mol-1
③PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g) △H3=c kJ·mol-1
反应3PbS(s)+6O2(g)=3PbSO4(s) △H=____________ kJ·mol-1(用含a、b、c的代数式表示)
(2)以含铅废料(主要含Pb、PbO、PbO2、PbSO4)为原料制备高纯PbO,其主要流程如下:

①“酸溶”时,在Fe2+催化下,Pb和PbO2反应成1 mol PbSO4时转移电子的物质的量为_________ mol。
②已知:PbO溶解在NaOH溶液中,存在化学平衡:PbO(s)+NaOH(aq) NaHPbO2(aq),其溶解度曲线如图1所示:
NaHPbO2(aq),其溶解度曲线如图1所示:

结合上述信息,完成由粗品PbO(所含杂质不溶于NaOH溶液)得到高纯PbO的操作:将粗品PbO溶解在一定量________ (填“35%”或“10%”)的NaOH溶液中,加热至110℃,充分溶解后,_______________ (填 “趁热过滤”或“蒸发浓缩”),将滤液冷却结晶,过滤、洗涤并干燥得到高纯PbO固体。
(3)将粗品PbO溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl4的电解液,电解Na2PbCl4溶液生成Pb的装置如图2所示:

①阴极的电极反应式为______________________ ;
②当有4.14gPb生成时,通过质子交换膜的n(H+)=______________________ 。
(4)PbI2可用于人工降雨。取一定量的PbI2固体,用蒸馏水配制成t℃饱和溶液,准确移取25.00 mL PbI2饱和溶液分次加入阳离子交换树脂RH+(发生反应:2RH++PbI2 =R2Pb+2H++2I-),用250ml洁净的锥形瓶接收流出液,后用蒸馏水淋洗树脂至流出液呈中性,将洗涤液一并盛放到锥形瓶中(如图3)。加入酚酞指示剂,用0.0050mol·L-1NaOH溶液滴定,当达到滴定终点时,用去氢氧化钠溶液10.00mL。可计算出t℃时Ksp(PbI2)为_________________ 。
(1)瓦纽科夫法熔炼铅,其相关反应的热化学方程式如下:
①2PbS(s)+3O2(g)=2PbO(s)+2SO2(g) △H1=akJ·mol-1
②PbS(s)2PbO(s)=3Pb(s)+SO2(g) △H2=b kJ·mol-1
③PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g) △H3=c kJ·mol-1
反应3PbS(s)+6O2(g)=3PbSO4(s) △H=
(2)以含铅废料(主要含Pb、PbO、PbO2、PbSO4)为原料制备高纯PbO,其主要流程如下:

①“酸溶”时,在Fe2+催化下,Pb和PbO2反应成1 mol PbSO4时转移电子的物质的量为
②已知:PbO溶解在NaOH溶液中,存在化学平衡:PbO(s)+NaOH(aq)
 NaHPbO2(aq),其溶解度曲线如图1所示:
NaHPbO2(aq),其溶解度曲线如图1所示:
结合上述信息,完成由粗品PbO(所含杂质不溶于NaOH溶液)得到高纯PbO的操作:将粗品PbO溶解在一定量
(3)将粗品PbO溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl4的电解液,电解Na2PbCl4溶液生成Pb的装置如图2所示:

①阴极的电极反应式为
②当有4.14gPb生成时,通过质子交换膜的n(H+)=
(4)PbI2可用于人工降雨。取一定量的PbI2固体,用蒸馏水配制成t℃饱和溶液,准确移取25.00 mL PbI2饱和溶液分次加入阳离子交换树脂RH+(发生反应:2RH++PbI2 =R2Pb+2H++2I-),用250ml洁净的锥形瓶接收流出液,后用蒸馏水淋洗树脂至流出液呈中性,将洗涤液一并盛放到锥形瓶中(如图3)。加入酚酞指示剂,用0.0050mol·L-1NaOH溶液滴定,当达到滴定终点时,用去氢氧化钠溶液10.00mL。可计算出t℃时Ksp(PbI2)为
您最近一年使用:0次
2018-07-02更新
|
184次组卷
|
2卷引用:【全国市级联考】湖北省天门市、仙桃市、潜江市2017-2018学年高二下学期期末联考化学试题
解题方法
9 . 煤炭属于不可再生资源,高效、清洁地利用煤炭资源至关重要。请回答下列问题:
(1)煤的干馏。煤的干馏反应中△S_____ 0(填“>”“<”或“=”)。
(2)煤的液化。原理是C(s)+H2O(g) CO(g)+H2(g) △H= akJ/mol;CO(g)+2H2(g)
CO(g)+H2(g) △H= akJ/mol;CO(g)+2H2(g) CH3OH(l) △H=bkJ/mol。则反应C(s)+ H2O(g)+H2(g)
CH3OH(l) △H=bkJ/mol。则反应C(s)+ H2O(g)+H2(g) CH3OH(l) 的△H=
CH3OH(l) 的△H=______ kJ/mol。
(3)煤的气化。原理是C(s) +2H2(g) CH4(g) △H。在1L密闭容器中投入1mol碳,并充入2 mol H2,测得相关数据如图所示。
CH4(g) △H。在1L密闭容器中投入1mol碳,并充入2 mol H2,测得相关数据如图所示。

①有关图1、图2 的说法正确的有______ (填标号)。
a.氢气的反应速率v(Z) >v(X) >v(Y)
b.T1<1000K
c.平衡常数K(X)=K(Y) >K(Z)
d.工业生产中,当温度为T2 时,压强越高,经济效益越好
②图2 中A 点对应的平衡常数Kp=_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)煤生产水煤气和半水煤气。
①工业上用煤生产作为合成氨原料气的水煤气,要求气体中(CO + H2) 与N2的体积之比为3.1-3.2,发生的反应有C(s)+H2O(g) CO(g) +H2(g).C(s) +1/2O2(g)
CO(g) +H2(g).C(s) +1/2O2(g) CO(g)。从能量角度考虑,通入空气的目的是
CO(g)。从能量角度考虑,通入空气的目的是__________ 。
②如图3是反应CO(g) +H2O(g) H2(g)+ CO2(g) △H<0 中CO 和CO2 的浓度随时间发生变化的曲线,则t2时刻改变的条件可能是
H2(g)+ CO2(g) △H<0 中CO 和CO2 的浓度随时间发生变化的曲线,则t2时刻改变的条件可能是_______ (写出1种即可)。若t4 时刻通过改变容积的方法将压强增大为原来的2 倍,在图中t4~t5区间内画出CO、CO2浓度变化曲线,并标明物质(假设各物质状态均保持不变)。________

(1)煤的干馏。煤的干馏反应中△S
(2)煤的液化。原理是C(s)+H2O(g)
 CO(g)+H2(g) △H= akJ/mol;CO(g)+2H2(g)
CO(g)+H2(g) △H= akJ/mol;CO(g)+2H2(g) CH3OH(l) △H=bkJ/mol。则反应C(s)+ H2O(g)+H2(g)
CH3OH(l) △H=bkJ/mol。则反应C(s)+ H2O(g)+H2(g) CH3OH(l) 的△H=
CH3OH(l) 的△H=(3)煤的气化。原理是C(s) +2H2(g)
 CH4(g) △H。在1L密闭容器中投入1mol碳,并充入2 mol H2,测得相关数据如图所示。
CH4(g) △H。在1L密闭容器中投入1mol碳,并充入2 mol H2,测得相关数据如图所示。
①有关图1、图2 的说法正确的有
a.氢气的反应速率v(Z) >v(X) >v(Y)
b.T1<1000K
c.平衡常数K(X)=K(Y) >K(Z)
d.工业生产中,当温度为T2 时,压强越高,经济效益越好
②图2 中A 点对应的平衡常数Kp=
(4)煤生产水煤气和半水煤气。
①工业上用煤生产作为合成氨原料气的水煤气,要求气体中(CO + H2) 与N2的体积之比为3.1-3.2,发生的反应有C(s)+H2O(g)
 CO(g) +H2(g).C(s) +1/2O2(g)
CO(g) +H2(g).C(s) +1/2O2(g) CO(g)。从能量角度考虑,通入空气的目的是
CO(g)。从能量角度考虑,通入空气的目的是②如图3是反应CO(g) +H2O(g)
 H2(g)+ CO2(g) △H<0 中CO 和CO2 的浓度随时间发生变化的曲线,则t2时刻改变的条件可能是
H2(g)+ CO2(g) △H<0 中CO 和CO2 的浓度随时间发生变化的曲线,则t2时刻改变的条件可能是
您最近一年使用:0次
名校
解题方法
10 . “绿水青山就是金山银山”,研究NO2、NO、CO等大气污染物处理对建设美丽中国具有重要意义。
(1) 已知: ①NO2+CO CO2+NO 该反应的平衡常数为K1(下同)
CO2+NO 该反应的平衡常数为K1(下同)
每1mol 下列物质分解为气态基态原子消耗能量分别为
②N2(g)+O2(g) 2NO(g) △H=+ 179.5 kJ /mol K2
2NO(g) △H=+ 179.5 kJ /mol K2
③2NO(g) + O2(g) 2NO2(g) △H=-112.3kJ/mol K3
2NO2(g) △H=-112.3kJ/mol K3
试写出NO与CO反应生成无污染物气体的热化学方程式_______________________ 以及此热化学方程式的平衡常数K=________ (用K1、 K2、K3表示)
(2)污染性气体NO2与CO在一定条件下的反应为:2NO2+4CO 4CO2+N2,某温度下,在1L密闭容器中充入0.1molNO2和0.2molCO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的
4CO2+N2,某温度下,在1L密闭容器中充入0.1molNO2和0.2molCO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的 ,则反应开始到平衡时CO的平均反应速率v(CO)=
,则反应开始到平衡时CO的平均反应速率v(CO)=___________ 。
若此温度下,某时刻测得NO2、CO、CO2、N2的浓度分别为amo/L、0.4mol/L、0.1mol/L、1mol/L,要使反应向逆反应方向进行,a的取值范围__________ 。
(1) 已知: ①NO2+CO
 CO2+NO 该反应的平衡常数为K1(下同)
CO2+NO 该反应的平衡常数为K1(下同)每1mol 下列物质分解为气态基态原子消耗能量分别为
| NO2 | CO | CO2 | NO |
| 812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g)
 2NO(g) △H=+ 179.5 kJ /mol K2
2NO(g) △H=+ 179.5 kJ /mol K2③2NO(g) + O2(g)
 2NO2(g) △H=-112.3kJ/mol K3
2NO2(g) △H=-112.3kJ/mol K3试写出NO与CO反应生成无污染物气体的热化学方程式
(2)污染性气体NO2与CO在一定条件下的反应为:2NO2+4CO
 4CO2+N2,某温度下,在1L密闭容器中充入0.1molNO2和0.2molCO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的
4CO2+N2,某温度下,在1L密闭容器中充入0.1molNO2和0.2molCO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的 ,则反应开始到平衡时CO的平均反应速率v(CO)=
,则反应开始到平衡时CO的平均反应速率v(CO)=若此温度下,某时刻测得NO2、CO、CO2、N2的浓度分别为amo/L、0.4mol/L、0.1mol/L、1mol/L,要使反应向逆反应方向进行,a的取值范围
您最近一年使用:0次



