名校
1 . 氮氧化物和碳氧化合物的综合治理是当前的重要课题之一。
已知:ⅰ.NO(g)+CO2(g) NO2(g)+CO(g) △H1=+234kJ·mol-1
NO2(g)+CO(g) △H1=+234kJ·mol-1
ⅱ.2NO(g)+2CO(g) N2(g)+2CO2(g) △H2=-745kJ·mol-1
N2(g)+2CO2(g) △H2=-745kJ·mol-1
(1)NO2(g)与CO(g)反应生成两种无毒气体的热化学方程式为______________ 。
(2)反应ⅰ的正反应的活化能E_____ △H1(填“>”、“<”或“=”)。
(3)一定压强下,密闭容器中发生反应ⅰ和反应ⅱ。达到平衡后,保持其他条件不变,升高温度,CO(g)的体积分数________ (填“增大”、“减少”或“无法确定”),原因为_____________________ 。
(4)向起始温度为t℃、容积为10L的恒容绝热的密闭容器中充入2molNO(g)和1molCO2(g),发生反应ⅰ。5min时达到平衡。则:
①下列事实能说明该反应达到平衡状态的是________ (填选项字母)
A.混合气体温度不变 B.混合气体的压强不变
C. NO2和CO的浓度之比为1: 1 D.混合气体的平均相对分子质量不变
②t℃时,向另一容积为10 L的恒温恒容的密闭容器中充入2 mol NO(g)和1 mol CO2(g),发生反应i。达到平衡的时间______ 5 min(填“>”、“<”或“=”)。
(5)在某密闭容器中充有10 mol CO(g)和20 mol NO(g),发生反应ii,CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。
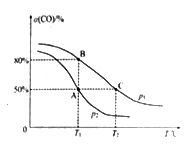
①A、B、C 三点的平衡常数KA、KB、KC的大小关系为________ ;p1和p2的大小关系为__________ 。
②A点时.测得容器的体积为10 L,则T1℃时,该反应平衡常数K的值为____________ 。
已知:ⅰ.NO(g)+CO2(g)
 NO2(g)+CO(g) △H1=+234kJ·mol-1
NO2(g)+CO(g) △H1=+234kJ·mol-1ⅱ.2NO(g)+2CO(g)
 N2(g)+2CO2(g) △H2=-745kJ·mol-1
N2(g)+2CO2(g) △H2=-745kJ·mol-1(1)NO2(g)与CO(g)反应生成两种无毒气体的热化学方程式为
(2)反应ⅰ的正反应的活化能E
(3)一定压强下,密闭容器中发生反应ⅰ和反应ⅱ。达到平衡后,保持其他条件不变,升高温度,CO(g)的体积分数
(4)向起始温度为t℃、容积为10L的恒容绝热的密闭容器中充入2molNO(g)和1molCO2(g),发生反应ⅰ。5min时达到平衡。则:
①下列事实能说明该反应达到平衡状态的是
A.混合气体温度不变 B.混合气体的压强不变
C. NO2和CO的浓度之比为1: 1 D.混合气体的平均相对分子质量不变
②t℃时,向另一容积为10 L的恒温恒容的密闭容器中充入2 mol NO(g)和1 mol CO2(g),发生反应i。达到平衡的时间
(5)在某密闭容器中充有10 mol CO(g)和20 mol NO(g),发生反应ii,CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。

①A、B、C 三点的平衡常数KA、KB、KC的大小关系为
②A点时.测得容器的体积为10 L,则T1℃时,该反应平衡常数K的值为
您最近一年使用:0次
2017-05-29更新
|
307次组卷
|
3卷引用:湖北省随州二中2019-2020学年高二上学期9月份月考化学试题
解题方法
2 . CH4、H2、C都是优质的能源物质,它们燃烧的热化学方程式为:
①CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ/mol
②2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ/mol
③C(s)+O2(g)===CO2(g) ΔH=-393.5kJ/mol
⑴深海中存在一种甲烷细菌,它们依靠酶使甲烷与O2作用产生的能量存活,甲烷细菌使1mol甲烷生成CO2气体与液态水,放出的能量_________ (填“>”“<”或“=”)890.3 kJ。
⑵甲烷与CO2可用于合成合成气(主要成分是一氧化碳和氢气):CH4+CO2===2CO+2H2,1gCH4完全反应可释放15.46 kJ的热量,则:
①图中能表示该反应过程中能量变化的是_______ (填字母)。
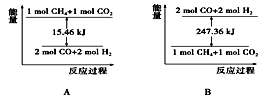

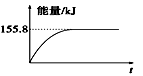
②若将物质的量均为1 mol的CH4与CO2充入某恒容密闭容器中,体系放出的热量随着时间的变化如图所示,则CH4的转化率约为____________ 。
⑶C(s)与H2(g)不反应,所以C(s)+2H2(g)===CH4(g)的反应热无法直接测量,但通过上述反应可求出C(s)+2H2(g)===CH4(g)的反应热ΔH=__________ 。
⑷下图是甲烷燃料电池原理示意图,请回答下列问题:
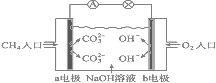
①电池的负极是______ (填“a”或“b”)电极,正极上的电极反应是_________ 。
②电池工作一段时间后电解质溶液的pH______ (填“增大”“减小”或“不变”)。
①CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ/mol
②2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ/mol
③C(s)+O2(g)===CO2(g) ΔH=-393.5kJ/mol
⑴深海中存在一种甲烷细菌,它们依靠酶使甲烷与O2作用产生的能量存活,甲烷细菌使1mol甲烷生成CO2气体与液态水,放出的能量
⑵甲烷与CO2可用于合成合成气(主要成分是一氧化碳和氢气):CH4+CO2===2CO+2H2,1gCH4完全反应可释放15.46 kJ的热量,则:
①图中能表示该反应过程中能量变化的是


②若将物质的量均为1 mol的CH4与CO2充入某恒容密闭容器中,体系放出的热量随着时间的变化如图所示,则CH4的转化率约为

⑶C(s)与H2(g)不反应,所以C(s)+2H2(g)===CH4(g)的反应热无法直接测量,但通过上述反应可求出C(s)+2H2(g)===CH4(g)的反应热ΔH=
⑷下图是甲烷燃料电池原理示意图,请回答下列问题:

①电池的负极是
②电池工作一段时间后电解质溶液的pH
您最近一年使用:0次
名校
3 . 臭氧是一种强氧化剂,常用于消毒、灭菌等。
(1)已知①太阳光催化分解水制氢:2H2O(l)=2H2(g)+O2(g) ΔH1=+571.6 kJ·mol–1
②焦炭与水反应制氢:C(s)+H2O(g)=CO(g)+H2(g) ΔH2=+131.3kJ·mol–1
③甲烷与水反应制氢:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH3=+206.1kJ·mol–1
则反应CH4(g)=C(s)+2H2(g)的ΔH=_______________ kJ·mol–1
(2)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如表所示。已知:O3的起始浓度为 0.0216 mol/L。
①pH增大能加速O3分解,表明对O3分解起催化作用的是____ 。
②在30 ℃、pH=4.0条件下,O3的分解速率为_____ mol/(L·min)。
③据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为________ (填字母)
a.40 ℃、pH=3.0 b.10 ℃、pH=4.0 c.30 ℃、pH=7.0

(3)O3可由臭氧发生器(原理如图)电解稀硫酸制得。
①图中阴极为____ (填“A或B”),
②若C处不通入O2,D、E处分别收集到x L和y L气体(标准状况),则E处收集的气体中O3所占的体积分数为____ (用含x 、y的代数式表示)。(忽略O3的分解)
(1)已知①太阳光催化分解水制氢:2H2O(l)=2H2(g)+O2(g) ΔH1=+571.6 kJ·mol–1
②焦炭与水反应制氢:C(s)+H2O(g)=CO(g)+H2(g) ΔH2=+131.3kJ·mol–1
③甲烷与水反应制氢:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH3=+206.1kJ·mol–1
则反应CH4(g)=C(s)+2H2(g)的ΔH=
(2)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如表所示。已知:O3的起始浓度为 0.0216 mol/L。
| pH t /min T/℃ | 3.0 | 4.0 | 5.0 | 6.0 |
| 20 | 301 | 231 | 169 | 58 |
| 30 | 158 | 108 | 48 | 15 |
| 50 | 31 | 26 | 15 | 7 |
①pH增大能加速O3分解,表明对O3分解起催化作用的是
②在30 ℃、pH=4.0条件下,O3的分解速率为
③据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为
a.40 ℃、pH=3.0 b.10 ℃、pH=4.0 c.30 ℃、pH=7.0

(3)O3可由臭氧发生器(原理如图)电解稀硫酸制得。
①图中阴极为
②若C处不通入O2,D、E处分别收集到x L和y L气体(标准状况),则E处收集的气体中O3所占的体积分数为
您最近一年使用:0次
名校
解题方法
4 . ⑴已知在常温常压下:
①2CH3OH(l)+2O2(g)===2CO(g)+4H2O(g) ΔH=-a kJ·mol-1
②2CO(g)+O2(g)===2CO2(g) ΔH=-b kJ·mol-1
③H2O(g)===H2O(l) ΔH=-c kJ·mol-1则表示CH3OH(l)燃烧热的热化学方程式为______________________________________ 。
⑵由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电。
①该电池负极的电极反应式为________________________________________________ 。
②若以该电池为电源,用石墨作电极电解200 mL含有如下离子的溶液。
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)。阳极上发生的电极反应为___________________________ ;阴极收集到的气体体积为(标准状况)______________ 。
①2CH3OH(l)+2O2(g)===2CO(g)+4H2O(g) ΔH=-a kJ·mol-1
②2CO(g)+O2(g)===2CO2(g) ΔH=-b kJ·mol-1
③H2O(g)===H2O(l) ΔH=-c kJ·mol-1则表示CH3OH(l)燃烧热的热化学方程式为
⑵由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电。
①该电池负极的电极反应式为
②若以该电池为电源,用石墨作电极电解200 mL含有如下离子的溶液。
离子 | Cu2+ | H+ | Cl- | SO42- |
c/(mol·L-1) | 0.5 | 2 | 2 | 0.5 |
您最近一年使用:0次
解题方法
5 . 请完成下列小题:
(1)工业上可利用CO2和H2生成甲醇,热化学方程式如下:
CO2(g)+3H2(g) CH3OH(l)+H2O(g) △H=Q1 kJ·mol-1
CH3OH(l)+H2O(g) △H=Q1 kJ·mol-1
又查资料得知:①CH3OH(l)+ O2(g)
O2(g)  CO2(g)+H2(g) △H=Q2 kJ·mol-1
CO2(g)+H2(g) △H=Q2 kJ·mol-1
②H2O(g)= H2O(l) △H=Q3 kJ·mol-1
则表示甲醇的燃烧热的热化学方程式为________________ 。
某同学设计了一个甲醇燃料电池,并用该电池电解200mL一定浓度的NaCl与CuSO4混合溶液,其装置如图:
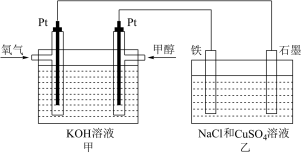
(2)写出甲中通入甲醇这一极的电极反应式_______________________ 。
(3)理论上乙中两极所得气体的体积随时间变化的关系如图所示(已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式___________ ,原混合溶液中NaCl的物质的量浓度为_______ mol/L。(设溶液体积不变)

(4)当向上述甲装置中通入标况下的氧气336mL时,理论上在铁电极上可析出铜的质量为_________ g。
(5)已知草酸H2C2O4为弱酸。
①常温下,下列事实能说明草酸是弱电解质的是____________ 。
A.向草酸钠溶液加酚酞,溶液变红
B.取一定量草酸溶液加水稀释至10倍,pH变化小于1
C.草酸能使酸性KMnO4溶液褪色
D.取相同pH的草酸溶液和盐酸,分别加入足量的大小、形状相同的镁条,草酸溶液反应速度快
②常温下,0.1mol·L-1的草酸溶液与pH=13的NaOH溶液等体积混合,所得溶液的pH为6,则c(HC2O4-)+2c(C2O42-)=________________ 。(用准确的数学表达式表示)
(1)工业上可利用CO2和H2生成甲醇,热化学方程式如下:
CO2(g)+3H2(g)
 CH3OH(l)+H2O(g) △H=Q1 kJ·mol-1
CH3OH(l)+H2O(g) △H=Q1 kJ·mol-1又查资料得知:①CH3OH(l)+
 O2(g)
O2(g)  CO2(g)+H2(g) △H=Q2 kJ·mol-1
CO2(g)+H2(g) △H=Q2 kJ·mol-1②H2O(g)= H2O(l) △H=Q3 kJ·mol-1
则表示甲醇的燃烧热的热化学方程式为
某同学设计了一个甲醇燃料电池,并用该电池电解200mL一定浓度的NaCl与CuSO4混合溶液,其装置如图:

(2)写出甲中通入甲醇这一极的电极反应式
(3)理论上乙中两极所得气体的体积随时间变化的关系如图所示(已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式

(4)当向上述甲装置中通入标况下的氧气336mL时,理论上在铁电极上可析出铜的质量为
(5)已知草酸H2C2O4为弱酸。
①常温下,下列事实能说明草酸是弱电解质的是
A.向草酸钠溶液加酚酞,溶液变红
B.取一定量草酸溶液加水稀释至10倍,pH变化小于1
C.草酸能使酸性KMnO4溶液褪色
D.取相同pH的草酸溶液和盐酸,分别加入足量的大小、形状相同的镁条,草酸溶液反应速度快
②常温下,0.1mol·L-1的草酸溶液与pH=13的NaOH溶液等体积混合,所得溶液的pH为6,则c(HC2O4-)+2c(C2O42-)=
您最近一年使用:0次
6 . 甲醇是一种优质燃料,在工业上常用CO和H2合成甲醇,反应方程式为CO (g)+H2(g) CH3OH(g)。已知:①CO(g)+1/2O2(g)=CO2(g) ΔH1=-283.0 kJ/mol;②H2(g)+1/2O2(g)=H2O(g) ΔH2=-241.8 kJ/mol;③CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH3=-192.2 kJ/mol。回答下列问题:
CH3OH(g)。已知:①CO(g)+1/2O2(g)=CO2(g) ΔH1=-283.0 kJ/mol;②H2(g)+1/2O2(g)=H2O(g) ΔH2=-241.8 kJ/mol;③CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH3=-192.2 kJ/mol。回答下列问题:
(1)计算CO(g)+2H2(g) CH3OH(g)的反应热ΔH4=
CH3OH(g)的反应热ΔH4=_________________ 。
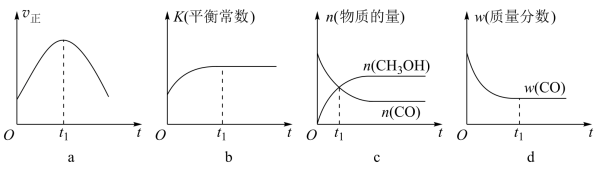
(2)若在绝热、恒容的密闭容器中充入1 mol CO、2 mol H2,发生反应CO(g)+2H2(g) CH3OH(g),下列示意图正确且能说明在进行到t1时刻为平衡状态的是
CH3OH(g),下列示意图正确且能说明在进行到t1时刻为平衡状态的是________ (填选项字母)。
(3)T1℃时,在一个体积为5 L的恒容容器中充入1 mol CO、2 mol H2,经过5 min达到平衡,CO的转化率为0.8。T1℃时,在另一体积不变的密闭容器中也充入1 mol CO、2 mol H2,达到平衡时CO的转化率为0.7,则该容器的体积______ 5 L(填“>、<或=”);T1℃时,CO(g)+2H2(g) CH3OH(g)的平衡常数K=
CH3OH(g)的平衡常数K=____________ 。
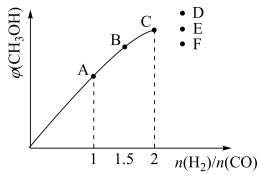
(4)在T1℃时,在体积为5 L的恒容容器中充入一定量的H2和CO,反应达到平衡时CH3OH的体积分数与n(H2)/n(CO)的关系如图所示。温度不变,当n(H2)/n(CO)=2.5时,达到平衡状态,CH3OH的体积分数可能是图象中的________ 点。
(5)为了提高燃料的利用率可以将甲醇设计为燃料电池,写出KOH作电解质溶液时,甲醇燃料电池的负极反应式________________________________________________ 。
 CH3OH(g)。已知:①CO(g)+1/2O2(g)=CO2(g) ΔH1=-283.0 kJ/mol;②H2(g)+1/2O2(g)=H2O(g) ΔH2=-241.8 kJ/mol;③CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH3=-192.2 kJ/mol。回答下列问题:
CH3OH(g)。已知:①CO(g)+1/2O2(g)=CO2(g) ΔH1=-283.0 kJ/mol;②H2(g)+1/2O2(g)=H2O(g) ΔH2=-241.8 kJ/mol;③CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH3=-192.2 kJ/mol。回答下列问题:(1)计算CO(g)+2H2(g)
 CH3OH(g)的反应热ΔH4=
CH3OH(g)的反应热ΔH4=(2)若在绝热、恒容的密闭容器中充入1 mol CO、2 mol H2,发生反应CO(g)+2H2(g)
 CH3OH(g),下列示意图正确且能说明在进行到t1时刻为平衡状态的是
CH3OH(g),下列示意图正确且能说明在进行到t1时刻为平衡状态的是
(3)T1℃时,在一个体积为5 L的恒容容器中充入1 mol CO、2 mol H2,经过5 min达到平衡,CO的转化率为0.8。T1℃时,在另一体积不变的密闭容器中也充入1 mol CO、2 mol H2,达到平衡时CO的转化率为0.7,则该容器的体积
 CH3OH(g)的平衡常数K=
CH3OH(g)的平衡常数K=(4)在T1℃时,在体积为5 L的恒容容器中充入一定量的H2和CO,反应达到平衡时CH3OH的体积分数与n(H2)/n(CO)的关系如图所示。温度不变,当n(H2)/n(CO)=2.5时,达到平衡状态,CH3OH的体积分数可能是图象中的

(5)为了提高燃料的利用率可以将甲醇设计为燃料电池,写出KOH作电解质溶液时,甲醇燃料电池的负极反应式
您最近一年使用:0次
7 . 研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:
Fe2O3(s)+3CO(s,石墨)═2Fe(s)+3CO2(g)△H1=+489.0kJ•mol﹣1
C(s,石墨)+CO2(g)═2CO(g)△H2=+172.5kJ•mol﹣1
则CO还原Fe2O3(s)的热化学方程式为_____ 。
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H
CH3OH(g)+H2O(g)△H
①取一定体积CO2和H2的混合气体(物质的量之比为1:3),加入恒容密闭容器中,发生上述反应反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图1所示,则该反应的△H____ 0(填“>”、“<”或“=”,下同)。
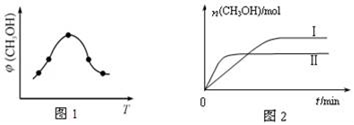
②在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图2所示,曲线I、Ⅱ对应的平衡常数关系为KⅠ_____ KⅡ。
(3)以CO2为原料还可以合成多种物质。
①工业上尿素[CO(NH2)2]由CO2和NH3在一定条件下合成.开始以氨碳比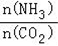 =3进行反应,达平衡时CO2的转化率为60%,则NH3的平衡转化率为
=3进行反应,达平衡时CO2的转化率为60%,则NH3的平衡转化率为_____ 。
②将足量CO2通入饱和氨水中可得氮肥NH4HCO3,已知常温下一水合氨Kb=1.8×10﹣5,碳酸一级电离常数Ka=4.3×10﹣7,则NH4HCO3溶液呈_____ (填“酸性”、“中性”或“碱性”)。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:
Fe2O3(s)+3CO(s,石墨)═2Fe(s)+3CO2(g)△H1=+489.0kJ•mol﹣1
C(s,石墨)+CO2(g)═2CO(g)△H2=+172.5kJ•mol﹣1
则CO还原Fe2O3(s)的热化学方程式为
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)△H
CH3OH(g)+H2O(g)△H①取一定体积CO2和H2的混合气体(物质的量之比为1:3),加入恒容密闭容器中,发生上述反应反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图1所示,则该反应的△H

②在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图2所示,曲线I、Ⅱ对应的平衡常数关系为KⅠ
(3)以CO2为原料还可以合成多种物质。
①工业上尿素[CO(NH2)2]由CO2和NH3在一定条件下合成.开始以氨碳比
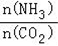 =3进行反应,达平衡时CO2的转化率为60%,则NH3的平衡转化率为
=3进行反应,达平衡时CO2的转化率为60%,则NH3的平衡转化率为②将足量CO2通入饱和氨水中可得氮肥NH4HCO3,已知常温下一水合氨Kb=1.8×10﹣5,碳酸一级电离常数Ka=4.3×10﹣7,则NH4HCO3溶液呈
您最近一年使用:0次
2017-03-06更新
|
293次组卷
|
2卷引用:2016-2017学年湖北省宜昌市部分重点中学高二上学期期末考试化学试卷
解题方法
8 . 有X、Y、Z、R四种短周期元素,Y、Z、R同周期。相关信息如下:
(1)Z 元素在周期表的位置是__________ ,Y、Z、R简单离子的半径从大到小的顺序是_________ (用离子符号表示);
(2)由X、Z两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子里X、Z两种原子最外层均达到8个电子的稳定结构。甲遇水蒸气可形成一种常见的漂白性物质。则甲的分子式为____________ ;
(3)化合物乙(Y2R)溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质Y2R2,其溶液显黄色。则Y2R2的电子式为____________ ,写出乙溶液在空气中变质过程的化学方程式______________ 。
(4)元素X与氢可形成分子式为X2H4的燃料,X2H4结构式为________________ ;
已知:X2(g)+2O2(g)=2XO2(g) △H=+68kJ·mol-1
X2H4(g)+O2(g)=X2(g)+2H2O(g) △H=-534kJ·mol-1
写出气态 X2H4和 XO2反应生成 X2和水蒸气的热化学方程式___________ 。
| 元素 | 相关信息 |
| X | 单质为双原子分子。若低温蒸发液态空气,因其沸点较低可先获得 X 的单质 |
| Y | 含 Y 元素的物质焰色反应为黄色 |
| Z | 同周期元素中原子半径最小 |
| R | R 元素原子的最外层电子数是 K 层电子数的 3 倍 |
(2)由X、Z两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子里X、Z两种原子最外层均达到8个电子的稳定结构。甲遇水蒸气可形成一种常见的漂白性物质。则甲的分子式为
(3)化合物乙(Y2R)溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质Y2R2,其溶液显黄色。则Y2R2的电子式为
(4)元素X与氢可形成分子式为X2H4的燃料,X2H4结构式为
已知:X2(g)+2O2(g)=2XO2(g) △H=+68kJ·mol-1
X2H4(g)+O2(g)=X2(g)+2H2O(g) △H=-534kJ·mol-1
写出气态 X2H4和 XO2反应生成 X2和水蒸气的热化学方程式
您最近一年使用:0次
2017-02-17更新
|
1049次组卷
|
2卷引用:湖北省利川市第五中学2020-2021学年高二上学期期中考试化学试题
名校
解题方法
9 . CO是现代化工生产的基础原料,下列有关问题都和CO的使用有关。
(1)工业上可利用CO生产乙醇:
2CO(g)+4H2(g)⇌CH3CH2OH(g)+H2O(g) ΔH1
又已知:H2O(l)= H2O(g) ΔH2
CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH3
工业上也可利用CO2(g)与H2(g)为原料合成乙醇:
2CO2(g)+6H2(g)⇌CH3CH2OH(g)+3H2O(l) ΔH
则:ΔH与ΔH1、ΔH2、ΔH3之间的关系是:ΔH=_______________________ 。
(2)一定条件下,H2、CO在体积固定的密闭容器中发生如下反应:
4H2(g)+2CO(g)⇌CH3OCH3(g)+H2O(g),
下列选项能判断该反应达到平衡状态的依据的有____。
(3)工业可采用CO与H2反应合成再生能源甲醇,反应如下:
CO(g)+ 2H2(g) CH3OH(g)
CH3OH(g)
在一容积可变的密闭容器中充有10molCO和20mol H2,
在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)、压强(p)的关系如(图1)所示。
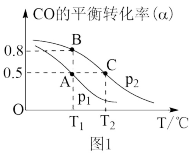
①合成甲醇的反应为_____ (填“放热”或“吸热”)反应。
②A、B、C三点的平衡常数KA、KB、KC的大小关系为_________ 。
③若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为______________ L。
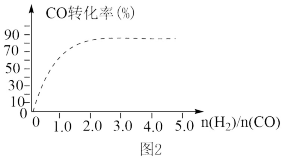
④(图2)中虚线为该反应在使用催化剂条件下关于起始氢气与CO投料比和CO平衡转化率的关系图。当其条件完全相同时,用实线画出不使用催化剂情况下CO平衡转化率的示意图______________ .
⑤CO的平衡转化率(α)与温度(T)、压强(p)的关系如(图3)所示,实际生产时条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是________ 。

(1)工业上可利用CO生产乙醇:
2CO(g)+4H2(g)⇌CH3CH2OH(g)+H2O(g) ΔH1
又已知:H2O(l)= H2O(g) ΔH2
CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH3
工业上也可利用CO2(g)与H2(g)为原料合成乙醇:
2CO2(g)+6H2(g)⇌CH3CH2OH(g)+3H2O(l) ΔH
则:ΔH与ΔH1、ΔH2、ΔH3之间的关系是:ΔH=
(2)一定条件下,H2、CO在体积固定的密闭容器中发生如下反应:
4H2(g)+2CO(g)⇌CH3OCH3(g)+H2O(g),
下列选项能判断该反应达到平衡状态的依据的有____。
| A.2v(H2)= v(CO) |
| B.CO的消耗速率等于CH3OCH3的生成速率 |
| C.容器内的压强保持不变 |
| D.混合气体的密度保持不变 |
| E.混合气体的平均相对分子质量不随时间而变化 |
CO(g)+ 2H2(g)
 CH3OH(g)
CH3OH(g)在一容积可变的密闭容器中充有10molCO和20mol H2,
在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)、压强(p)的关系如(图1)所示。

①合成甲醇的反应为
②A、B、C三点的平衡常数KA、KB、KC的大小关系为
③若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为
④(图2)中虚线为该反应在使用催化剂条件下关于起始氢气与CO投料比和CO平衡转化率的关系图。当其条件完全相同时,用实线画出不使用催化剂情况下CO平衡转化率的示意图

⑤CO的平衡转化率(α)与温度(T)、压强(p)的关系如(图3)所示,实际生产时条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是

您最近一年使用:0次
2016-12-09更新
|
1017次组卷
|
3卷引用:2015-2016学年湖北武汉第二中学高二上期中考试化学试卷
10 . 为应对环境污染,使得对如何减少煤燃烧和汽车尾气中各种含碳、氮、硫等气体的排放,及有效地开发利用碳资源的研究显得更加紧迫。
(1)为减少煤燃烧中废气的排放,常将煤转化为清洁气体燃料。请写出焦炭与水蒸气高温下反应的化学方程式:________________________ 。
(2)选择适当的催化剂在高温下可将汽车尾气中的 CO、NO转化为无毒气体。
已知:①2CO(g)+O2(g)=2CO2(g) ∆H1=-566kJ∙mol-1
②2NO(g)+2CO(g) ⇋N2(g)+ 2CO2(g) ∆H2=-746kJ∙mol-1
则反应N2(g)+ O2(g)= 2NO(g)的∆H=___________ kJ∙mol-1。
(3)在一定温度下,向1L密闭容器中充入0.5 mol NO、2 mol CO,发生上述反应②,
20s反应达平衡,此时CO的物质的量为1.6 mol。在该温度下反应的平衡常数K=_______ 。
(4)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。如图是通过人工光合作用以CO2和H2O为原料制备HCOOH和O2的原理示意图。催化剂b表面发生的电极反应式为_____________________ 。
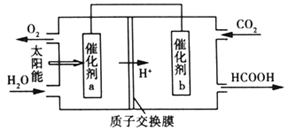
(5)氮氧化物进入水体可转化为 ,电化学降解法可用于治理水中
,电化学降解法可用于治理水中 的污染。原理如图所示。
的污染。原理如图所示。
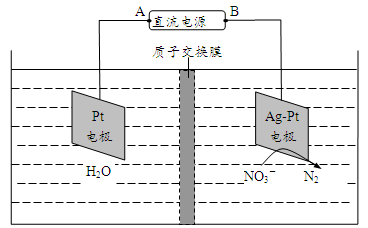
电源正极为_______ (填“A”或“B”),若电解过程中转移了0.4mol电子,则处理掉的 为
为_________ g。
(1)为减少煤燃烧中废气的排放,常将煤转化为清洁气体燃料。请写出焦炭与水蒸气高温下反应的化学方程式:
(2)选择适当的催化剂在高温下可将汽车尾气中的 CO、NO转化为无毒气体。
已知:①2CO(g)+O2(g)=2CO2(g) ∆H1=-566kJ∙mol-1
②2NO(g)+2CO(g) ⇋N2(g)+ 2CO2(g) ∆H2=-746kJ∙mol-1
则反应N2(g)+ O2(g)= 2NO(g)的∆H=
(3)在一定温度下,向1L密闭容器中充入0.5 mol NO、2 mol CO,发生上述反应②,
20s反应达平衡,此时CO的物质的量为1.6 mol。在该温度下反应的平衡常数K=
(4)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。如图是通过人工光合作用以CO2和H2O为原料制备HCOOH和O2的原理示意图。催化剂b表面发生的电极反应式为

(5)氮氧化物进入水体可转化为
 ,电化学降解法可用于治理水中
,电化学降解法可用于治理水中 的污染。原理如图所示。
的污染。原理如图所示。
电源正极为
 为
为
您最近一年使用:0次
2016-12-09更新
|
576次组卷
|
2卷引用:2014-2015学年湖北省襄阳市老河口高级中学高二下学期期末化学试卷



