名校
解题方法
1 . 氮的氧化物是大气污染物之一,用活性炭或一氧化碳还原氮氧化物,可防止空气污染。回答下列问题:
(1)汽车尾气中常含有碳烟、CO、NO等有害物质,尾气中含有碳烟的主要原因为______ 。
(2)已知在298 K和101 kPa条件下,有如下反应:反应①:C(s)+O2(g)=CO2(g) ΔH1=-393.5kJ·mol
反应②:N2(g)+O2(g)=2NO(g) ΔH2=+180.5kJ·mol
若反应 CO2(g)+
CO2(g)+ N2(g)⇌
N2(g)⇌ C(s)+NO(g)的活化能为a kJ·mol
C(s)+NO(g)的活化能为a kJ·mol ,则反应C(s)+2NO(g)⇌CO2(g)+N2(g)的活化能为
,则反应C(s)+2NO(g)⇌CO2(g)+N2(g)的活化能为____ kJ·mol
(3)在常压下,已知反应2CO(g)+2NO(g)⇌N2(g)+2CO2(g) ΔH(298 K)= -113.0 kJ·mol ,ΔS(298 K)= -145.3×10-3kJ/(mol·K) ,据此可判断该反应在常温下
,ΔS(298 K)= -145.3×10-3kJ/(mol·K) ,据此可判断该反应在常温下___ (填“能”或“不能”)自发进行。
(4)向容积为2L的真空密闭容器中加入活性炭(足量)和NO,发生反应C(s)+2NO(g)⇌ N2 (g)+CO2(g),NO和N2的物质的量变化如下表所示,在T1℃、T2℃分别到达平衡时容器的总压强分别为p1 kPa、p2 kPa。
①0~10min内,以NO表示的该反应速率v(NO)=_____ kPa·min-1。
②第15 min后,温度调整到T2,数据变化如上表所示,则p1____ p2(填“>”、“<”或“=”)。
③若30min时,保持T2不变,向该容器中再加入该四种反应混合物各2 mol,再次达平衡时NO的体积百分含量为________ 。
(1)汽车尾气中常含有碳烟、CO、NO等有害物质,尾气中含有碳烟的主要原因为
(2)已知在298 K和101 kPa条件下,有如下反应:反应①:C(s)+O2(g)=CO2(g) ΔH1=-393.5kJ·mol

反应②:N2(g)+O2(g)=2NO(g) ΔH2=+180.5kJ·mol

若反应
 CO2(g)+
CO2(g)+ N2(g)⇌
N2(g)⇌ C(s)+NO(g)的活化能为a kJ·mol
C(s)+NO(g)的活化能为a kJ·mol ,则反应C(s)+2NO(g)⇌CO2(g)+N2(g)的活化能为
,则反应C(s)+2NO(g)⇌CO2(g)+N2(g)的活化能为
(3)在常压下,已知反应2CO(g)+2NO(g)⇌N2(g)+2CO2(g) ΔH(298 K)= -113.0 kJ·mol
 ,ΔS(298 K)= -145.3×10-3kJ/(mol·K) ,据此可判断该反应在常温下
,ΔS(298 K)= -145.3×10-3kJ/(mol·K) ,据此可判断该反应在常温下(4)向容积为2L的真空密闭容器中加入活性炭(足量)和NO,发生反应C(s)+2NO(g)⇌ N2 (g)+CO2(g),NO和N2的物质的量变化如下表所示,在T1℃、T2℃分别到达平衡时容器的总压强分别为p1 kPa、p2 kPa。
| 物质的量/mol | T1℃ | T2℃ | |||||
| 0 | 5 min | 10 min | 15 min | 20 min | 25 min | 30 min | |
| NO | 2.0 | 1.16 | 0.80 | 0.80 | 0.50 | 0.40 | 0.40 |
| N2 | 0 | 0.42 | 0.60 | 0.60 | 0.75 | 0.80 | 0.80 |
①0~10min内,以NO表示的该反应速率v(NO)=
②第15 min后,温度调整到T2,数据变化如上表所示,则p1
③若30min时,保持T2不变,向该容器中再加入该四种反应混合物各2 mol,再次达平衡时NO的体积百分含量为
您最近一年使用:0次
名校
2 . (1)在高温、高压、催化剂作用下,1mol石墨转化为金刚石,吸收1.9 kJ的热量。该反应的ΔH ___________ 0 (填“>”或“<”),对于石墨和金刚石,___________ 更稳定。
(2)用50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在如图所示的装置中进行中和反应反应热的测定实验。回答下列问题:
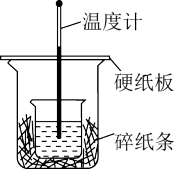
①从实验装置上看,图中尚缺少的一种玻璃用品是___________ 。
②大烧杯上如不盖硬纸板,测得的反应热数值___________ (填“偏大、偏小、无影响”)。
③用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的反应热的数值会___________ (填“偏大”、“偏小”、“无影响”)。
(3)在25℃、101 kPa下,1g CH3OH(l)完全燃烧生成CO2和液态水时放热22.68 kJ。写出表示CH3OH燃烧热的热化学方程式___________ 。
(4)已知几种化学键的键能如表所示:
则反应Cl2(g)+ 3F2(g) 2ClF3(g) 的ΔH =
2ClF3(g) 的ΔH =___________ kJ/mol
(5)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4 (g)+ 4NO2 (g)=4NO(g)+ CO2 (g)+ 2H2O(1) △H1 = -662kJ·mol-1
②CH4 (g)+ 4NO(g) =2N2 (g)+ CO2 (g)+ 2H2O(1) △H2 = -1251 kJ·mol-1
据此,写出CH4将NO2还原为N2的热化学方程式:___________ 。
(2)用50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在如图所示的装置中进行中和反应反应热的测定实验。回答下列问题:

①从实验装置上看,图中尚缺少的一种玻璃用品是
②大烧杯上如不盖硬纸板,测得的反应热数值
③用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的反应热的数值会
(3)在25℃、101 kPa下,1g CH3OH(l)完全燃烧生成CO2和液态水时放热22.68 kJ。写出表示CH3OH燃烧热的热化学方程式
(4)已知几种化学键的键能如表所示:
| 化学键 | Cl—Cl | F—F | Cl—F |
| 键能/ (kJ/mol) | 242 | 159 | 172 |
则反应Cl2(g)+ 3F2(g)
 2ClF3(g) 的ΔH =
2ClF3(g) 的ΔH =(5)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4 (g)+ 4NO2 (g)=4NO(g)+ CO2 (g)+ 2H2O(1) △H1 = -662kJ·mol-1
②CH4 (g)+ 4NO(g) =2N2 (g)+ CO2 (g)+ 2H2O(1) △H2 = -1251 kJ·mol-1
据此,写出CH4将NO2还原为N2的热化学方程式:
您最近一年使用:0次
解题方法
3 . 联氨( )是一种应用广泛的化工原料,常用作火箭和燃料电池的燃料。回答下列问题:
)是一种应用广泛的化工原料,常用作火箭和燃料电池的燃料。回答下列问题:
(1)工业上利用 和
和 合成
合成 ,用
,用 进一步制备联氨
进一步制备联氨 。
。
①已知断开(或形成)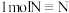 键、
键、 键分别需要吸收(或放出)
键分别需要吸收(或放出)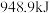 ,
, 的热量,合成
的热量,合成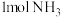 可放出
可放出 的热量,则形成
的热量,则形成 放出的热量为
放出的热量为___________  (保留一位小数)。
(保留一位小数)。
②工业上一种制备联氨的方法为 。该反应涉及物质中属于离子化合物的是
。该反应涉及物质中属于离子化合物的是___________ (填写化学式)。制备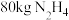 ,反应中转移电子的物质的量为
,反应中转移电子的物质的量为___________  。
。
(2)发射航天器时常以 为燃料,
为燃料, 为推进剂。
为推进剂。
已知
ⅰ.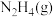 的摩尔燃烧焓为
的摩尔燃烧焓为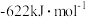 。
。
ⅱ. 与
与 反应的物质和能量变化示意图如下:
反应的物质和能量变化示意图如下:
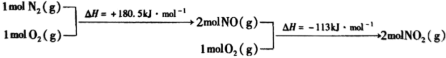
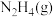 与
与 反应生成
反应生成 和
和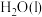 的热化学方程式为
的热化学方程式为___________ 。
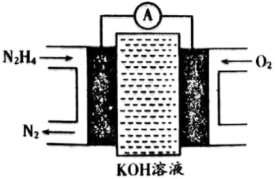
(3)一种联氨燃料电池的工作原理如图所示。放电一段时间,电解质溶液中 的物质的量浓度
的物质的量浓度___________ (填“增大”“减小”或“不变”),负极反应式为___________ 。
 )是一种应用广泛的化工原料,常用作火箭和燃料电池的燃料。回答下列问题:
)是一种应用广泛的化工原料,常用作火箭和燃料电池的燃料。回答下列问题:(1)工业上利用
 和
和 合成
合成 ,用
,用 进一步制备联氨
进一步制备联氨 。
。①已知断开(或形成)
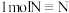 键、
键、 键分别需要吸收(或放出)
键分别需要吸收(或放出)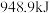 ,
, 的热量,合成
的热量,合成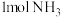 可放出
可放出 的热量,则形成
的热量,则形成 放出的热量为
放出的热量为 (保留一位小数)。
(保留一位小数)。②工业上一种制备联氨的方法为
 。该反应涉及物质中属于离子化合物的是
。该反应涉及物质中属于离子化合物的是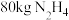 ,反应中转移电子的物质的量为
,反应中转移电子的物质的量为 。
。(2)发射航天器时常以
 为燃料,
为燃料, 为推进剂。
为推进剂。已知
ⅰ.
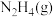 的摩尔燃烧焓为
的摩尔燃烧焓为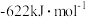 。
。ⅱ.
 与
与 反应的物质和能量变化示意图如下:
反应的物质和能量变化示意图如下: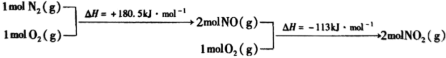
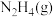 与
与 反应生成
反应生成 和
和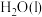 的热化学方程式为
的热化学方程式为(3)一种联氨燃料电池的工作原理如图所示。放电一段时间,电解质溶液中
 的物质的量浓度
的物质的量浓度
您最近一年使用:0次
4 . 目前,汽车尾气系统中均安装了催化转化器,大大减少了CO和NOx汽车尾气的排放。
(1)在催化剂作用下CO还原NO、NO2。
标准摩尔生成焓是指由稳态单质生成1mol该化合物的焓变,25℃下几种物质的标准生成焓如下:
ⅰ.CO(g)+NO2(g) CO2(g)+NO(g) ΔH1
CO2(g)+NO(g) ΔH1
ⅱ.2CO(g)+2NO(g) 2CO2(g)+N2(g) ΔH2=-623KJ• mol-1
2CO2(g)+N2(g) ΔH2=-623KJ• mol-1
ΔH1=___________ ;写出用 CO还原NO2生成两种无污染的气态物质总反应的热化学方程式:___________
人们应用原电池原理制作了多种电池,以满足不同的需要。请根据题中提供的信息,填写空格。
(2)铅蓄电池在放电时发生的电池反应式为:Pb+PbO2+2H2SO4=2PbSO4+2H2O,负极电极反应式为:___________ 。
(3)一种以 CO为燃料,以空气为氧化剂,以熔融态 K2CO3为电解质的燃料电池,工作原理如下图所示:
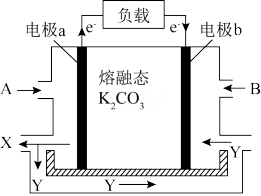
①电极a为___________ (填“ 正极”或“ 负极” ),Y物质为___________ ;
②正极上的电极反应式为___________ 。
(1)在催化剂作用下CO还原NO、NO2。
标准摩尔生成焓是指由稳态单质生成1mol该化合物的焓变,25℃下几种物质的标准生成焓如下:
| NO2 | CO | CO2 | NO | |
| 标准生成焓/kJ•mol-1 | 33.1 | -110.5 | -183.6 | 90.3 |
 CO2(g)+NO(g) ΔH1
CO2(g)+NO(g) ΔH1ⅱ.2CO(g)+2NO(g)
 2CO2(g)+N2(g) ΔH2=-623KJ• mol-1
2CO2(g)+N2(g) ΔH2=-623KJ• mol-1ΔH1=
人们应用原电池原理制作了多种电池,以满足不同的需要。请根据题中提供的信息,填写空格。
(2)铅蓄电池在放电时发生的电池反应式为:Pb+PbO2+2H2SO4=2PbSO4+2H2O,负极电极反应式为:
(3)一种以 CO为燃料,以空气为氧化剂,以熔融态 K2CO3为电解质的燃料电池,工作原理如下图所示:

①电极a为
②正极上的电极反应式为
您最近一年使用:0次
名校
解题方法
5 . 工业合成氨的反应N2+3H2⇌2NH3的能量变化如图所示,请回答有关问题:
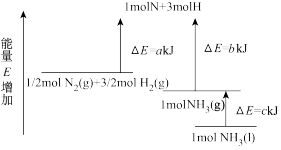
(1)合成1molNH3(l)____ (填“吸收”或“放出”)____ kJ的热量。
(2)推测反应2NH3(l)⇌2N2(g)+3H2(g)比反应2NH3(g)⇌2N2(g)+3H2(g)___ (填“吸收”或“放出”)的热量___ (填“多”或“少”)。
(3)已知:P(s,白磷)=P(s,黑磷),每1molP(s,白磷)发生反应,放出39.3kJ的热量,P(s,白磷)=P(s,红磷),每1molP(s,白磷)发生反应,放出17.6kJ的热量,由此推知,其中最稳定的磷单质是__ (填“黑磷”或“红磷”)。
(4)某实验小组同学对电化学原理进行了一系列探究活动。
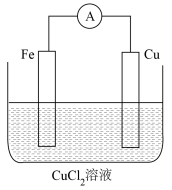
该电池基于总反应____ (用离子方程式表示)来设计的,一段时间后,铜极质量变化32g,则导线中通过____ mol电子。

(1)合成1molNH3(l)
(2)推测反应2NH3(l)⇌2N2(g)+3H2(g)比反应2NH3(g)⇌2N2(g)+3H2(g)
(3)已知:P(s,白磷)=P(s,黑磷),每1molP(s,白磷)发生反应,放出39.3kJ的热量,P(s,白磷)=P(s,红磷),每1molP(s,白磷)发生反应,放出17.6kJ的热量,由此推知,其中最稳定的磷单质是
(4)某实验小组同学对电化学原理进行了一系列探究活动。

该电池基于总反应
您最近一年使用:0次
6 . 能源是现代文明的原动力,通过化学方法可以使能源按人们所期望的形式转化,从而开辟新能源和提高能源的利用率。回答下列问题:
(1)氢能作为一种清洁高效的二次能源,在未来能源格局中发挥着重要作用。已知:常温下,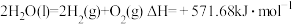 ,
,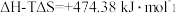 。则常温下水的分解不能自发进行的热力学依据是
。则常温下水的分解不能自发进行的热力学依据是_______ 。
(2)已知反应: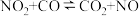
①在某温度下该反应的平衡常数为K,则其逆反应的平衡常数为_______ (用含K的式子表示)。
②下图是该反应中能量变化示意图。
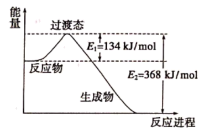
则 和
和 反应生成
反应生成 和
和 的活化能为
的活化能为_______ , 和
和 反应的热化学方程式为
反应的热化学方程式为_______ 。
(3)燃料燃烧将其所含的化学能转变为我们所需要的热能。已知:
①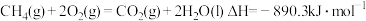
②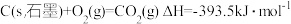
③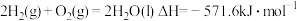
则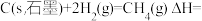
_______ 。
(4)已知一些化学键的键能数据如表所示:
请根据键能数据写出 和
和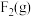 反应生成
反应生成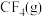 和
和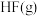 的热化学方程式:
的热化学方程式:_______ 。
(1)氢能作为一种清洁高效的二次能源,在未来能源格局中发挥着重要作用。已知:常温下,
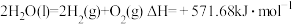 ,
,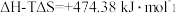 。则常温下水的分解不能自发进行的热力学依据是
。则常温下水的分解不能自发进行的热力学依据是(2)已知反应:
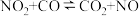
①在某温度下该反应的平衡常数为K,则其逆反应的平衡常数为
②下图是该反应中能量变化示意图。

则
 和
和 反应生成
反应生成 和
和 的活化能为
的活化能为 和
和 反应的热化学方程式为
反应的热化学方程式为(3)燃料燃烧将其所含的化学能转变为我们所需要的热能。已知:
①
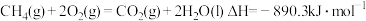
②
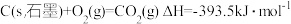
③
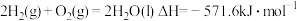
则
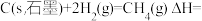
(4)已知一些化学键的键能数据如表所示:
| 化学键 |  |  |  |  |
键能/ | 414 | 489 | 565 | 155 |
请根据键能数据写出
 和
和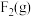 反应生成
反应生成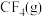 和
和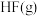 的热化学方程式:
的热化学方程式:
您最近一年使用:0次
7 . (1)CO2与CH4经催化重新整,制得合成气:CH4(g)+CO2(g)=2CO(g)+2H2(g),已知上述反应中相关的化学键键能数据如下:
ΔH=_______________
(2)1mol硫酸和氢氧化钠稀溶液反应放出115kJ热量,写出反应的热化学方程式____
(3)25℃、101 kPa条件下,0.5mol液态甲醇(CH3OH)燃烧生成CO2和液态水时放热363 kJ,写出反应的热化学方程式___________ 。
(4)若适量的N2和O2完全反应生成NO2,每生成23gNO2需要吸收16.95kJ热量,写出反应的热化学方程式____________
| 化学键 | C-H | C=O | H-H | C=O(CO) |
| 键能/KJ.mol-1 | 413 | 745 | 436 | 1075 |
ΔH=
(2)1mol硫酸和氢氧化钠稀溶液反应放出115kJ热量,写出反应的热化学方程式
(3)25℃、101 kPa条件下,0.5mol液态甲醇(CH3OH)燃烧生成CO2和液态水时放热363 kJ,写出反应的热化学方程式
(4)若适量的N2和O2完全反应生成NO2,每生成23gNO2需要吸收16.95kJ热量,写出反应的热化学方程式
您最近一年使用:0次
名校
解题方法
8 . 将CO2应用于生产清洁燃料甲醇,既能缓解温室效应的影响,又能为能源的制备开辟新的渠道,其合成反应为CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。回答下列问题:
(1)利用二氧化碳制得的甲醇还可以制取甲胺,其反应原理为CH3OH(g)+NH3(g)⇌CH3NH2(g)+H2O(g) ∆H,已知该反应中相关化学键的键能数据如下:
则该反应的∆H=_______ kJ•mol-1。
(2)汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。已知:
①CO(g)+NO2(g)⇌CO2(g)+NO(g) ∆H1=-226kJ•rnol-1
②N2(g)+2O2(g)⇌2NO2(g) ∆H2=+68kJ•mol-1
③N2(g)+O2(g)⇌2NO(g) ∆H3=+183kJ•mol-1
则:CO和NO两种尾气在催化剂作用下生成N2的热化学方程式是_______ 。
(3)CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如下:
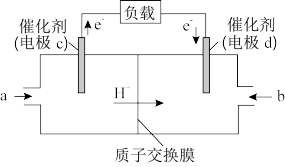
电池总反应为2CH3OH+3O2=2CO2+4H2O。则d电极是_______ (填“正极”或“负极”),c电极的电极反应式为______ 。若线路中转移2mol电子,则上述CH3OH燃料电池消耗的O2在标准状况下的体积为_____ L。
(1)利用二氧化碳制得的甲醇还可以制取甲胺,其反应原理为CH3OH(g)+NH3(g)⇌CH3NH2(g)+H2O(g) ∆H,已知该反应中相关化学键的键能数据如下:
| 共价键 | C-O | H-O | N-H | C-N |
| 键能/kJ•mol-1 | 351 | 463 | 393 | 293 |
则该反应的∆H=
(2)汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。已知:
①CO(g)+NO2(g)⇌CO2(g)+NO(g) ∆H1=-226kJ•rnol-1
②N2(g)+2O2(g)⇌2NO2(g) ∆H2=+68kJ•mol-1
③N2(g)+O2(g)⇌2NO(g) ∆H3=+183kJ•mol-1
则:CO和NO两种尾气在催化剂作用下生成N2的热化学方程式是
(3)CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如下:

电池总反应为2CH3OH+3O2=2CO2+4H2O。则d电极是
您最近一年使用:0次
9 . NH3和联氨(N2H4)是两种重要的氮氢化合物,在科研和生产中应用广泛。
(1)①已知:
注:拆开气态物质中 1 mol 某种共价键需要吸收的能量,就是该共价键的键能。
N2(g)+3H2(g) 2NH3(g) ∆H=
2NH3(g) ∆H=__________ kJ/mol
②联氨(N2H4)和N2O4 可作为火箭推进剂。
已知:N2(g)+2O2(g)=N2O4(g) ∆H=10.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g) ∆H=-543kJ/mol
N2H4(g)和N2O4(g)反应生成 N2(g)和H2O(g)的热化学方程式为_______ 。
(2)一定温度下,向恒容的密闭容器中充入N2 和H2 发生反应:N2+3H2 2NH3,测得各组分浓度随时间变化如图所示。
2NH3,测得各组分浓度随时间变化如图所示。
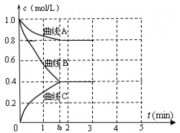
①表示c(N2)的曲线是_______ 。(填“曲线 A”、“曲线B”或“曲线C”)
②0~t0时,v(H2)=_______ mol·L-1·min-1。
③下列措施不能使该反应速率加快的是_______ 。
a.升高温度 b.降低压强 c.使用催化剂
④下列能说明该反应达到平衡的是_______ 。
a.混合气体的压强不再变化 b.2c(H2)= 3c(NH3) c.混合气体的质量不再变化
(1)①已知:
| 共价键 | 键能/ kJ·mol-1 |
| H-H | 436 |
| N≡N | 946 |
| N-H | 391 |
注:拆开气态物质中 1 mol 某种共价键需要吸收的能量,就是该共价键的键能。
N2(g)+3H2(g)
 2NH3(g) ∆H=
2NH3(g) ∆H=②联氨(N2H4)和N2O4 可作为火箭推进剂。
已知:N2(g)+2O2(g)=N2O4(g) ∆H=10.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g) ∆H=-543kJ/mol
N2H4(g)和N2O4(g)反应生成 N2(g)和H2O(g)的热化学方程式为
(2)一定温度下,向恒容的密闭容器中充入N2 和H2 发生反应:N2+3H2
 2NH3,测得各组分浓度随时间变化如图所示。
2NH3,测得各组分浓度随时间变化如图所示。
①表示c(N2)的曲线是
②0~t0时,v(H2)=
③下列措施不能使该反应速率加快的是
a.升高温度 b.降低压强 c.使用催化剂
④下列能说明该反应达到平衡的是
a.混合气体的压强不再变化 b.2c(H2)= 3c(NH3) c.混合气体的质量不再变化
您最近一年使用:0次
名校
解题方法
10 . 生产生活中的化学反应都伴随着能量的变化,请根据有关知识回答下列问题:
(1)有科学家预言,氢能将成为21世纪的主要能源,而且是一种理想的绿色能源。在 下,
下,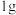 氢气完全燃烧生成液态水放出
氢气完全燃烧生成液态水放出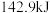 的热量,
的热量,
①请写出表示氢气燃烧热的热化学方程式____ 。
②将上述反应设计成下图所示的原电池,其中Y为___ 极(填“正”或“负”),该极电极反应式为___ 。
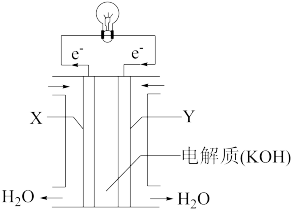
(2)最新一期国际学术期刊《自然·纳米技术》介绍了我国科学家曾杰团队的成果:在含铂高效催化剂作用下把二氧化碳高效转化清洁液态燃料——甲醇 。
。
①该法利用 制取甲醇的有关化学反应如下:
制取甲醇的有关化学反应如下:
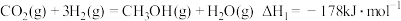
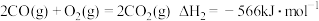
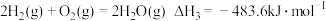
已知:i.断开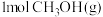 中的化学键共吸收
中的化学键共吸收 的能量
的能量
ii.反应①中部分化学键键能数据如下:
由此计算断开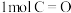 需要吸收
需要吸收____ kJ的能量,
____  。
。
②甲醇燃烧时发生如下反应(a、b、c、d均大于0):
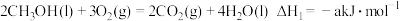
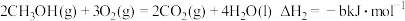
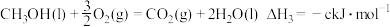
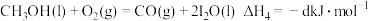
由此知,a、b、c、d由小到大排序为_______ 。
③将甲醇完全燃烧生成液态水的反应设计成原电池,以 为电解质。工作时负极的电极反应式
为电解质。工作时负极的电极反应式__ 。
(1)有科学家预言,氢能将成为21世纪的主要能源,而且是一种理想的绿色能源。在
 下,
下,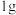 氢气完全燃烧生成液态水放出
氢气完全燃烧生成液态水放出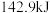 的热量,
的热量,①请写出表示氢气燃烧热的热化学方程式
②将上述反应设计成下图所示的原电池,其中Y为

(2)最新一期国际学术期刊《自然·纳米技术》介绍了我国科学家曾杰团队的成果:在含铂高效催化剂作用下把二氧化碳高效转化清洁液态燃料——甲醇
 。
。①该法利用
 制取甲醇的有关化学反应如下:
制取甲醇的有关化学反应如下: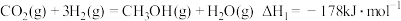
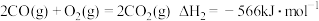
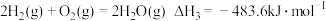
已知:i.断开
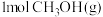 中的化学键共吸收
中的化学键共吸收 的能量
的能量ii.反应①中部分化学键键能数据如下:
| 化学键 | H-H | H-O |
键能/( ) ) | 436 | 463 |
由此计算断开
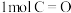 需要吸收
需要吸收
 。
。②甲醇燃烧时发生如下反应(a、b、c、d均大于0):
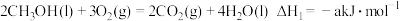
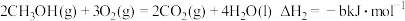
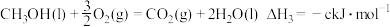
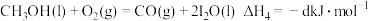
由此知,a、b、c、d由小到大排序为
③将甲醇完全燃烧生成液态水的反应设计成原电池,以
 为电解质。工作时负极的电极反应式
为电解质。工作时负极的电极反应式
您最近一年使用:0次



