名校
1 . 用CO2和H2在一定条件下可转化生成甲醇蒸气和水蒸CO2(g)+3H2(g) CH3OH(g)+H2O(g);ΔH=-akJ/mol
CH3OH(g)+H2O(g);ΔH=-akJ/mol
(1)已知:①3CO(g)+3H2(g) CH3OCH3(g)+CO2(g) ΔH=-247kJ/mol
CH3OCH3(g)+CO2(g) ΔH=-247kJ/mol
②2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH=-24kJ/mol
CH3OCH3(g)+H2O(g) ΔH=-24kJ/mol
③CO(g)+H2O(g) CO2(g)+H2(g) ΔH=-41kJ/mol
CO2(g)+H2(g) ΔH=-41kJ/mol
则a=___________ 。
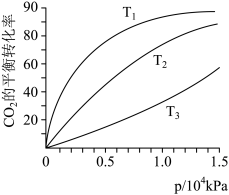
(2)CO2在不同温度下的平衡转化率与压强的关系如下图所示。请写出T1、T2、T3三者的大小关系___________ ,实际生产条件控制在T1、1.3×104kPa左右,选择此压强的理由是___________ 。
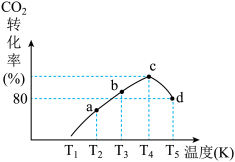
(3)一定条件下,在相同体积的恒容密闭容器中充入1.0molCO2和3.0molH2,相同时间段内测得CO2的转化率随温度变化如图所示:b点v正___________ v逆(填“>”“<”或“=”);温度高于T4,CO2的转化率降低的原因是___________ 。已知容器内的起始压强为200kPa,则图中d点对应温度下反应的平衡常数Kp=___________ (kPa)-2(结果保留两位有效数字)(KP为以分压表示的平衡常数,分压=总压×物质的量分数)
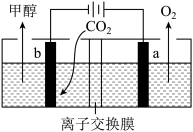
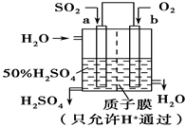
(4)用惰性电极电解强酸性的二氧化碳水溶液可得到甲醇,其原理如下图所示。
①b电极上的电极反应式为___________ ;
②该装置中使用的是___________ (填“阳”或“阴”)离子交换膜。
 CH3OH(g)+H2O(g);ΔH=-akJ/mol
CH3OH(g)+H2O(g);ΔH=-akJ/mol(1)已知:①3CO(g)+3H2(g)
 CH3OCH3(g)+CO2(g) ΔH=-247kJ/mol
CH3OCH3(g)+CO2(g) ΔH=-247kJ/mol②2CH3OH(g)
 CH3OCH3(g)+H2O(g) ΔH=-24kJ/mol
CH3OCH3(g)+H2O(g) ΔH=-24kJ/mol③CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH=-41kJ/mol
CO2(g)+H2(g) ΔH=-41kJ/mol则a=
(2)CO2在不同温度下的平衡转化率与压强的关系如下图所示。请写出T1、T2、T3三者的大小关系

(3)一定条件下,在相同体积的恒容密闭容器中充入1.0molCO2和3.0molH2,相同时间段内测得CO2的转化率随温度变化如图所示:b点v正

(4)用惰性电极电解强酸性的二氧化碳水溶液可得到甲醇,其原理如下图所示。
①b电极上的电极反应式为
②该装置中使用的是

您最近一年使用:0次
解题方法
2 . (1)潜艇中使用的液氨-液氧燃料电池工作原理如图所示:
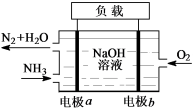
①电极a名称是___________ 。
②电解质溶液中OH-离子向___________ 移动(填“电极a”或 “电极b”)。
③电极b的电极反应式为___________ 。
④可以通过NH3跟NaClO反应来制得火箭燃料肼(N2H4)。该反应的化学方程式为___________ 。
(2)利用甲烷催化还原氮氧化物,可以消除氮氧化物的污染。已知:
①CH4 (g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H =-574 kJ/mol
②CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g) △H =-1160 kJ/mol
③H2O(l)=H2O(g) △H = +44 kJ/mol
写出CH4将NO2还原为N2并生成液态水时的热化学方程式___________ 。
(3)科研人员设想用如图原电池装置生产硫酸,则负极的电极反应式为___________ 。为稳定持续生产,硫酸溶液的浓度应维持不变,则通入SO2和水的质量比为___________ 。

①电极a名称是
②电解质溶液中OH-离子向
③电极b的电极反应式为
④可以通过NH3跟NaClO反应来制得火箭燃料肼(N2H4)。该反应的化学方程式为
(2)利用甲烷催化还原氮氧化物,可以消除氮氧化物的污染。已知:
①CH4 (g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H =-574 kJ/mol
②CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g) △H =-1160 kJ/mol
③H2O(l)=H2O(g) △H = +44 kJ/mol
写出CH4将NO2还原为N2并生成液态水时的热化学方程式
(3)科研人员设想用如图原电池装置生产硫酸,则负极的电极反应式为

您最近一年使用:0次
名校
解题方法
3 . 源开发和利用是科学研究的热点课题。
(1)几个有关CO的热化学方程式如下:
I.CO(g)+2H2(g)⇌CH3OH(g) ∆H1
II.2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ∆H2
III.CO(g)+H2O(g)⇌CO2(g)+H2(g) ∆H3
则3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g) ∆H=_______ (用含∆H1、∆H2、∆H3的代数表示)。
(2)在1L恒容密闭容器中充入一定量CH3OH发生反应:2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ∆H,测得CH3OH的浓度与温度的关系如图所示:
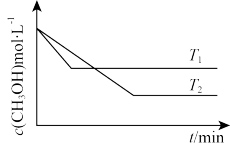
则T1_______ T2;∆H_______ 0(填“>”“<”或“=”)。
(3)工业上,利用水煤气合成CH3OH的反应表示如下:2H2(g)+CO(g)⇌CH3OH(g) ∆H=-91.0kJ·mol-1,向1L的恒容密容器中加入0.1molH2和0.05molCO在一定温度下发生上述反应,10min后反应达到平衡状态,测得放出的热量为3.64kJ。
①从反应开始恰好平衡状态时,H2的平均反应速率v(H2)为_______ 。
②在温度不变条件下,上述反应达到平衡后再向容器中充入0.01molH2和0.05molCH3OH(g)时,平衡_______ (填“向左移动”、“向右移动”或“不移动”)。
(4)探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
I.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H=-49.5kJ·mol-1
II.CO(g)+2H2(g)⇌CH3OH(g) ∆H2=-90.4kJ·mol-1
III.CO2(g)+H2(g)⇌CO(g)+H2O(g) ∆H3
一定条件下,向体积为VL的恒容密闭容器中通入1molCO2和3molH2发生上述反应,达到平衡时,容器中CH3OH(g)为amol,CO为bmol,此时H2O(g)的浓度为_______ mol·L-1(用含a、b、V的代数式表示,下同),反应III的平衡常数为_______ 。
(1)几个有关CO的热化学方程式如下:
I.CO(g)+2H2(g)⇌CH3OH(g) ∆H1
II.2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ∆H2
III.CO(g)+H2O(g)⇌CO2(g)+H2(g) ∆H3
则3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g) ∆H=
(2)在1L恒容密闭容器中充入一定量CH3OH发生反应:2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ∆H,测得CH3OH的浓度与温度的关系如图所示:

则T1
(3)工业上,利用水煤气合成CH3OH的反应表示如下:2H2(g)+CO(g)⇌CH3OH(g) ∆H=-91.0kJ·mol-1,向1L的恒容密容器中加入0.1molH2和0.05molCO在一定温度下发生上述反应,10min后反应达到平衡状态,测得放出的热量为3.64kJ。
①从反应开始恰好平衡状态时,H2的平均反应速率v(H2)为
②在温度不变条件下,上述反应达到平衡后再向容器中充入0.01molH2和0.05molCH3OH(g)时,平衡
(4)探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
I.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H=-49.5kJ·mol-1
II.CO(g)+2H2(g)⇌CH3OH(g) ∆H2=-90.4kJ·mol-1
III.CO2(g)+H2(g)⇌CO(g)+H2O(g) ∆H3
一定条件下,向体积为VL的恒容密闭容器中通入1molCO2和3molH2发生上述反应,达到平衡时,容器中CH3OH(g)为amol,CO为bmol,此时H2O(g)的浓度为
您最近一年使用:0次
4 . 随着低碳钢等洁净钢技术的发展,Al2O3-C耐火材料和钢水之间的相互作用已成为当前的一个研究重点。请回答下列问题:
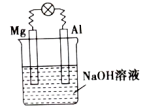
(1)将镁片、铝片平行插入一定浓度的NaOH溶液中,用导线连接成闭合回路,如图所示。写出铝电极的电极反应式:_____ 。
(2)在埋炭实验条件下,不同碳素材料的Al2O3-C耐火材料与铁液之间的可能反应如下:
①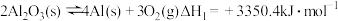
②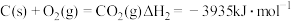
③
④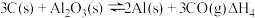 则
则

______  。
。
(3)直接碳热还原氧化铝法除需要高温外,系统中生成的碳化铝、碳氧化铝等会与生成的铝混合在一起,难以分离。实际生产中,至今仍未用直接碳热还原氧化铝法来炼铝。氧化铝碳热还原氯化法炼铝是生产铝的一种可行性新方法,其反应过程如下:
⑤
⑥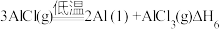
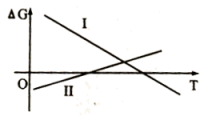
反应⑤、反应⑥中自由能( )与温度(T)的变化关系如图所示,由此判断反应⑤对应图中的曲线
)与温度(T)的变化关系如图所示,由此判断反应⑤对应图中的曲线____ (填“I”或“II”),试分析氧化铝碳热还原氯化法炼铝的可行性:______
(4)在埋炭情况下,碳过剩时,碳的氧化反应主要考虑: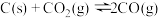 。在实验室研究该反应,一定温度下,向某体积可变的恒压密闭容器(总压强为p总)中加入足量的碳和2 molCO2(g),平衡时体系中气体体积分数与温度的关系如图所示。
。在实验室研究该反应,一定温度下,向某体积可变的恒压密闭容器(总压强为p总)中加入足量的碳和2 molCO2(g),平衡时体系中气体体积分数与温度的关系如图所示。
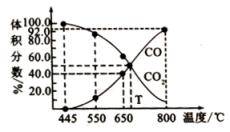
①650℃反应达到平衡时,容器体积为10L,则平衡时c(CO)=___________ 。
②T℃时,若向平衡体系中再充入一定量n(CO):n(CO2)=3:2的混合气体,则平衡___________ (填“向正反应方向”、“向逆反应方向”或“不”)移动。
③800℃时,如图CO的体积分数为92%,用平衡分压代替平衡浓度表示的化学平衡常数Kp=___________ [用含p总的代数式表示,气体分压(p分)=气体总压(p总) 体积分数]。
体积分数]。
(1)将镁片、铝片平行插入一定浓度的NaOH溶液中,用导线连接成闭合回路,如图所示。写出铝电极的电极反应式:

(2)在埋炭实验条件下,不同碳素材料的Al2O3-C耐火材料与铁液之间的可能反应如下:
①
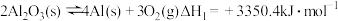
②
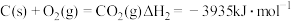
③

④
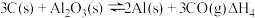 则
则
 。
。(3)直接碳热还原氧化铝法除需要高温外,系统中生成的碳化铝、碳氧化铝等会与生成的铝混合在一起,难以分离。实际生产中,至今仍未用直接碳热还原氧化铝法来炼铝。氧化铝碳热还原氯化法炼铝是生产铝的一种可行性新方法,其反应过程如下:
⑤

⑥
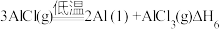
反应⑤、反应⑥中自由能(
 )与温度(T)的变化关系如图所示,由此判断反应⑤对应图中的曲线
)与温度(T)的变化关系如图所示,由此判断反应⑤对应图中的曲线
(4)在埋炭情况下,碳过剩时,碳的氧化反应主要考虑:
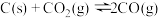 。在实验室研究该反应,一定温度下,向某体积可变的恒压密闭容器(总压强为p总)中加入足量的碳和2 molCO2(g),平衡时体系中气体体积分数与温度的关系如图所示。
。在实验室研究该反应,一定温度下,向某体积可变的恒压密闭容器(总压强为p总)中加入足量的碳和2 molCO2(g),平衡时体系中气体体积分数与温度的关系如图所示。
①650℃反应达到平衡时,容器体积为10L,则平衡时c(CO)=
②T℃时,若向平衡体系中再充入一定量n(CO):n(CO2)=3:2的混合气体,则平衡
③800℃时,如图CO的体积分数为92%,用平衡分压代替平衡浓度表示的化学平衡常数Kp=
 体积分数]。
体积分数]。
您最近一年使用:0次
解题方法
5 . 石油是宝贵的能源,属于战略资源。 、
、 均是石油裂解的产物。请回答下列问题:
均是石油裂解的产物。请回答下列问题:
(1)石油裂化、裂解为_______ (填“物理”或“化学")变化。
(2)已知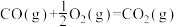
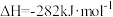
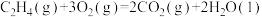
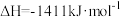
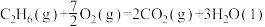
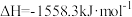
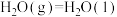
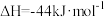
则反应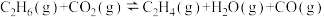

_______  。
。
(3)一定温度下,在某2L恒容密闭容器中充入1mol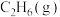 和1mol
和1mol 发生反应
发生反应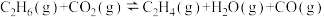 ,10min后达到平衡,容器内压强为起始压强的1.25倍。
,10min后达到平衡,容器内压强为起始压强的1.25倍。
①下列说法可以判定反应到达平衡状态的是_______ 。(填字母序号)
A.
B.相同时间内,断裂2mol 的同时断裂1mol
的同时断裂1mol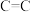
C.容器内气体的密度不再发生变化
D.容器内气体的平均相对分子质量不再发生变化
②0~10min,v(CO)=_______  ,
, 的转化率为
的转化率为_______ %, 的体积分数为
的体积分数为_______ %。
 、
、 均是石油裂解的产物。请回答下列问题:
均是石油裂解的产物。请回答下列问题:(1)石油裂化、裂解为
(2)已知
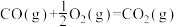
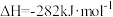
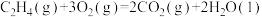
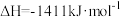
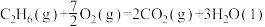
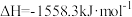
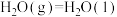
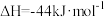
则反应
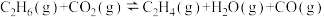

 。
。(3)一定温度下,在某2L恒容密闭容器中充入1mol
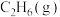 和1mol
和1mol 发生反应
发生反应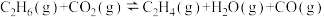 ,10min后达到平衡,容器内压强为起始压强的1.25倍。
,10min后达到平衡,容器内压强为起始压强的1.25倍。①下列说法可以判定反应到达平衡状态的是
A.

B.相同时间内,断裂2mol
 的同时断裂1mol
的同时断裂1mol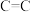
C.容器内气体的密度不再发生变化
D.容器内气体的平均相对分子质量不再发生变化
②0~10min,v(CO)=
 ,
, 的转化率为
的转化率为 的体积分数为
的体积分数为
您最近一年使用:0次
解题方法
6 . (1)研究 、
、 等大气污染气体的处理方法具有重要的意义。
等大气污染气体的处理方法具有重要的意义。
已知:①
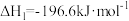
②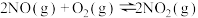
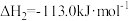
则反应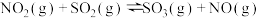 的
的
_______  。
。
(2)t℃时,将2mol 和1mol
和1mol 通入体积为2L的恒温、恒容密闭容器中,发生如下反应:
通入体积为2L的恒温、恒容密闭容器中,发生如下反应: ,2min时反应达到化学平衡,此时测得容器内的压强为起始压强的0.8倍,请回答:
,2min时反应达到化学平衡,此时测得容器内的压强为起始压强的0.8倍,请回答:
①下列叙述能证明该反应已达到化学平衡状态的是_______ (选填字母)。
A.容器内压强不再发生变化
B. 的体积分数不再发生变化
的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗2nmol 的同时消耗nmol
的同时消耗nmol
E.相同时间内消耗2nmol 的同时生成nmol
的同时生成nmol
F.混合气体密度不再变化
②从反应开始到达化学平衡,生成 的平均反应速率为
的平均反应速率为___ ;平衡时, 的转化率为
的转化率为___ 。
(3)已知 电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是
电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是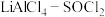 。电池的总反应可表示为
。电池的总反应可表示为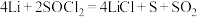 。请回答下列问题:
。请回答下列问题:
①电池的负极材料为_______ ,发生的电极反应为_______ 。
②电池正极发生的电极反应为_______ 。
 、
、 等大气污染气体的处理方法具有重要的意义。
等大气污染气体的处理方法具有重要的意义。已知:①

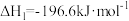
②
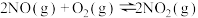
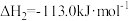
则反应
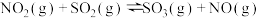 的
的
 。
。(2)t℃时,将2mol
 和1mol
和1mol 通入体积为2L的恒温、恒容密闭容器中,发生如下反应:
通入体积为2L的恒温、恒容密闭容器中,发生如下反应: ,2min时反应达到化学平衡,此时测得容器内的压强为起始压强的0.8倍,请回答:
,2min时反应达到化学平衡,此时测得容器内的压强为起始压强的0.8倍,请回答:①下列叙述能证明该反应已达到化学平衡状态的是
A.容器内压强不再发生变化
B.
 的体积分数不再发生变化
的体积分数不再发生变化C.容器内气体原子总数不再发生变化
D.相同时间内消耗2nmol
 的同时消耗nmol
的同时消耗nmol
E.相同时间内消耗2nmol
 的同时生成nmol
的同时生成nmol
F.混合气体密度不再变化
②从反应开始到达化学平衡,生成
 的平均反应速率为
的平均反应速率为 的转化率为
的转化率为(3)已知
 电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是
电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是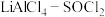 。电池的总反应可表示为
。电池的总反应可表示为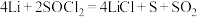 。请回答下列问题:
。请回答下列问题:①电池的负极材料为
②电池正极发生的电极反应为
您最近一年使用:0次
7 . 氢气因燃值高、燃烧产物无污染,被公认为清洁能源。
(1)电解饱和食盐水可制取氢气,该反应的化学方程式为___________ 。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①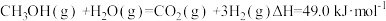
②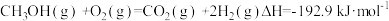
又知:③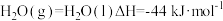
则表示甲醇摩尔燃烧焓的热化学方程式为___________
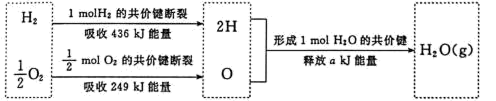
(3)已知1molH2 完全燃烧生成H2O(g) ,放出 245kJ 能量。根据下列信息,计算a____ 。
(4)氢氧燃料电池是符合绿色化学理念的新型发电装置,下图为氢氧燃料电池的示意图。
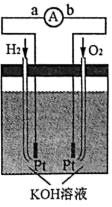
①在导线中电子流动方向为___________ (用 a、b 表示)。
②电极表面镀一层细小的铂粉,其目的是___________ 。
③该电池的负极反应式为H2 2e 2OH 2H2O,请写出正极反应式___________ 。
④假设该电池每发 1 度电(1 度 3.6 106 J )能生成 450g 水蒸气,则该电池的能量转化率为___________ (保留小数点后一位)。
(1)电解饱和食盐水可制取氢气,该反应的化学方程式为
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①
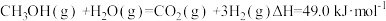
②
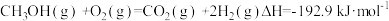
又知:③
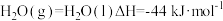
则表示甲醇摩尔燃烧焓的热化学方程式为
(3)已知1molH2 完全燃烧生成H2O(g) ,放出 245kJ 能量。根据下列信息,计算a

(4)氢氧燃料电池是符合绿色化学理念的新型发电装置,下图为氢氧燃料电池的示意图。

①在导线中电子流动方向为
②电极表面镀一层细小的铂粉,其目的是
③该电池的负极反应式为H2 2e 2OH 2H2O,请写出正极反应式
④假设该电池每发 1 度电(1 度 3.6 106 J )能生成 450g 水蒸气,则该电池的能量转化率为
您最近一年使用:0次
名校
8 . 2021年6月17日,搭载神舟十二号载人飞船的长征二号F摇十二运载火箭,在酒泉卫星发射中心发射。该运载火箭推进物分为偏二甲基肼(C2H8N2)、四氧化二氮和液氢、液氧两种。
(1)氨热分解法制氢气,相关化学键的键能数据如下表所示:
由以上数据可求得2NH3(g)⇌N2(g)+3H2(g)∆H=_______ 。
(2)在298.15K、100kPa条件下,N2(g)、H2(g)和NH3(g)的摩尔热容分别为29.1、28.9和35.6J·K-1·mol-1(已知:摩尔热容是指单位物质的量的某种物质升高单位温度所需的热量)。N2(g)、H2(g)合成NH3(g)的能量随温度T的变化示意图合理的是_______ 。
A.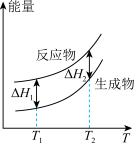 B.
B. 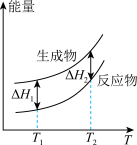 C.
C. 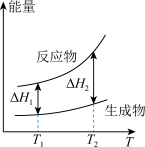 D.
D.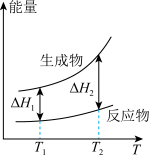
(3)甲烷水蒸气催化重整是制高纯氢的方法之一、反应器中存在如下反应:
i.CH4(g)+H2O(g)=CO(g)+3H2(g)ΔH1
ii.CO(g)+H2O(g)=CO2(g)+H2(g)ΔH2
iii.C(s)+2H2O(g)=CO2(g)+2H2(g)ΔH3
iv.CH4(g)=C(s)+2H2(g)ΔH4
ⅳ为积炭反应,利用ΔH1、ΔH2和ΔH3,可计算ΔH4=_______ 。
(4)3.0g液态偏二甲基肼与足量液态四氧化二氮完全反应生成N2(g)、H2O(g)和CO2(g),放出112.5kJ的热量,写出上述反应的热化学方程式_______ 。
(5)对C2H8N2和N2O4反应的说法正确的是_______ 。
A.偏二甲肼是比液氢更环保的燃料
B.N2即是氧化产物,又是还原产物
C.偏二甲基肼的燃烧热为2250kJ/mol
D.偏二甲肼在四氧化二氮中的燃烧是放热反应
(1)氨热分解法制氢气,相关化学键的键能数据如下表所示:
| 化学键 | N≡N | H—H | N—H |
| 键能E(kJ/mol) | 946.0 | 436.0 | 390.8 |
(2)在298.15K、100kPa条件下,N2(g)、H2(g)和NH3(g)的摩尔热容分别为29.1、28.9和35.6J·K-1·mol-1(已知:摩尔热容是指单位物质的量的某种物质升高单位温度所需的热量)。N2(g)、H2(g)合成NH3(g)的能量随温度T的变化示意图合理的是
A.
 B.
B.  C.
C.  D.
D.
(3)甲烷水蒸气催化重整是制高纯氢的方法之一、反应器中存在如下反应:
i.CH4(g)+H2O(g)=CO(g)+3H2(g)ΔH1
ii.CO(g)+H2O(g)=CO2(g)+H2(g)ΔH2
iii.C(s)+2H2O(g)=CO2(g)+2H2(g)ΔH3
iv.CH4(g)=C(s)+2H2(g)ΔH4
ⅳ为积炭反应,利用ΔH1、ΔH2和ΔH3,可计算ΔH4=
(4)3.0g液态偏二甲基肼与足量液态四氧化二氮完全反应生成N2(g)、H2O(g)和CO2(g),放出112.5kJ的热量,写出上述反应的热化学方程式
(5)对C2H8N2和N2O4反应的说法正确的是
A.偏二甲肼是比液氢更环保的燃料
B.N2即是氧化产物,又是还原产物
C.偏二甲基肼的燃烧热为2250kJ/mol
D.偏二甲肼在四氧化二氮中的燃烧是放热反应
您最近一年使用:0次
解题方法
9 .  为工业制硫酸的重要反应。回答下列问题:
为工业制硫酸的重要反应。回答下列问题:
(1)已知该反应在反应过程中体系温度会升高,且每摩尔 、
、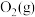 、
、 所含化学能分别为
所含化学能分别为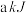 、
、 、
、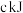 ,则每有
,则每有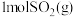 参与反应时,
参与反应时,_______ (填“吸收”或“放出”)的能量为_______  。
。
(2)一定温度下,向体积为2L的刚性密闭容器中充入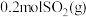 和
和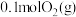 ,发生反应:
,发生反应: 。反应过程中容器内各物质的分压随时间变化关系如图所示:已知:分压等于各自物质的量分数乘以总压,例如
。反应过程中容器内各物质的分压随时间变化关系如图所示:已知:分压等于各自物质的量分数乘以总压,例如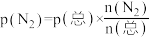 。
。
①图中表示 分压变化的曲线为
分压变化的曲线为_______ (填“Ⅰ”“Ⅱ”或“Ⅲ”); 时,
时, 的转化率为
的转化率为_______ 。
② 内,用
内,用 表示该反应的速率为
表示该反应的速率为_______  。
。
③能说明上述反应已达到平衡状态的是_______ (填选项字母)。
a.容器内 、
、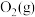 的物质的量浓度之比为
的物质的量浓度之比为
b.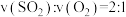
c.容器中气体的密度不随时间而变化
d.容器内压强不随时间面变化
 为工业制硫酸的重要反应。回答下列问题:
为工业制硫酸的重要反应。回答下列问题:(1)已知该反应在反应过程中体系温度会升高,且每摩尔
 、
、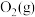 、
、 所含化学能分别为
所含化学能分别为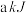 、
、 、
、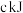 ,则每有
,则每有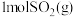 参与反应时,
参与反应时, 。
。(2)一定温度下,向体积为2L的刚性密闭容器中充入
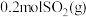 和
和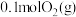 ,发生反应:
,发生反应: 。反应过程中容器内各物质的分压随时间变化关系如图所示:已知:分压等于各自物质的量分数乘以总压,例如
。反应过程中容器内各物质的分压随时间变化关系如图所示:已知:分压等于各自物质的量分数乘以总压,例如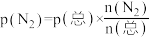 。
。
①图中表示
 分压变化的曲线为
分压变化的曲线为 时,
时, 的转化率为
的转化率为②
 内,用
内,用 表示该反应的速率为
表示该反应的速率为 。
。③能说明上述反应已达到平衡状态的是
a.容器内
 、
、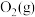 的物质的量浓度之比为
的物质的量浓度之比为
b.
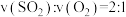
c.容器中气体的密度不随时间而变化
d.容器内压强不随时间面变化
您最近一年使用:0次
解题方法
10 . i.研究CO2的利用具有现实意义,比如将CO2与焦炭作用生成CO,CO可用于炼铁、设计燃料电池等。
已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH1=+489kJ/mol
C(石墨)+CO2(g)=2CO(g) ΔH2=+172kJ/mol
写出Fe2O3和CO为原料冶炼铁的热化学方程式_______ 。
ii.环境空气质量指数(AQI)日报和实时报告包括了NO2、CO、O3、PM10、PM2.5等指标,为公众提供健康指引,引导当地居民合理安排出行和生活。请回答下列问题:
(1)汽车排出的尾气中含有CO和NO等气体,用化学方程式解释产生NO的原因:_______ 。
(2)汽车排气管内安装催化转化器,可使汽车尾气中的主要污染物转化为无毒的大气循环物质。已知:
N2(g)+O2(g)=2NO(g) ΔΗ=+180.5kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔΗ=-221.0kJ·mol-1
C(s)+O2(g)=CO2(g) ΔΗ=-393.5kJ·mol-1
则反应2NO(g)+2CO(g)⇌N2(g)+2CO2(g)的ΔΗ=_______ kJ·mol-1。
iii.据报道,最近摩托罗拉公司研制了一种由甲醇和氧气以及强碱作电解质溶液的新型手机电池,电量可达现用镍氢电池或锂电池的10倍。已知该电池的总反应为 。请回答下列问题:
。请回答下列问题:
(1)该燃料电池的正极反应式为_______ 。
(2)该燃料电池的负极反应式为_______ 。
(3)当外电路中通过1.2mol电子时,理论上消耗甲醇的质量是_______ g。
已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH1=+489kJ/mol
C(石墨)+CO2(g)=2CO(g) ΔH2=+172kJ/mol
写出Fe2O3和CO为原料冶炼铁的热化学方程式
ii.环境空气质量指数(AQI)日报和实时报告包括了NO2、CO、O3、PM10、PM2.5等指标,为公众提供健康指引,引导当地居民合理安排出行和生活。请回答下列问题:
(1)汽车排出的尾气中含有CO和NO等气体,用化学方程式解释产生NO的原因:
(2)汽车排气管内安装催化转化器,可使汽车尾气中的主要污染物转化为无毒的大气循环物质。已知:
N2(g)+O2(g)=2NO(g) ΔΗ=+180.5kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔΗ=-221.0kJ·mol-1
C(s)+O2(g)=CO2(g) ΔΗ=-393.5kJ·mol-1
则反应2NO(g)+2CO(g)⇌N2(g)+2CO2(g)的ΔΗ=
iii.据报道,最近摩托罗拉公司研制了一种由甲醇和氧气以及强碱作电解质溶液的新型手机电池,电量可达现用镍氢电池或锂电池的10倍。已知该电池的总反应为
 。请回答下列问题:
。请回答下列问题:(1)该燃料电池的正极反应式为
(2)该燃料电池的负极反应式为
(3)当外电路中通过1.2mol电子时,理论上消耗甲醇的质量是
您最近一年使用:0次



