1 . CO用于处理大气污染物N2O的原理为CO(g)+N2O(g) CO2(g)+N2(g) ΔH=-224.0kJ·mol-1。有人提出上述反应可以用“Fe”作催化剂,其总反应分两步进行:
CO2(g)+N2(g) ΔH=-224.0kJ·mol-1。有人提出上述反应可以用“Fe”作催化剂,其总反应分两步进行:
(1)第一步:Fe++N2O FeO++N2;第二步:
FeO++N2;第二步:_______ (写离子反应方)。
(2)第二步反应不影响总反应达到平衡所用时间,由此推知,第二步反应速率_______ 第一步反应速率(填“大于”“小于”或“等于”)。
(3)合成天然气(SNG)涉及的主要反应原理如下:
CO甲烷化:CO(g)+3H2(g) CH4(g)+H2O(g) ΔH1=-206.2kJ·mol-1
CH4(g)+H2O(g) ΔH1=-206.2kJ·mol-1
水煤气变换:CO(g)+H2O(g) CO2(g)+H2(g) ΔH2=-41.2kJ·mol-1
CO2(g)+H2(g) ΔH2=-41.2kJ·mol-1
反应CO2(g)+4H2(g) CH4(g)+2H2O(g)的ΔH=
CH4(g)+2H2O(g)的ΔH=_______ kJ·mol-1。
 CO2(g)+N2(g) ΔH=-224.0kJ·mol-1。有人提出上述反应可以用“Fe”作催化剂,其总反应分两步进行:
CO2(g)+N2(g) ΔH=-224.0kJ·mol-1。有人提出上述反应可以用“Fe”作催化剂,其总反应分两步进行:(1)第一步:Fe++N2O
 FeO++N2;第二步:
FeO++N2;第二步:(2)第二步反应不影响总反应达到平衡所用时间,由此推知,第二步反应速率
(3)合成天然气(SNG)涉及的主要反应原理如下:
CO甲烷化:CO(g)+3H2(g)
 CH4(g)+H2O(g) ΔH1=-206.2kJ·mol-1
CH4(g)+H2O(g) ΔH1=-206.2kJ·mol-1水煤气变换:CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH2=-41.2kJ·mol-1
CO2(g)+H2(g) ΔH2=-41.2kJ·mol-1反应CO2(g)+4H2(g)
 CH4(g)+2H2O(g)的ΔH=
CH4(g)+2H2O(g)的ΔH=
您最近一年使用:0次
解题方法
2 . 化石燃料的开发、利用和燃烧尾气处理成为研究的热点。
(1)利用焦炉煤气制取甲醇,发生的主要反应为CO(g)+2H2(g) CH3OH(g)。下表所列为常见化学键的键能数据:(提示CO和N2是等电子体,其电子式相似)
CH3OH(g)。下表所列为常见化学键的键能数据:(提示CO和N2是等电子体,其电子式相似)
则CO(g)+2H2(g) CH3OH(g)的△H=
CH3OH(g)的△H=__________ kJ·mol-1,若想提高CH3COH的产率,可以采取的措施有__________ 、__________ (任写2条)。
(2)可以用H2等清洁能源代替天然气(主要成分CH4),两者的热化学方程式如下:H2(g) + O2(g) = H2O(1) △H= -286 kJ·mol-1;CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890 kJ/mol。现有H2与CH4的混合气体112L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热2034 kJ,则原混合气体中H2与CH4的物质的量之比是
O2(g) = H2O(1) △H= -286 kJ·mol-1;CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890 kJ/mol。现有H2与CH4的混合气体112L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热2034 kJ,则原混合气体中H2与CH4的物质的量之比是_______ 。反应过程中消耗的氧气在标注状况下的体积为_________ 。
(3)化石燃料会排放含SO2的烟气会形成酸雨,危害环境。工业上常用催化还原法和碱吸收法处理SO2体。1molCH4完全燃烧生成气态水和1molS(g)燃烧的能量变化如下图所示:
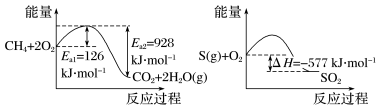
在催化剂作用下,CH4可以还原SO2生成单质S(g)、H2O(g)和CO2,写出该反应的热化学方程式:__________ ;也可以用NaOH吸收化石燃料燃烧产生的SO2,然后通入足量的O2,这样做的目的是__________ ;
(4)第(3)题中得到的S在O2中燃烧生成SO2,在催化剂的作用下与O2发生反应产生SO3,所发生的的化学方程式为2SO2(g) +O2(g) 2SO3(g),在温度不变的情况下,同时加快该反应的化学反应速率和提高SO2的转化率的措施有
2SO3(g),在温度不变的情况下,同时加快该反应的化学反应速率和提高SO2的转化率的措施有__________ (任写1条)。
(1)利用焦炉煤气制取甲醇,发生的主要反应为CO(g)+2H2(g)
 CH3OH(g)。下表所列为常见化学键的键能数据:(提示CO和N2是等电子体,其电子式相似)
CH3OH(g)。下表所列为常见化学键的键能数据:(提示CO和N2是等电子体,其电子式相似)| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能(kJ/mol) | 348 | 414 | 436 | 327 | 1032 | 464 |
则CO(g)+2H2(g)
 CH3OH(g)的△H=
CH3OH(g)的△H=(2)可以用H2等清洁能源代替天然气(主要成分CH4),两者的热化学方程式如下:H2(g) +
 O2(g) = H2O(1) △H= -286 kJ·mol-1;CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890 kJ/mol。现有H2与CH4的混合气体112L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热2034 kJ,则原混合气体中H2与CH4的物质的量之比是
O2(g) = H2O(1) △H= -286 kJ·mol-1;CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890 kJ/mol。现有H2与CH4的混合气体112L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热2034 kJ,则原混合气体中H2与CH4的物质的量之比是(3)化石燃料会排放含SO2的烟气会形成酸雨,危害环境。工业上常用催化还原法和碱吸收法处理SO2体。1molCH4完全燃烧生成气态水和1molS(g)燃烧的能量变化如下图所示:

在催化剂作用下,CH4可以还原SO2生成单质S(g)、H2O(g)和CO2,写出该反应的热化学方程式:
(4)第(3)题中得到的S在O2中燃烧生成SO2,在催化剂的作用下与O2发生反应产生SO3,所发生的的化学方程式为2SO2(g) +O2(g)
 2SO3(g),在温度不变的情况下,同时加快该反应的化学反应速率和提高SO2的转化率的措施有
2SO3(g),在温度不变的情况下,同时加快该反应的化学反应速率和提高SO2的转化率的措施有
您最近一年使用:0次
解题方法
3 . 已知: 4Al(s) +3O2 (g)=2 Al2O3 (s) △H1= -3264 kJ·mol-1; 3Fe + 4O2 (g)=Fe3O4(s) △H2= -1120 kJ·mol-1。则3 Fe3O4(s) + 8Al(s)=4Al2O3 (s) + 9Fe(s) 的反应热△H3为
| A.+3186 kJ·mol-1 | B.-3186 kJ·mol-1 | C.-2114 kJ·mol-1 | D.+2114 kJ·mol-1 |
您最近一年使用:0次
解题方法
4 . 发射卫星时可用肼(N2H4)作燃料,用二氧化氮作氧化剂,这两种物质反应生成氮气和水蒸气。
已知:N2(g)+2O2(g)=2NO2(g) ΔH=+67.7kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534kJ·mol-1
 H2(g)+
H2(g)+ F2(g)=HF(g) ΔH=-269kJ·mol-1
F2(g)=HF(g) ΔH=-269kJ·mol-1
H2(g)+ O2(g)=H2O(g) ΔH=-242kJ·mol-1
O2(g)=H2O(g) ΔH=-242kJ·mol-1
(1)肼和二氧化氮反应的热化学方程式为_______ 。
(2)有人认为若用氟气代替二氧化氮作氧化剂,则反应释放的能量更大。肼和氟反应的热化学方程式为_______ 。
已知:N2(g)+2O2(g)=2NO2(g) ΔH=+67.7kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534kJ·mol-1
 H2(g)+
H2(g)+ F2(g)=HF(g) ΔH=-269kJ·mol-1
F2(g)=HF(g) ΔH=-269kJ·mol-1H2(g)+
 O2(g)=H2O(g) ΔH=-242kJ·mol-1
O2(g)=H2O(g) ΔH=-242kJ·mol-1(1)肼和二氧化氮反应的热化学方程式为
(2)有人认为若用氟气代替二氧化氮作氧化剂,则反应释放的能量更大。肼和氟反应的热化学方程式为
您最近一年使用:0次
解题方法
5 . 按下列要求填空
(1)常温下,1mol NO2气体溶于水中,生成硝酸和NO气体,放热46kJ,则热化学方程式为:_______
(2)已知298K,101kPa时,1mol气态水转化为1mol液态水放出热量44kJ,并且知道热化学方程式: =2H2O(g) ∆H=-483.6kJ·
=2H2O(g) ∆H=-483.6kJ· 。请写出该条件下氢气与氧气反应生成液态水的热化学方程式:
。请写出该条件下氢气与氧气反应生成液态水的热化学方程式:_______
(3)已知反应:H2(g)+ O2(g)=H2O(g) ∆H1 N2(g)+2O2=2NO2(g) ∆H2
O2(g)=H2O(g) ∆H1 N2(g)+2O2=2NO2(g) ∆H2  N2(g)+
N2(g)+ H2(g)=NH3(g) ∆H3;利用上述三个反应,计算4NH3(g)+7O2(g)=4NO2(g)+6H2O(g)的反应焓变为
H2(g)=NH3(g) ∆H3;利用上述三个反应,计算4NH3(g)+7O2(g)=4NO2(g)+6H2O(g)的反应焓变为_______ (用含∆H1、∆H2、∆H3的式子表示)。
(4)在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。
(1)已知:N2(g)+O2(g)=2NO(g) ΔH=+180.5 kJ/mol;
2C(s)+O2(g)=2CO(g) ΔH=-221.0 kJ/mol;
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol。
尾气转化的反应之一为NO和CO生成N2和CO2,则该反应的热化学方程式为:______
(1)常温下,1mol NO2气体溶于水中,生成硝酸和NO气体,放热46kJ,则热化学方程式为:
(2)已知298K,101kPa时,1mol气态水转化为1mol液态水放出热量44kJ,并且知道热化学方程式:
 =2H2O(g) ∆H=-483.6kJ·
=2H2O(g) ∆H=-483.6kJ· 。请写出该条件下氢气与氧气反应生成液态水的热化学方程式:
。请写出该条件下氢气与氧气反应生成液态水的热化学方程式:(3)已知反应:H2(g)+
 O2(g)=H2O(g) ∆H1 N2(g)+2O2=2NO2(g) ∆H2
O2(g)=H2O(g) ∆H1 N2(g)+2O2=2NO2(g) ∆H2  N2(g)+
N2(g)+ H2(g)=NH3(g) ∆H3;利用上述三个反应,计算4NH3(g)+7O2(g)=4NO2(g)+6H2O(g)的反应焓变为
H2(g)=NH3(g) ∆H3;利用上述三个反应,计算4NH3(g)+7O2(g)=4NO2(g)+6H2O(g)的反应焓变为(4)在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。
(1)已知:N2(g)+O2(g)=2NO(g) ΔH=+180.5 kJ/mol;
2C(s)+O2(g)=2CO(g) ΔH=-221.0 kJ/mol;
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol。
尾气转化的反应之一为NO和CO生成N2和CO2,则该反应的热化学方程式为:
您最近一年使用:0次
6 . 已知:①C(s)+2H2(g)=CH4(g) ΔH1 ②C(s)+ H2(g)=
H2(g)= C2H2(g) ΔH2 ③C(s)+H2(g)=
C2H2(g) ΔH2 ③C(s)+H2(g)= C2H4(g) ΔH3;且ΔH2<ΔH3<ΔH1<0。则关于反应C2H2(g)+H2(g)=C2H4(g)和2CH4(g)=C2H4(g)+2H2(g)的说法正确的是
C2H4(g) ΔH3;且ΔH2<ΔH3<ΔH1<0。则关于反应C2H2(g)+H2(g)=C2H4(g)和2CH4(g)=C2H4(g)+2H2(g)的说法正确的是
 H2(g)=
H2(g)= C2H2(g) ΔH2 ③C(s)+H2(g)=
C2H2(g) ΔH2 ③C(s)+H2(g)= C2H4(g) ΔH3;且ΔH2<ΔH3<ΔH1<0。则关于反应C2H2(g)+H2(g)=C2H4(g)和2CH4(g)=C2H4(g)+2H2(g)的说法正确的是
C2H4(g) ΔH3;且ΔH2<ΔH3<ΔH1<0。则关于反应C2H2(g)+H2(g)=C2H4(g)和2CH4(g)=C2H4(g)+2H2(g)的说法正确的是| A.都是放热反应 | B.都是吸热反应 |
| C.前者放热后者吸热 | D.前者吸热后者放热 |
您最近一年使用:0次
解题方法
7 . 氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用
(1)肼(N2H4)可作为火箭发动机的燃料。肼(N2H4)与氧化剂N2O4(l)反应生成N2和水蒸气。已知:
①N2(g)+2O2(g)=N2O4(l) ΔH1=-195 kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=-534kJ·mol-1
试计算1 mol肼(l)与N2O4(l)完全反应生成N2和水蒸气时放出的热量为______ kJ,写出肼(l)和N2O4(l)反应的热化学方程式:_____________________ 。
(2)肼一空气燃料电池是一种碱性电池(产物无污染),该电池放电时,负极的电极反应式为________ 。
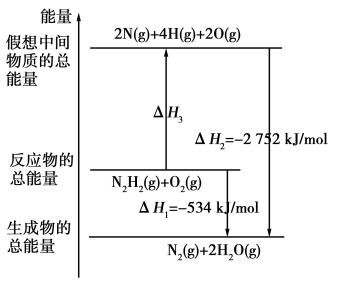
(3)有关肼化学反应的能量变化如图所示,已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,则ΔH3=________ ,断裂1 mol N—H键所需的能量是________ kJ。
(1)肼(N2H4)可作为火箭发动机的燃料。肼(N2H4)与氧化剂N2O4(l)反应生成N2和水蒸气。已知:
①N2(g)+2O2(g)=N2O4(l) ΔH1=-195 kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=-534kJ·mol-1
试计算1 mol肼(l)与N2O4(l)完全反应生成N2和水蒸气时放出的热量为
(2)肼一空气燃料电池是一种碱性电池(产物无污染),该电池放电时,负极的电极反应式为
(3)有关肼化学反应的能量变化如图所示,已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,则ΔH3=

您最近一年使用:0次
名校
解题方法
8 . 下列热化学方程式或叙述正确的是
| A.1 mol液态肼在足量氧气中完全燃烧生成水蒸气,放出642 kJ的热量:N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH=+642 kJ·mol-1 |
| B.12 g石墨转化为CO时,放出110.5 kJ的热量:2C(石墨,s)+O2(g)=2CO(g) ΔH=-110.5 kJ·mol-1 |
C.已知:H2(g)+ O2(g)=H2O(l) ΔH=-286 kJ·mol-1,则:2H2O(l)=2H2(g)+O2(g) ΔH=+572 kJ·mol-1 O2(g)=H2O(l) ΔH=-286 kJ·mol-1,则:2H2O(l)=2H2(g)+O2(g) ΔH=+572 kJ·mol-1 |
D.已知N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,则在一定条件下向密闭容器中充入0.5 mol N2(g)和1.5 mol H2(g)充分反应放出46.2 kJ的热量 2NH3(g) ΔH=-92.4 kJ·mol-1,则在一定条件下向密闭容器中充入0.5 mol N2(g)和1.5 mol H2(g)充分反应放出46.2 kJ的热量 |
您最近一年使用:0次
2022-12-10更新
|
178次组卷
|
3卷引用:河北省唐山市迁西县职业技术教育中心2021-2022学年高二(普职融通部)上学期9月月考化学试题
9 . 联氨(N2H4)常温下为无色液体,可用作火箭燃料。
①2O2(g)+N2(g)=N2O4(l) ΔH1 ②N2(g)+2H2(g)=N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3 ④2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH4=﹣1048.9 kJ·mol−1
下列说法不正确的是
①2O2(g)+N2(g)=N2O4(l) ΔH1 ②N2(g)+2H2(g)=N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3 ④2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH4=﹣1048.9 kJ·mol−1
下列说法不正确的是
| A.O2(g)+2H2(g)=2H2O(l) ΔH5,ΔH5>ΔH3 |
| B.ΔH4=2ΔH3﹣2ΔH2﹣ΔH1 |
| C.1 mol O2(g)和2 mol H2(g)具有的总能量高于2 mol H2O(g) |
| D.联氨和N2O4作火箭推进剂的原因之一是反应放出大量的热 |
您最近一年使用:0次
2022-12-10更新
|
123次组卷
|
2卷引用:河北省唐山市迁西县职业技术教育中心2021-2022学年高二(普职融通部)上学期9月月考化学试题
名校
解题方法
10 . CH4-CO2催化重整可以得到合成气(CO和H2),有利于减少温室效应。催化重整时还存在以下反应:
积碳反应:CH4(g)=C(s)+2H2(g) ΔH=+75kJ·mol-1
消碳反应:CO2(g)+C(s)=2CO(g) ΔH=+172kJ·mol-1
(1)写出 CH4-CO2催化重整反应的热化学方程式_________ 。
(2)在刚性容器中,当投料比 时,CO2的平衡转化率(α)与温度(T)、初始压强(p)的关系如图所示。
时,CO2的平衡转化率(α)与温度(T)、初始压强(p)的关系如图所示。
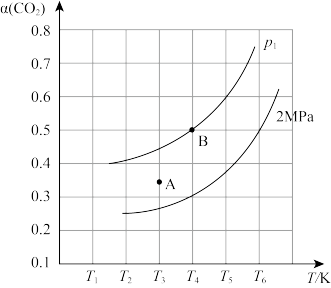
①由图可知,压强p1_________ 2MPa(填“大于”,“小于”或“等于”),理由是_________ 。
②当温度为T3、压强为2MPa时,A点的v正_________ v逆(填“大于”、“小于”或“等于”)。
③起始时向容器中加入1mol CH4和1mol CO2,根据图中点B(T4,0.5),计算该温度时反应的平衡常数Kp=_________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)一定温度下,测得某催化剂上沉积碳的生成速率方程为v=k·p(CH4)·[p(CO2)]-0.5(k为速率常数) (k为速率常数)。
①在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2),pb(CO2),pc(CO2)从大到小的顺序为_________ 。
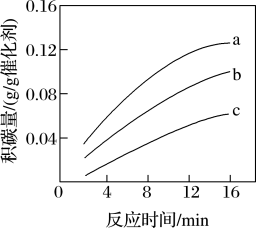
②_________ (填“增大”或“减小”)投料比 ,有助于减少积碳。
,有助于减少积碳。
积碳反应:CH4(g)=C(s)+2H2(g) ΔH=+75kJ·mol-1
消碳反应:CO2(g)+C(s)=2CO(g) ΔH=+172kJ·mol-1
(1)写出 CH4-CO2催化重整反应的热化学方程式
(2)在刚性容器中,当投料比
 时,CO2的平衡转化率(α)与温度(T)、初始压强(p)的关系如图所示。
时,CO2的平衡转化率(α)与温度(T)、初始压强(p)的关系如图所示。
①由图可知,压强p1
②当温度为T3、压强为2MPa时,A点的v正
③起始时向容器中加入1mol CH4和1mol CO2,根据图中点B(T4,0.5),计算该温度时反应的平衡常数Kp=
(3)一定温度下,测得某催化剂上沉积碳的生成速率方程为v=k·p(CH4)·[p(CO2)]-0.5(k为速率常数) (k为速率常数)。
①在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2),pb(CO2),pc(CO2)从大到小的顺序为

②
 ,有助于减少积碳。
,有助于减少积碳。
您最近一年使用:0次
2022-12-09更新
|
92次组卷
|
2卷引用:陕西省咸阳市实验中学2021-2022学年高二上学期第二次月考化学试题



