名校
解题方法
1 . 以CO和 为原料合成甲醇是工业上的成熟方法,直接以
为原料合成甲醇是工业上的成熟方法,直接以 为原料生产甲醇是目前的研究热点。我国科学家用
为原料生产甲醇是目前的研究热点。我国科学家用 人工合成淀粉时,第一步就需要将
人工合成淀粉时,第一步就需要将 转化为甲醇。
转化为甲醇。
已知:①
 kJ·mol
kJ·mol
②
 kJ·mol
kJ·mol
③
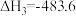 kJ·mol
kJ·mol
下列说法不正确 的是
 为原料合成甲醇是工业上的成熟方法,直接以
为原料合成甲醇是工业上的成熟方法,直接以 为原料生产甲醇是目前的研究热点。我国科学家用
为原料生产甲醇是目前的研究热点。我国科学家用 人工合成淀粉时,第一步就需要将
人工合成淀粉时,第一步就需要将 转化为甲醇。
转化为甲醇。已知:①

 kJ·mol
kJ·mol
②

 kJ·mol
kJ·mol
③

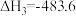 kJ·mol
kJ·mol
下列说法
A.若温度不变,反应①中生成1 mol  时,放出的热量大于90.5 kJ 时,放出的热量大于90.5 kJ |
B. 与 与 合成甲醇的热化学方程式为: 合成甲醇的热化学方程式为:  kJ·mol kJ·mol |
C.通过电解制 和选用高效催化剂,可降低 和选用高效催化剂,可降低 与 与 合成甲醇反应的焓变 合成甲醇反应的焓变 |
D.以 和 和 为原料合成甲醇,同时生成 为原料合成甲醇,同时生成 ,该反应需要吸收能量 ,该反应需要吸收能量 |
您最近一年使用:0次
2022-11-27更新
|
958次组卷
|
7卷引用:天津市静海区第一中学2021-2022学年高三上学期12月调研考试化学试题
天津市静海区第一中学2021-2022学年高三上学期12月调研考试化学试题北京市第二十二中学2021-2022学年高三上学期12月阶段性测试理科化学试题北京市海淀区2021-2022学年高三上学期期中考试化学试题北京市东城区一六六中学2022-2023学年高三上学期期中考试化学试题(已下线)2023年北京卷高考真题变式题(选择题11-14)(已下线)考点17 化学反应的热效应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)化学反应的热效应
名校
解题方法
2 . 回答下列问题:
(1)25℃时,制备亚硝酰氯所涉及的热化学方程式和平衡常数如表:
则该温度下,
_______  ;
;
_______ (用 和
和 表示)。
表示)。
(2)25℃时,在体积为 的恒容密闭容器中通入
的恒容密闭容器中通入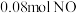 和
和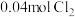 发生上述反应③,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强
发生上述反应③,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强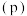 随时间
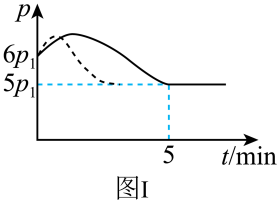
随时间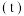 的变化如图Ⅰ实线所示,则
的变化如图Ⅰ实线所示,则
_______ (填“>”“<”或“=”)0;若其他条件相同,仅改变某一条件,测得其压强随时间的变化如图Ⅰ虚线所示,则改变的条件是_______ ;在 时,再充入
时,再充入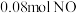 和
和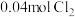 ,则混合气体的平均相对分子质量将
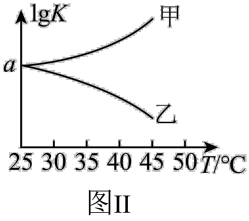
,则混合气体的平均相对分子质量将_______ (填“增大”、“减小”或“不变”)。图Ⅱ是甲、乙两同学描绘上述反应③的平衡常数的对数值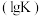 与温度的变化关系图,其中正确的曲线是
与温度的变化关系图,其中正确的曲线是_______ (填“甲”或“乙”),a值为_______ 。25℃时测得反应③在某时刻, 、
、 、
、 的浓度分别为0.7、0.1、0.3,则此时
的浓度分别为0.7、0.1、0.3,则此时
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(3)在300℃、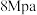 下,将
下,将 和
和 按物质的量之比
按物质的量之比 通入一密闭容器中发生
通入一密闭容器中发生 中反应,达到平衡时,测得
中反应,达到平衡时,测得 的平衡转化率为50%,则该反应条件下的平衡常数为
的平衡转化率为50%,则该反应条件下的平衡常数为
_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(1)25℃时,制备亚硝酰氯所涉及的热化学方程式和平衡常数如表:
| 热化学方程式 | 平衡常数 | |
| ① | 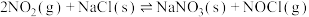  |  |
| ② | 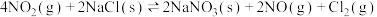 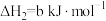 |  |
| ③ |   |  |

 ;
;
 和
和 表示)。
表示)。(2)25℃时,在体积为
 的恒容密闭容器中通入
的恒容密闭容器中通入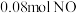 和
和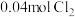 发生上述反应③,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强
发生上述反应③,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强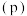 随时间
随时间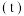 的变化如图Ⅰ实线所示,则
的变化如图Ⅰ实线所示,则
 时,再充入
时,再充入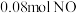 和
和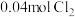 ,则混合气体的平均相对分子质量将
,则混合气体的平均相对分子质量将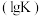 与温度的变化关系图,其中正确的曲线是
与温度的变化关系图,其中正确的曲线是 、
、 、
、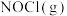 的浓度分别为0.7、0.1、0.3,则此时
的浓度分别为0.7、0.1、0.3,则此时
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。

(3)在300℃、
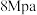 下,将
下,将 和
和 按物质的量之比
按物质的量之比 通入一密闭容器中发生
通入一密闭容器中发生 中反应,达到平衡时,测得
中反应,达到平衡时,测得 的平衡转化率为50%,则该反应条件下的平衡常数为
的平衡转化率为50%,则该反应条件下的平衡常数为
您最近一年使用:0次
2022-11-10更新
|
141次组卷
|
9卷引用:内蒙古赤峰市第四中学分校2021-2022学年高二上学期9月月考化学试题
内蒙古赤峰市第四中学分校2021-2022学年高二上学期9月月考化学试题安徽省皖北名校2020-2021学年高二上学期第一次联考化学试题江西省赣州市南康中学2020-2021学年高二上学期第二次大考化学试题【全国百强校】福建省师范大学附属中学2018-2019学年高二(理)上学期期中考试化学试题【全国百强校】福建省师范大学附属中学2018-2019学年高二(实验班)上学期期中考试化学试题河北省石家庄市第二中学2019-2020学年高一下学期期末考试化学试题河北省邯郸市联盟校2020-2021学年高二上学期期中考试化学试题陕西省汉中市洋县中学2022-2023学年高二上学期期中考试化学试题安徽省滁州市定远县育才学校2021-2022学年高二(实验班)下学期开学摸底考试化学试题
2011·陕西西安·模拟预测
名校
解题方法
3 . 已知:①CO(g)+ O2(g) = CO2(g) ΔH=-283 kJ·mol-1
O2(g) = CO2(g) ΔH=-283 kJ·mol-1
②N2(g)+O2(g) = 2NO(g) ΔH=+180 kJ·mol-1
则反应2CO(g)+2NO(g) = N2(g)+2CO2(g)的ΔH是
 O2(g) = CO2(g) ΔH=-283 kJ·mol-1
O2(g) = CO2(g) ΔH=-283 kJ·mol-1②N2(g)+O2(g) = 2NO(g) ΔH=+180 kJ·mol-1
则反应2CO(g)+2NO(g) = N2(g)+2CO2(g)的ΔH是
| A.-386 kJ·mol-1 | B.+386 kJ·mol-1 | C.-746 kJ·mol-1 | D.+746 kJ·mol-1 |
您最近一年使用:0次
2022-11-04更新
|
52次组卷
|
30卷引用:海南省三亚华侨学校(南新校区)2021-2022学年高二上学期10月月考化学试题
海南省三亚华侨学校(南新校区)2021-2022学年高二上学期10月月考化学试题 山西省太原市第五十六中学2021-2022学年高二上学期10月月考化学试题(已下线)2012届河南省豫南九校高三上学期第一次联考化学试卷(已下线)2011-2012学年江西省会昌中学高二第二次月考化学试卷(已下线)2011-2012学年河北省正定中学高二第一次考试理科化学试卷(已下线)2012-2013学年湖北省监利县柘木中学高二第一次月考化学试卷辽宁省建平第二高级中学2019-2020学年高二上学期9月月考化学试题河北省邢台市第七中学2019-2020学年高二上学期10月月考化学试题新疆吾尔自治区石河子第二中学2020-2021学年高二上学期第一次月考化学试题宁夏贺兰县景博中学2020-2021学年高二上学期第二次月考化学试题甘肃省天水市秦安县第一中学2020-2021学年高二上学期期末考试化学试题辽宁省葫芦岛市第八高级中学2021–2022学年高二上学期期中考试化学试题山西省太原市第五十六中学2022-2023学年高二上学期10月联考化学试题广西南宁市第五十六中学2022-2023学年高二上学期月考化学试题四川省南充市嘉陵第一中学2022-2023学年高二下学期6月月考化学试题(已下线)2011届陕西省西安中学高三第十三次模拟考试(理综)化学试题(已下线)2012届辽宁省辽南协作体高三上学期期中考试化学试卷2015-2016学年福建省连江县尚德中学高二上期中考试化学试卷2015-2016学年新疆兵团农二师华山中学高二下期中化学卷吉林省汪清县第六中学2017-2018学年高二上学期期末考试化学试题【全国校级联考】福建省闽侯第二中学五校教学联合体2017-2018学年高二上学期期末考试化学试题2018-2019学年人教版高二化学选修四章:化学反应与能量末测试题(已下线)《2018-2019学年同步单元双基双测AB卷》第一单元 化学反应与能量单元测试(A卷)内蒙古自治区巴彦淖尔市临河三中2018-2019学年高二上学期期中考试化学试题江西省南昌市进贤一中2019-2020学年高二上学期期末考试化学试题宁夏银川市宁夏大学附属中学2019-2020学年高二下学期期末考试化学试题河北省沧州市盐山中学2020-2021学年高二上学期期中考试化学试题四川广元川师大万达中学2020-2021学年高二上学期期中考试化学试题天津北京师范大学静海附属学校 (天津市静海区北师大实验学校)2023-2024学年高三上学期第二次阶段检测(期中)化学试题(已下线)北京市第四中学2023-22024学年高一下学期期中考试 化学试题
名校
解题方法
4 . 氢气是一种清洁高效的新型能源,如何经济实用的制取氢气成为重要课题。
(1)硫碘循环分解水是一种高效、环保的制氢方法,其流程图如下:
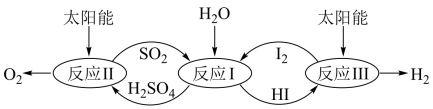
已知:
反应II:H2SO4(aq)=SO2(g)+H2O(l)+ O2(g) ΔH2=+327kJ·mol-1
O2(g) ΔH2=+327kJ·mol-1
反应III:2HI(aq)=H2(g)+I2(g) ΔH3=+172kJ·mol-1
反应:2H2O(l)=2H2(g)+O2(g) ΔH=+572kJ·mol-1
则反应I的热化学方程式为_______ 。
(2)H2S可用于高效制取氢气,发生的反应为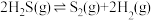

I.若起始时容器中只有H2S,平衡时三种物质的物质的量与裂解温度的关系如图1。
①图中曲线Z表示的物质是_______ (填化学式)。
②C点时H2S的转化率为_______ %(保留一位小数)。
II.若在两个等体积的恒容容器中分别加入2.0molH2S、1.0molH2S,测得不同温度下H2S的平衡转化率如图2所示。
①M点、O点和N点的逆反应速率v(M)、v(O)和v(N)的大小从大到小排列_______
②M、N两点容器内的压强2p(M)_______ p(N)(填>或<或=),平衡常数K(M)、K(N)、K(O)三者的大小从小到大排列:_______ 。
(1)硫碘循环分解水是一种高效、环保的制氢方法,其流程图如下:

已知:
反应II:H2SO4(aq)=SO2(g)+H2O(l)+
 O2(g) ΔH2=+327kJ·mol-1
O2(g) ΔH2=+327kJ·mol-1反应III:2HI(aq)=H2(g)+I2(g) ΔH3=+172kJ·mol-1
反应:2H2O(l)=2H2(g)+O2(g) ΔH=+572kJ·mol-1
则反应I的热化学方程式为
(2)H2S可用于高效制取氢气,发生的反应为
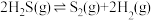

I.若起始时容器中只有H2S,平衡时三种物质的物质的量与裂解温度的关系如图1。
①图中曲线Z表示的物质是
②C点时H2S的转化率为
II.若在两个等体积的恒容容器中分别加入2.0molH2S、1.0molH2S,测得不同温度下H2S的平衡转化率如图2所示。
①M点、O点和N点的逆反应速率v(M)、v(O)和v(N)的大小从大到小排列
②M、N两点容器内的压强2p(M)
您最近一年使用:0次
2022-11-03更新
|
122次组卷
|
3卷引用:河南省南乐县第一高级中学2021-2022学年高二上学期9月半月考化学试题
名校
解题方法
5 . 雾霾天气是一种大气污染状态,雾霾的源头多种多样,比如汽车尾气、工业排放、建筑扬尘、垃圾焚烧,甚至火山喷发等。
(1)汽车尾气中的NO(g)和CO(g)在一定温度和催化剂的条件下可净化。
①已知部分化学键的键能如下
请完成汽车尾气净化中NO(g)和CO(g)发生反应的热化学方程式 △H =
△H = _______ kJ·mol-1
②若上述反应在恒温、恒容的密闭体系中进行,并在t1时刻达到平衡状态,则下列示意图符合题意的是_______ (填选项序号)。(下图中V正、n、P总分别表示正反应速率、物质的量和总压强)

(2)在t1℃下,向体积为10 L的恒容密闭容器中通入NO和CO,测得不同时间NO和CO的物质的量如下表:
既能增大反应速率又能使平衡正向移动的措施是_______ 。(写出一种即可)
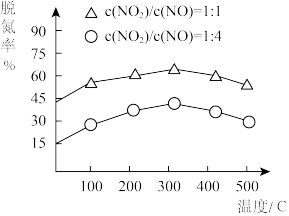
(3)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。在氨气足量的情况下,不同c(NO2)/C(NO)、不同温度对脱氮率的影响如图所示(已知氨气催化还原氮氧化物的正反应为放热反应),请回答温度对脱氮率的影响_______ ,给出合理的解释:_______ 。
(1)汽车尾气中的NO(g)和CO(g)在一定温度和催化剂的条件下可净化。
①已知部分化学键的键能如下
| 分子式/结构式 | NO/N≡O | CO/C≡O | CO2/O=C=O | N2/N≡N |
| 化学键 | N≡O | C≡O | C=O | N≡N |
| 键能( kJ/mol) | 632 | 1072 | 750 | 946 |
 △H =
△H = ②若上述反应在恒温、恒容的密闭体系中进行,并在t1时刻达到平衡状态,则下列示意图符合题意的是

(2)在t1℃下,向体积为10 L的恒容密闭容器中通入NO和CO,测得不同时间NO和CO的物质的量如下表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/×10-2mol | 10.0 | 4.50 | 2 50 50 | 1.50 | 1.00 | 1.00 |
| n(CO)/×10-1 mol | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
(3)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。在氨气足量的情况下,不同c(NO2)/C(NO)、不同温度对脱氮率的影响如图所示(已知氨气催化还原氮氧化物的正反应为放热反应),请回答温度对脱氮率的影响

您最近一年使用:0次
2022-11-03更新
|
62次组卷
|
2卷引用:河南省南乐县第一高级中学2021-2022学年高二上学期9月半月考化学试题
名校
解题方法
6 . 用CO与H2反应合成甲醇符合原子经济的绿色化学理念,反应过程中能量变化如图所示。
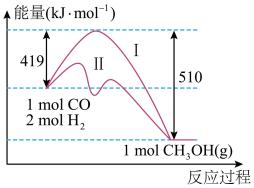
(1)请写出CO与H2反应合成甲醇的热化学方程式_______ ;
(2)该反应中相关的化学键键能数据如表所示:则C≡O中的键能为_______ kJ/mol;
(3)图中曲线I和II所对应的反应路径,比较容易发生的是_______ (填I或II);
(4)已知:①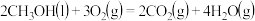
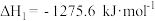 ,
,
②
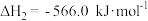 ,
,
③
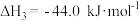 ,
,
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:_______ 。
(5)一定条件下,1 g甲醇蒸气完全燃烧生成二氧化碳和液态水,放出Q kJ的热量。则表示甲醇燃烧热的热化学方程式为_______ 。

(1)请写出CO与H2反应合成甲醇的热化学方程式
(2)该反应中相关的化学键键能数据如表所示:则C≡O中的键能为
| 化学键 | H-H | C-O | H-O | C-H |
| E/(kJ/mol) | 436 | 343 | 465 | 413 |
(3)图中曲线I和II所对应的反应路径,比较容易发生的是
(4)已知:①
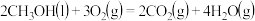
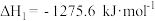 ,
,②

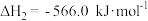 ,
,③

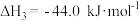 ,
,写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(5)一定条件下,1 g甲醇蒸气完全燃烧生成二氧化碳和液态水,放出Q kJ的热量。则表示甲醇燃烧热的热化学方程式为
您最近一年使用:0次
名校
7 .
(1)铁及其化合物在生产生活中应用最广泛,炼铁技术和含铁新材料的应用倍受关注。利用铁的氧化物循环裂解水制氢气的过程如下图所示。整个过程与温度密切相关,当温度低于570℃时,反应Fe3O4(s)+4CO(g) 3Fe(s)+4CO2(g),阻碍循环反应的进行。
3Fe(s)+4CO2(g),阻碍循环反应的进行。
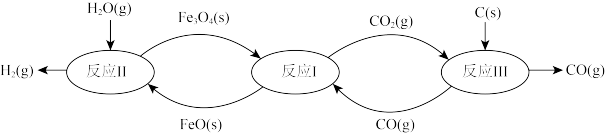
已知:i. Fe3O4(s)+CO(g) 3FeO(s)+CO2(g) △H1=+19.3 kJ·mol-1
3FeO(s)+CO2(g) △H1=+19.3 kJ·mol-1
ii. 3FeO(s)+H2O(g) Fe3O4(s)+H2(g) △H2=-57.2 kJ·mol-1
Fe3O4(s)+H2(g) △H2=-57.2 kJ·mol-1
iii. C(s)+CO2(g) 2CO(g) △H3=+172.4 kJ·mol-1
2CO(g) △H3=+172.4 kJ·mol-1
铁氧化物循环裂解水制氢气总反应的热化学方程式是_______________ 。
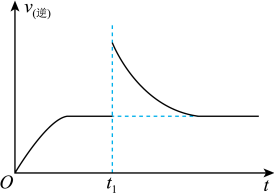
(2)T1℃时,向某恒温密闭容器中加入一定量的Fe2O3和炭粉,发生反应Fe2O3(s)+3C(s) 2Fe(s)+3CO(g),反应达到平衡后,在t1时刻,改变某条件,v(逆)随时间(t)的变化关系如图所示,则t1时刻改变的条件可能是______(填写字母)。
2Fe(s)+3CO(g),反应达到平衡后,在t1时刻,改变某条件,v(逆)随时间(t)的变化关系如图所示,则t1时刻改变的条件可能是______(填写字母)。
(3)在一定温度下,向某体积可变的恒压密闭容器(p总)加入1molCO2与足量的碳,发生反应,平衡时体系中气体体积分数与温度的关系如图所示:
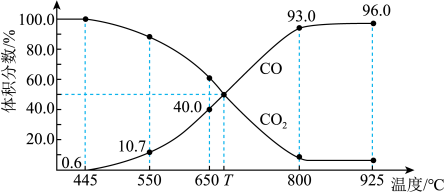
①650℃时,该反应达平衡后吸收的热量是___________________________________________ 。
②T℃时,若向平衡体系中再充入一定量按V(CO2)︰V(CO)=5︰4的混合气体,平衡________________ (填“正向”、“逆向”或“不”)移动。
③925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp计算表达式为________________ 。[气体分压(p分)=气体总压(p总)×体积分数,用某物质的平衡分压代替物质的量浓度也可以表示化学平衡常数,记作Kp]
(4)用原电池原理可以除去酸性废水中的三氯乙烯、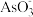 ,其原理如图所示(导电壳内部为纳米零价铁) 在除污过程中,纳米零价铁中的Fe为原电池的负极,写出C2HCl3在其表面转化为乙烷的电极反应式为
,其原理如图所示(导电壳内部为纳米零价铁) 在除污过程中,纳米零价铁中的Fe为原电池的负极,写出C2HCl3在其表面转化为乙烷的电极反应式为______________________ 。

(1)铁及其化合物在生产生活中应用最广泛,炼铁技术和含铁新材料的应用倍受关注。利用铁的氧化物循环裂解水制氢气的过程如下图所示。整个过程与温度密切相关,当温度低于570℃时,反应Fe3O4(s)+4CO(g)
 3Fe(s)+4CO2(g),阻碍循环反应的进行。
3Fe(s)+4CO2(g),阻碍循环反应的进行。 
已知:i. Fe3O4(s)+CO(g)
 3FeO(s)+CO2(g) △H1=+19.3 kJ·mol-1
3FeO(s)+CO2(g) △H1=+19.3 kJ·mol-1ii. 3FeO(s)+H2O(g)
 Fe3O4(s)+H2(g) △H2=-57.2 kJ·mol-1
Fe3O4(s)+H2(g) △H2=-57.2 kJ·mol-1iii. C(s)+CO2(g)
 2CO(g) △H3=+172.4 kJ·mol-1
2CO(g) △H3=+172.4 kJ·mol-1铁氧化物循环裂解水制氢气总反应的热化学方程式是
(2)T1℃时,向某恒温密闭容器中加入一定量的Fe2O3和炭粉,发生反应Fe2O3(s)+3C(s)
 2Fe(s)+3CO(g),反应达到平衡后,在t1时刻,改变某条件,v(逆)随时间(t)的变化关系如图所示,则t1时刻改变的条件可能是______(填写字母)。
2Fe(s)+3CO(g),反应达到平衡后,在t1时刻,改变某条件,v(逆)随时间(t)的变化关系如图所示,则t1时刻改变的条件可能是______(填写字母)。
| A.保持温度不变,压缩容器 | B.保持体积不变,升高温度 |
| C.保持体积不变,加少量碳粉 | D.保持体积不变,增大CO浓度 |

①650℃时,该反应达平衡后吸收的热量是
②T℃时,若向平衡体系中再充入一定量按V(CO2)︰V(CO)=5︰4的混合气体,平衡
③925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp计算表达式为
(4)用原电池原理可以除去酸性废水中的三氯乙烯、
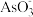 ,其原理如图所示(导电壳内部为纳米零价铁) 在除污过程中,纳米零价铁中的Fe为原电池的负极,写出C2HCl3在其表面转化为乙烷的电极反应式为
,其原理如图所示(导电壳内部为纳米零价铁) 在除污过程中,纳米零价铁中的Fe为原电池的负极,写出C2HCl3在其表面转化为乙烷的电极反应式为
您最近一年使用:0次
名校
8 . 液氨作为一种潜在的汽车燃料已受到人们的普遍重视。它在安全性、价格等方面比化石燃料和氢燃料有着较大的优势,氨的燃烧实验涉及下列两个反应:
①4NH3(g)+5O2(g)=4NO(g)+6H2O(l) △H1
②4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H2
(1)反应4NH3(g)+3O2(g)=2N2(g)+6H2O(l)的△H=_______ (用含有△H1、△H2的式子表示)。
(2)若NH3(g)⇌ N2(g)+
N2(g)+ H2(g) K=A,则N2(g)+3H2(g) ⇌ 2NH3(g) K′=
H2(g) K=A,则N2(g)+3H2(g) ⇌ 2NH3(g) K′=____ (用A表示)。
(3)一定温度下,在恒容密闭容器中按照n(NH3)∶n(NO)=1∶3充入反应物,发生反应4NH3(g)+6NO(g)=5N2(g)+6H2O(l)。下列不能判断该反应达到平衡状态的是_______ 。
A.混合气体的平均摩尔质量保持不变
B.容器内物质的总质量保持不变
C. c(H2O)保持不变
D. n(NH3)∶n(NO)保持不变
E.有1molN-H键断裂的同时,有1molO-H键断裂
(4)向容积为3L的恒容密闭容器中投入4.0molN2和9.0molH2,在一定条件下发生反应N2(g)+3H2(g)⇌2NH3(g),仅改变温度测得平衡时的数据如表所示:
已知:断裂1.0molN2(g)和3.0molH2(g)中的化学键消耗的总能量小于断裂2.0molNH3(g)中的化学键消耗的能量。
①则T1_______ T2(填“>”“<”或“=”)。
②在T2 K下,经过10min达到化学平衡状态,则0~10min内,H2的平均反应速率v(H2)=_______ mol/(L·min),平衡时N2的转化率α(N2)=_______ 。
①4NH3(g)+5O2(g)=4NO(g)+6H2O(l) △H1
②4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H2
(1)反应4NH3(g)+3O2(g)=2N2(g)+6H2O(l)的△H=
(2)若NH3(g)⇌
 N2(g)+
N2(g)+ H2(g) K=A,则N2(g)+3H2(g) ⇌ 2NH3(g) K′=
H2(g) K=A,则N2(g)+3H2(g) ⇌ 2NH3(g) K′=(3)一定温度下,在恒容密闭容器中按照n(NH3)∶n(NO)=1∶3充入反应物,发生反应4NH3(g)+6NO(g)=5N2(g)+6H2O(l)。下列不能判断该反应达到平衡状态的是
A.混合气体的平均摩尔质量保持不变
B.容器内物质的总质量保持不变
C. c(H2O)保持不变
D. n(NH3)∶n(NO)保持不变
E.有1molN-H键断裂的同时,有1molO-H键断裂
(4)向容积为3L的恒容密闭容器中投入4.0molN2和9.0molH2,在一定条件下发生反应N2(g)+3H2(g)⇌2NH3(g),仅改变温度测得平衡时的数据如表所示:
| 温度/K | 平衡时NH3的物质的量/mol |
| T1 | 2.4 |
| T2 | 2.0 |
①则T1
②在T2 K下,经过10min达到化学平衡状态,则0~10min内,H2的平均反应速率v(H2)=
您最近一年使用:0次
9 . 回答下列问题
(1) 和
和 混合可作火箭推进剂,已知:
混合可作火箭推进剂,已知: 液态
液态 和足量氧气反应生成
和足量氧气反应生成 和
和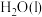 放出
放出 的热量;
的热量;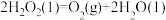
 ,则液态
,则液态 和液态
和液态 反应生成
反应生成 和
和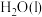 的热化学方程式为
的热化学方程式为_______ 。
(2)工业上可用 来生产燃料甲醇。在容积为
来生产燃料甲醇。在容积为 的密闭容器中充入
的密闭容器中充入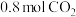 和
和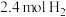 ,在500℃下发生反应
,在500℃下发生反应 ,实验测得
,实验测得 和
和 的物质的量(
的物质的量( )随时间变化如图所示:
)随时间变化如图所示:

①从反应开始到平衡,氢气的平均反应速率v(H2)=_______ 。
②500℃条件下,另一容器中测得某时刻, 、
、 、
、 和
和 的浓度均为
的浓度均为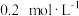 ,则此时v(正)
,则此时v(正)_______ (填“>”、“<”或“=”)v(逆)。
③下列不能表示反应达到平衡状态的是_______ 。
A.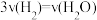
B.混合气体的平均分子质量不再改变
C.单位时间内生成3molH—H键,同时生成3molH—O键
D.混合气体的密度不再改变
(3)如图所示, 形管内盛有
形管内盛有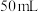 滴有酚酞的足量
滴有酚酞的足量 溶液,打开
溶液,打开 ,闭合
,闭合 ,则:
,则:

①A极附近可观察到的现象是_______ 。
②反应一段时间后打开 ,若忽略溶液的体积变化和气体的溶解,整个反应产生气体的体积(标准状况)为
,若忽略溶液的体积变化和气体的溶解,整个反应产生气体的体积(标准状况)为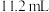 ,将溶液充分混合,则溶液在常温下的pH约为
,将溶液充分混合,则溶液在常温下的pH约为_______ ;若要使电解质溶液恢复到原状态,需向 形管内加入或通入一定量的
形管内加入或通入一定量的_______ 。
(1)
 和
和 混合可作火箭推进剂,已知:
混合可作火箭推进剂,已知: 液态
液态 和足量氧气反应生成
和足量氧气反应生成 和
和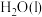 放出
放出 的热量;
的热量;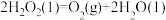
 ,则液态
,则液态 和液态
和液态 反应生成
反应生成 和
和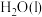 的热化学方程式为
的热化学方程式为(2)工业上可用
 来生产燃料甲醇。在容积为
来生产燃料甲醇。在容积为 的密闭容器中充入
的密闭容器中充入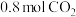 和
和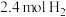 ,在500℃下发生反应
,在500℃下发生反应 ,实验测得
,实验测得 和
和 的物质的量(
的物质的量( )随时间变化如图所示:
)随时间变化如图所示:
①从反应开始到平衡,氢气的平均反应速率v(H2)=
②500℃条件下,另一容器中测得某时刻,
 、
、 、
、 和
和 的浓度均为
的浓度均为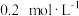 ,则此时v(正)
,则此时v(正)③下列不能表示反应达到平衡状态的是
A.
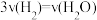
B.混合气体的平均分子质量不再改变
C.单位时间内生成3molH—H键,同时生成3molH—O键
D.混合气体的密度不再改变
(3)如图所示,
 形管内盛有
形管内盛有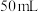 滴有酚酞的足量
滴有酚酞的足量 溶液,打开
溶液,打开 ,闭合
,闭合 ,则:
,则:
①A极附近可观察到的现象是
②反应一段时间后打开
 ,若忽略溶液的体积变化和气体的溶解,整个反应产生气体的体积(标准状况)为
,若忽略溶液的体积变化和气体的溶解,整个反应产生气体的体积(标准状况)为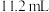 ,将溶液充分混合,则溶液在常温下的pH约为
,将溶液充分混合,则溶液在常温下的pH约为 形管内加入或通入一定量的
形管内加入或通入一定量的
您最近一年使用:0次
2022-10-31更新
|
29次组卷
|
3卷引用:湖南省部分校2021-2022学年高二上学期12月联考化学试题
名校
解题方法
10 . 已知下列两个热化学方程式:H2(g)+1/2O2(g)=H2O(l) △H=-285.8kJ/mol,C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) △H=-2220.0kJ/mol。
(1)H2的燃烧热为_______ ,C3H8的燃烧热为_______ 。
(2)实验测得H2和C3H8的混合气体共5mol,完全燃烧生成液态的水时放热6264.5kJ,则混合气体中H2和C3H8的体积比是_______ 。
(3)1molH2和2molC3H8组成的混合气体完全燃烧释放的热量为:_______ 。
(4)已知H2O(l)=H2O(g) △H=+44kJ/mol。写出丙烷燃烧生成CO2和气态水的热化学方程式:_______ 。
(1)H2的燃烧热为
(2)实验测得H2和C3H8的混合气体共5mol,完全燃烧生成液态的水时放热6264.5kJ,则混合气体中H2和C3H8的体积比是
(3)1molH2和2molC3H8组成的混合气体完全燃烧释放的热量为:
(4)已知H2O(l)=H2O(g) △H=+44kJ/mol。写出丙烷燃烧生成CO2和气态水的热化学方程式:
您最近一年使用:0次



