1 . 下列说法正确的是
已知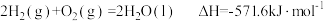
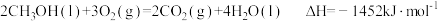
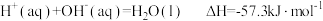
已知
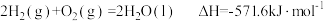
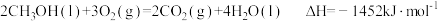
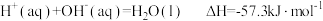
| A.H2(g)的燃烧热ΔH=-571.6kJ•mol-1 |
B.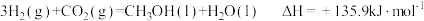 |
C.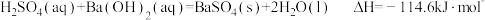 |
| D.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多 |
您最近一年使用:0次
2023-10-05更新
|
63次组卷
|
2卷引用:江苏省常州市前黄高级中学2022-2023学年高二上学期第二次阶段考试化学试题
解题方法
2 . 含N元素的部分物质对环境有影响。含NO、 的废气会引起空气污染,含
的废气会引起空气污染,含 、
、 、
、 的废水会引起水体富营养化,都需要经过处理后才能排放。
的废水会引起水体富营养化,都需要经过处理后才能排放。
(1)氢气催化还原含NO烟气:
主反应: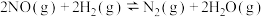
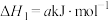
副反应: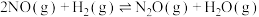

①已知NO也能与 反应生成
反应生成 ,写出该反应的热化学方程式
,写出该反应的热化学方程式___________ 。
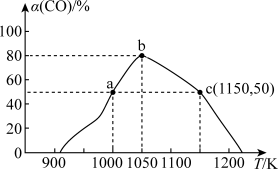
②某温度下 的体积分数对
的体积分数对 还原NO反应的影响如图1所示。当
还原NO反应的影响如图1所示。当 的体积分数大于
的体积分数大于 时,
时, 的体积分数呈下降趋势,原因是
的体积分数呈下降趋势,原因是___________ 。
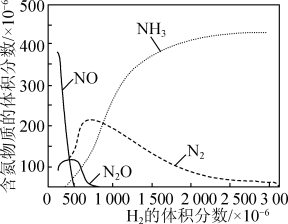
图1
(2)工业上用电解法治理亚硝酸盐对水体的污染,模拟工艺如图2所示,写出电解时铁电极的电极反应式___________ 。随后,铁电极附近有无色气体产生,写出有关反应的离子方程式___________ 。
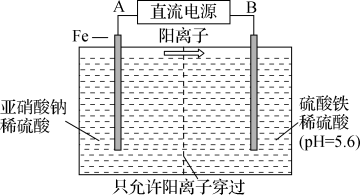
图2
(3)工业上以钛基氧化物涂层材料为阳极,碳纳米管修饰的石墨为阴极,电解硝酸钠和硫酸钠混合溶液,可使 转变为
转变为 ,后续再将
,后续再将 反应除去。已知:电极(电催化剂)所处的环境对其催化活性起重要作用。
反应除去。已知:电极(电催化剂)所处的环境对其催化活性起重要作用。
①若在酸性介质中电解混合溶液,将 转变为
转变为 的电极反应式为
的电极反应式为___________ ;其他条件不变,只改变混合溶液的pH, 去除率如图3所示,pH越小,
去除率如图3所示,pH越小, 去除率上升可能原因是
去除率上升可能原因是___________ 。
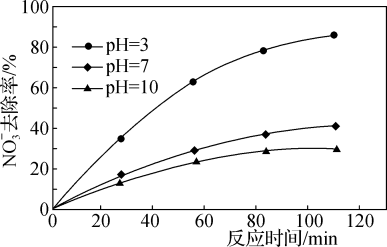
图3
②其他条件不变,只向混合溶液中投入一定量 ,后续去除
,后续去除 的效果明显提高,溶液中氮元素含量显著降低。可能原因是
的效果明显提高,溶液中氮元素含量显著降低。可能原因是___________ 。
 的废气会引起空气污染,含
的废气会引起空气污染,含 、
、 、
、 的废水会引起水体富营养化,都需要经过处理后才能排放。
的废水会引起水体富营养化,都需要经过处理后才能排放。(1)氢气催化还原含NO烟气:
主反应:
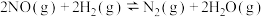
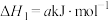
副反应:
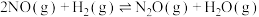

①已知NO也能与
 反应生成
反应生成 ,写出该反应的热化学方程式
,写出该反应的热化学方程式②某温度下
 的体积分数对
的体积分数对 还原NO反应的影响如图1所示。当
还原NO反应的影响如图1所示。当 的体积分数大于
的体积分数大于 时,
时, 的体积分数呈下降趋势,原因是
的体积分数呈下降趋势,原因是
图1
(2)工业上用电解法治理亚硝酸盐对水体的污染,模拟工艺如图2所示,写出电解时铁电极的电极反应式

图2
(3)工业上以钛基氧化物涂层材料为阳极,碳纳米管修饰的石墨为阴极,电解硝酸钠和硫酸钠混合溶液,可使
 转变为
转变为 ,后续再将
,后续再将 反应除去。已知:电极(电催化剂)所处的环境对其催化活性起重要作用。
反应除去。已知:电极(电催化剂)所处的环境对其催化活性起重要作用。①若在酸性介质中电解混合溶液,将
 转变为
转变为 的电极反应式为
的电极反应式为 去除率如图3所示,pH越小,
去除率如图3所示,pH越小, 去除率上升可能原因是
去除率上升可能原因是
图3
②其他条件不变,只向混合溶液中投入一定量
 ,后续去除
,后续去除 的效果明显提高,溶液中氮元素含量显著降低。可能原因是
的效果明显提高,溶液中氮元素含量显著降低。可能原因是
您最近一年使用:0次
2023-07-23更新
|
159次组卷
|
2卷引用:江苏省扬州市高邮市2022-2023学年高二上学期10月月考化学试题
解题方法
3 .  催化加氢合成二甲醚是一种
催化加氢合成二甲醚是一种 转化方法,其过程中主要发生下列反应:
转化方法,其过程中主要发生下列反应:
反应Ⅰ:
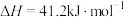
反应Ⅱ:
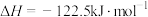
在恒压、 和
和 的起始量一定的条件下,
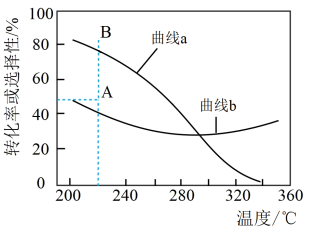
的起始量一定的条件下, 平衡转化率和平衡时
平衡转化率和平衡时 的选择性随温度的变化如图所示。(已知:
的选择性随温度的变化如图所示。(已知: 的选择性
的选择性 ),下列说法正确的是
),下列说法正确的是
 催化加氢合成二甲醚是一种
催化加氢合成二甲醚是一种 转化方法,其过程中主要发生下列反应:
转化方法,其过程中主要发生下列反应:反应Ⅰ:

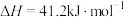
反应Ⅱ:

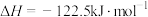
在恒压、
 和
和 的起始量一定的条件下,
的起始量一定的条件下, 平衡转化率和平衡时
平衡转化率和平衡时 的选择性随温度的变化如图所示。(已知:
的选择性随温度的变化如图所示。(已知: 的选择性
的选择性 ),下列说法正确的是
),下列说法正确的是
A.曲线a代表 平衡转化率 平衡转化率 |
B.为提高 选择性需研发高温条件下对反应Ⅱ催化活性更高的催化剂 选择性需研发高温条件下对反应Ⅱ催化活性更高的催化剂 |
| C.200~360℃范围内,体系中主要发生反应Ⅱ |
D.反应一段时间后,在220℃测得 的选择性48%(图中A点),增大压强可能将 的选择性48%(图中A点),增大压强可能将 的选择性提升到B点 的选择性提升到B点 |
您最近一年使用:0次
4 . 下列说法正确的是
A.已知  , ,  ; ; , , |
B.已知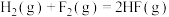 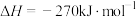 ,则 ,则 氢气与 氢气与 氟气反应生成 氟气反应生成 液态氟化氢时放热大于 液态氟化氢时放热大于 |
C.已知  ,则 ,则 燃烧热为 燃烧热为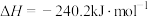 |
D.已知中和热可表示为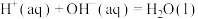  ,则 ,则 与 与 完全反应放出的热量为 完全反应放出的热量为 |
您最近一年使用:0次
名校
5 . 气态含氮化合物是把双刃剑,既是固氮的主要途径,也是大气污染物。气态含氮化合物及相关反应是新型科研热点。回答下列问题:
(1)还原法:①用 催化还原
催化还原 可以消除氮氧化物的污染。已知:
可以消除氮氧化物的污染。已知:
ⅰ:
ⅱ:
写出 还原
还原 至
至 和水蒸气的热化学方程式
和水蒸气的热化学方程式_______ 。
②尿素水溶液热解产生的 可去除尾气中的
可去除尾气中的 ,流程如下:
,流程如下:

a.尿素 中氮元素的化合价为
中氮元素的化合价为_______ 。
b.若氧化处理后的尾气中混有 ,此时催化剂表面会因为覆盖部分硫酸盐而导致催化剂中毒,降低
,此时催化剂表面会因为覆盖部分硫酸盐而导致催化剂中毒,降低 的去除率。试分析硫酸盐的产生过程
的去除率。试分析硫酸盐的产生过程_______ 。
③某脱硝反应机理如图-1所示, 参与Ⅰ的反应方程式为
参与Ⅰ的反应方程式为_______ 。

(2)氧化法: 氧化性强于
氧化性强于 ,能更有效地氧化
,能更有效地氧化 。
。
Ⅰ:
Ⅱ: (活化能
(活化能 )
)
Ⅲ: (活化能
(活化能 )
)
 可经
可经 处理后再用碱液吸收而实现脱除。为分析氧化时温度对
处理后再用碱液吸收而实现脱除。为分析氧化时温度对 脱除率的影响,将
脱除率的影响,将 与
与 混合反应一段时间,再用碱液吸收氧化后的气体。其他条件相同时,脱除率随
混合反应一段时间,再用碱液吸收氧化后的气体。其他条件相同时,脱除率随 与
与 混合反应温度变化如图-2所示。试分析在
混合反应温度变化如图-2所示。试分析在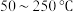 范围内,随着温度的升高
范围内,随着温度的升高 脱除率先几乎不变后下降的可能原因是
脱除率先几乎不变后下降的可能原因是_______ 。

(3)研究表明氮氧化物的脱除率除了与还原剂、氧化剂、催化剂相关外,还取决于催化剂表面氧缺位的密集程度。以 (A、B均为过渡元素)为催化剂,用
(A、B均为过渡元素)为催化剂,用 还原
还原 的机理如下:
的机理如下:
第一阶段: (不稳定)
(不稳定) 低价态的金属离子(还原前后催化剂中金属原子的个数不变)
低价态的金属离子(还原前后催化剂中金属原子的个数不变)
第二阶段:Ⅰ.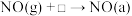 Ⅱ.
Ⅱ.
Ⅲ. Ⅳ.
Ⅳ.
Ⅴ.
注:表示催化剂表面的氧缺位,g表示气态,a表示吸附态
第一阶段用氢气还原 得到低价态的金属离子越多,第二阶段反应的速率越快,原因是
得到低价态的金属离子越多,第二阶段反应的速率越快,原因是_______ 。
(1)还原法:①用
 催化还原
催化还原 可以消除氮氧化物的污染。已知:
可以消除氮氧化物的污染。已知:ⅰ:

ⅱ:

写出
 还原
还原 至
至 和水蒸气的热化学方程式
和水蒸气的热化学方程式②尿素水溶液热解产生的
 可去除尾气中的
可去除尾气中的 ,流程如下:
,流程如下:
a.尿素
 中氮元素的化合价为
中氮元素的化合价为b.若氧化处理后的尾气中混有
 ,此时催化剂表面会因为覆盖部分硫酸盐而导致催化剂中毒,降低
,此时催化剂表面会因为覆盖部分硫酸盐而导致催化剂中毒,降低 的去除率。试分析硫酸盐的产生过程
的去除率。试分析硫酸盐的产生过程③某脱硝反应机理如图-1所示,
 参与Ⅰ的反应方程式为
参与Ⅰ的反应方程式为
(2)氧化法:
 氧化性强于
氧化性强于 ,能更有效地氧化
,能更有效地氧化 。
。Ⅰ:

Ⅱ:
 (活化能
(活化能 )
)Ⅲ:
 (活化能
(活化能 )
) 可经
可经 处理后再用碱液吸收而实现脱除。为分析氧化时温度对
处理后再用碱液吸收而实现脱除。为分析氧化时温度对 脱除率的影响,将
脱除率的影响,将 与
与 混合反应一段时间,再用碱液吸收氧化后的气体。其他条件相同时,脱除率随
混合反应一段时间,再用碱液吸收氧化后的气体。其他条件相同时,脱除率随 与
与 混合反应温度变化如图-2所示。试分析在
混合反应温度变化如图-2所示。试分析在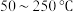 范围内,随着温度的升高
范围内,随着温度的升高 脱除率先几乎不变后下降的可能原因是
脱除率先几乎不变后下降的可能原因是
(3)研究表明氮氧化物的脱除率除了与还原剂、氧化剂、催化剂相关外,还取决于催化剂表面氧缺位的密集程度。以
 (A、B均为过渡元素)为催化剂,用
(A、B均为过渡元素)为催化剂,用 还原
还原 的机理如下:
的机理如下:第一阶段:
 (不稳定)
(不稳定) 低价态的金属离子(还原前后催化剂中金属原子的个数不变)
低价态的金属离子(还原前后催化剂中金属原子的个数不变)第二阶段:Ⅰ.
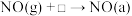 Ⅱ.
Ⅱ.
Ⅲ.
 Ⅳ.
Ⅳ.
Ⅴ.

注:表示催化剂表面的氧缺位,g表示气态,a表示吸附态
第一阶段用氢气还原
 得到低价态的金属离子越多,第二阶段反应的速率越快,原因是
得到低价态的金属离子越多,第二阶段反应的速率越快,原因是
您最近一年使用:0次
2022-12-17更新
|
562次组卷
|
3卷引用:江苏省南京师范大学附属中学、天一中学、海安中学、海门中学2022-2023学年高三上学期12月联考化学试题
解题方法
6 . 黄铁矿(主要成分 )的利用对资源和环境具有重要意义。
)的利用对资源和环境具有重要意义。
(1)空气氧化。Stumm和Morgan提出黄铁矿在空气中氧化的三步反应如图所示。

① 基态核外电子排布式为
基态核外电子排布式为_______ 。
②向黄铁矿与水形成的悬浊液中通入空气,测得 浓度的增加先慢后快,其原因结合机理可描述为
浓度的增加先慢后快,其原因结合机理可描述为_______ 。
(2)燃煤脱硫。原理:利用羟基自由基(·OH,氧元素为 价)将燃煤中的含硫物质(主要是
价)将燃煤中的含硫物质(主要是 )氧化除去,其装置示意图如图所示。
)氧化除去,其装置示意图如图所示。

①利用羟基自由基除去煤中 反应的离子方程式:
反应的离子方程式:_______ 。
②测得一定时间内随溶液起始pH的改变脱硫率(溶于水中的硫元素质量占燃煤中硫元素总质量的百分比)的变化如图所示。当pH大于1.5后脱硫率下降的可能原因:_______ 。

(3)尾气处理。工业上常用黄铁矿为原料接触法制硫酸。为减少尾气 的排放,工业上常将
的排放,工业上常将 转化为
转化为 固定,但存在CO又会同时发生以下两个反应:
固定,但存在CO又会同时发生以下两个反应:
①反应: 的
的
_______  。
。
②恒容、恒温条件下,反应体系中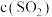 随时间t变化的总趋势如图所示。结合已知信息分析
随时间t变化的总趋势如图所示。结合已知信息分析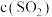 随时间t变化的原因
随时间t变化的原因_______ 。

 )的利用对资源和环境具有重要意义。
)的利用对资源和环境具有重要意义。(1)空气氧化。Stumm和Morgan提出黄铁矿在空气中氧化的三步反应如图所示。

①
 基态核外电子排布式为
基态核外电子排布式为②向黄铁矿与水形成的悬浊液中通入空气,测得
 浓度的增加先慢后快,其原因结合机理可描述为
浓度的增加先慢后快,其原因结合机理可描述为(2)燃煤脱硫。原理:利用羟基自由基(·OH,氧元素为
 价)将燃煤中的含硫物质(主要是
价)将燃煤中的含硫物质(主要是 )氧化除去,其装置示意图如图所示。
)氧化除去,其装置示意图如图所示。
①利用羟基自由基除去煤中
 反应的离子方程式:
反应的离子方程式:②测得一定时间内随溶液起始pH的改变脱硫率(溶于水中的硫元素质量占燃煤中硫元素总质量的百分比)的变化如图所示。当pH大于1.5后脱硫率下降的可能原因:

(3)尾气处理。工业上常用黄铁矿为原料接触法制硫酸。为减少尾气
 的排放,工业上常将
的排放,工业上常将 转化为
转化为 固定,但存在CO又会同时发生以下两个反应:
固定,但存在CO又会同时发生以下两个反应:| 序号 | 反应 | 活化能 | 平衡常数 |
| 1 |  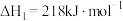 |  |  |
| 2 | 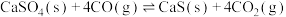 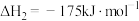 | 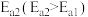 | 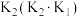 |
 的
的
 。
。②恒容、恒温条件下,反应体系中
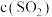 随时间t变化的总趋势如图所示。结合已知信息分析
随时间t变化的总趋势如图所示。结合已知信息分析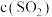 随时间t变化的原因
随时间t变化的原因
您最近一年使用:0次
解题方法
7 . 二甲醚催化还原法可用于治理空气中的NOx。
(1)工业利用CO2加氢制二甲醚的反应体系中,主要发生反应的热化学方程式为
反应Ⅰ: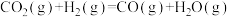
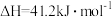
反应Ⅱ: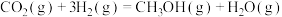
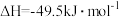
反应Ⅲ: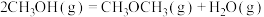
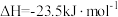
在2 MPa,起始投料 时,CO2的平衡转化率及CH3OCH3和CH3OH的平衡体积分数随温度变化如图-1所示。
时,CO2的平衡转化率及CH3OCH3和CH3OH的平衡体积分数随温度变化如图-1所示。

①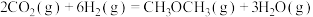 △H=
△H=_______
②从453-553℃,升高温度CO2平衡转化率降低的原因是_______ 。
③为提高单位时间内CH3OCH3产率。研发的催化剂需具备的特点是_______ 。
(2)在催化剂作用下,二甲醚还原NO的反应原理为 △H<0。在有氧和无氧的环境下,NO的去除率随温度变化如图-2所示。
△H<0。在有氧和无氧的环境下,NO的去除率随温度变化如图-2所示。
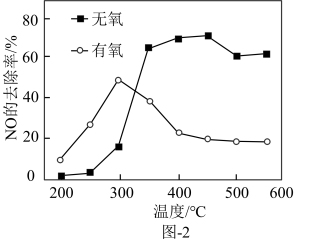
①无氧环境下,在250~450℃范围内随着温度的升高,NO的去除率先迅速上升后上升缓慢的主要原因是_______ 。
②温度高于400℃时,NO去除率明显低于无氧环境的可能原因有_______ 。
(1)工业利用CO2加氢制二甲醚的反应体系中,主要发生反应的热化学方程式为
反应Ⅰ:
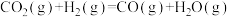
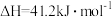
反应Ⅱ:
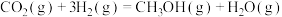
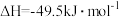
反应Ⅲ:
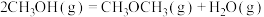
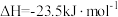
在2 MPa,起始投料
 时,CO2的平衡转化率及CH3OCH3和CH3OH的平衡体积分数随温度变化如图-1所示。
时,CO2的平衡转化率及CH3OCH3和CH3OH的平衡体积分数随温度变化如图-1所示。
①
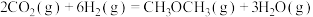 △H=
△H=②从453-553℃,升高温度CO2平衡转化率降低的原因是
③为提高单位时间内CH3OCH3产率。研发的催化剂需具备的特点是
(2)在催化剂作用下,二甲醚还原NO的反应原理为
 △H<0。在有氧和无氧的环境下,NO的去除率随温度变化如图-2所示。
△H<0。在有氧和无氧的环境下,NO的去除率随温度变化如图-2所示。
①无氧环境下,在250~450℃范围内随着温度的升高,NO的去除率先迅速上升后上升缓慢的主要原因是
②温度高于400℃时,NO去除率明显低于无氧环境的可能原因有
您最近一年使用:0次
解题方法
8 . 研究高效催化剂是解决汽车尾气中的NO和CO对大气污染的重要途径。
(1)已知: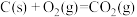


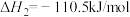
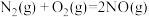

则汽车尾气的催化转化反应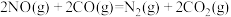 属于反应
属于反应______ (放热或吸热)。
(2)400℃时,在分别装有催化剂A和B的两个容积为2L的刚性密闭容器中,各充入物质的量均为 的
的 和
和 发生上述反应。通过测定容器内总压强随时间变化来探究催化剂对反应速率的影响,数据如下表;
发生上述反应。通过测定容器内总压强随时间变化来探究催化剂对反应速率的影响,数据如下表;
①由上表可以判断催化剂______ (填“A”或“B”)的效果更好。
②容器中 的平衡转化率为
的平衡转化率为______ 。
③汽车尾气排气管中使用催化剂可以提高污染物转化率,其原因是______ 。
(3)为研究气缸中 的生成,在体积可变的恒压密闭容器中,高温下充入物质的量均为
的生成,在体积可变的恒压密闭容器中,高温下充入物质的量均为 的氮气和氧气,发生反应
的氮气和氧气,发生反应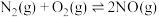 。
。
①下列说法能表明该反应已经达到平衡状态的是______ (填序号)。
A.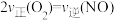 B.混合气体的平均相对分子质量不变
B.混合气体的平均相对分子质量不变
C. D.容器内气体的密度不再发生变化
D.容器内气体的密度不再发生变化
②为减小平衡混合气中NO体积分数,可采取的措施是_____ 。(填升高温度或降低温度)
(4)对于气缸中 的生成,化学家提出了如下反应历程:
的生成,化学家提出了如下反应历程:
第一步 慢反应
慢反应
第二步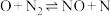 较快平衡
较快平衡
第三步 快速平衡
快速平衡
下列说法正确的是______(填标号)。
(1)已知:
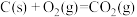


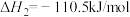
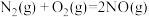

则汽车尾气的催化转化反应
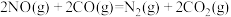 属于反应
属于反应(2)400℃时,在分别装有催化剂A和B的两个容积为2L的刚性密闭容器中,各充入物质的量均为
 的
的 和
和 发生上述反应。通过测定容器内总压强随时间变化来探究催化剂对反应速率的影响,数据如下表;
发生上述反应。通过测定容器内总压强随时间变化来探究催化剂对反应速率的影响,数据如下表;| 时间/min | 0 | 10 | 20 | 30 |
|
| A容器内压强/kPa | 100.0 | 90.0 | 85.0 | 80.0 | 80.0 |
| B容器内压强/kPa | 100.0 | 95.0 | 90.0 | 85.0 | 80.0 |
①由上表可以判断催化剂
②容器中
 的平衡转化率为
的平衡转化率为③汽车尾气排气管中使用催化剂可以提高污染物转化率,其原因是
(3)为研究气缸中
 的生成,在体积可变的恒压密闭容器中,高温下充入物质的量均为
的生成,在体积可变的恒压密闭容器中,高温下充入物质的量均为 的氮气和氧气,发生反应
的氮气和氧气,发生反应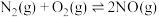 。
。①下列说法能表明该反应已经达到平衡状态的是
A.
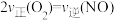 B.混合气体的平均相对分子质量不变
B.混合气体的平均相对分子质量不变C.
 D.容器内气体的密度不再发生变化
D.容器内气体的密度不再发生变化②为减小平衡混合气中NO体积分数,可采取的措施是
(4)对于气缸中
 的生成,化学家提出了如下反应历程:
的生成,化学家提出了如下反应历程:第一步
 慢反应
慢反应第二步
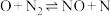 较快平衡
较快平衡第三步
 快速平衡
快速平衡下列说法正确的是______(填标号)。
| A.N、O原子均为该反应的催化剂 |
B.第一步反应不从 分解开始,是因为 分解开始,是因为 比 比 稳定 稳定 |
| C.三步反应中第一步反应活化能最小 |
| D.三步反应的速率都随温度升高而增大 |
您最近一年使用:0次
9 . 氨气和甲醇都是重要的工业产品,试运用必要的化学原理解决有关问题。
(1)在密闭容器中,使 和
和 在一定条件下发生反应:
在一定条件下发生反应: 。
。
①平衡后, 和
和 的转化率的比值
的转化率的比值_______ 1(填“>”“<”或“=”)。
②当达到平衡时,保持恒温,压缩容器体积,平衡_______ (填“正向”“逆向”或“不”)移动,化学平衡常数K_______ (填“增大”“减小”或“不变”)。
(2)水煤气在一定条件下可合成甲醇: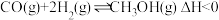 。将
。将 和
和 充入
充入 恒容密闭容器中,在一定条件下合成甲醇,反应相同时间(
恒容密闭容器中,在一定条件下合成甲醇,反应相同时间( )时测得不同温度下
)时测得不同温度下 的转化率如图所示:
的转化率如图所示:
①温度在 下,从反应开始至
下,从反应开始至 末,这段时间内的反应速率
末,这段时间内的反应速率
_______ 。
②由图可知,在温度低于 时,
时, 的转化率随温度的升高而增大,原因是
的转化率随温度的升高而增大,原因是_______ 。
③已知c点时容器内气体的压强为P,则在 下该反应的压强平衡常数
下该反应的压强平衡常数 为
为_______  (用含p的代数式表示,
(用含p的代数式表示, 是用各气体的分压替代浓度来计算的平衡常数,分压=总压×物质的量分数)。
是用各气体的分压替代浓度来计算的平衡常数,分压=总压×物质的量分数)。
(3)探究 合成反应化学平衡的影响因素,有利于提高
合成反应化学平衡的影响因素,有利于提高 的产率。以
的产率。以 为原料合成
为原料合成 涉及的主要反应如下:
涉及的主要反应如下:
I.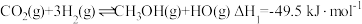
II.
III.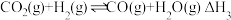
一定条件下,向体积为 的恒容密闭容器中通入
的恒容密闭容器中通入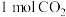 和
和 发生上述反应,达到平衡时,容器中
发生上述反应,达到平衡时,容器中 为
为 ,
, 为
为 ,此时
,此时 的浓度为
的浓度为_______  (用含a、b、V的代数式表示,可以不化简,下同),反应Ⅲ的平衡常数为
(用含a、b、V的代数式表示,可以不化简,下同),反应Ⅲ的平衡常数为_______ 。
(1)在密闭容器中,使
 和
和 在一定条件下发生反应:
在一定条件下发生反应: 。
。①平衡后,
 和
和 的转化率的比值
的转化率的比值②当达到平衡时,保持恒温,压缩容器体积,平衡
(2)水煤气在一定条件下可合成甲醇:
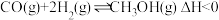 。将
。将 和
和 充入
充入 恒容密闭容器中,在一定条件下合成甲醇,反应相同时间(
恒容密闭容器中,在一定条件下合成甲醇,反应相同时间( )时测得不同温度下
)时测得不同温度下 的转化率如图所示:
的转化率如图所示:
①温度在
 下,从反应开始至
下,从反应开始至 末,这段时间内的反应速率
末,这段时间内的反应速率
②由图可知,在温度低于
 时,
时, 的转化率随温度的升高而增大,原因是
的转化率随温度的升高而增大,原因是③已知c点时容器内气体的压强为P,则在
 下该反应的压强平衡常数
下该反应的压强平衡常数 为
为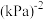 (用含p的代数式表示,
(用含p的代数式表示, 是用各气体的分压替代浓度来计算的平衡常数,分压=总压×物质的量分数)。
是用各气体的分压替代浓度来计算的平衡常数,分压=总压×物质的量分数)。(3)探究
 合成反应化学平衡的影响因素,有利于提高
合成反应化学平衡的影响因素,有利于提高 的产率。以
的产率。以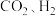 为原料合成
为原料合成 涉及的主要反应如下:
涉及的主要反应如下:I.
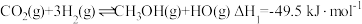
II.

III.
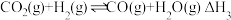
一定条件下,向体积为
 的恒容密闭容器中通入
的恒容密闭容器中通入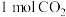 和
和 发生上述反应,达到平衡时,容器中
发生上述反应,达到平衡时,容器中 为
为 ,
, 为
为 ,此时
,此时 的浓度为
的浓度为 (用含a、b、V的代数式表示,可以不化简,下同),反应Ⅲ的平衡常数为
(用含a、b、V的代数式表示,可以不化简,下同),反应Ⅲ的平衡常数为
您最近一年使用:0次
2022-11-12更新
|
165次组卷
|
2卷引用:江苏省苏北三市2022-2023学年高二上学期阶段调研测试化学试题
名校
解题方法
10 . 已知: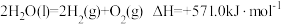 。以太阳能为热源分解
。以太阳能为热源分解 ,经热化学铁氧化合物循环分解水制
,经热化学铁氧化合物循环分解水制 的过程如下:
的过程如下:
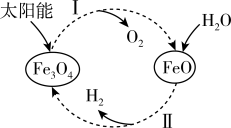
过程Ⅰ:
过程Ⅱ:……
下列说法正确的是
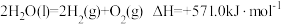 。以太阳能为热源分解
。以太阳能为热源分解 ,经热化学铁氧化合物循环分解水制
,经热化学铁氧化合物循环分解水制 的过程如下:
的过程如下:
过程Ⅰ:

过程Ⅱ:……
下列说法正确的是
A. 起催化剂的作用,在反应过程中化学性质不发生改变 起催化剂的作用,在反应过程中化学性质不发生改变 |
B.过程Ⅰ中每消耗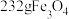 转移4mol电子 转移4mol电子 |
| C.过程Ⅰ、Ⅱ中能量转化的形式依次是太阳能→化学能→热能 |
D.过程Ⅱ的热化学方程式为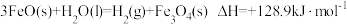 |
您最近一年使用:0次
2022-11-05更新
|
429次组卷
|
6卷引用:江苏省扬州中学2022-2023学年高二上学期12月月考化学试题




