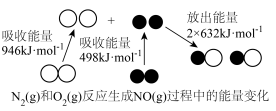
1 . 化学反应原理在生产、生活中用途广泛。氮是地球上含量丰富的一种元素,氮及其化合物对我们的生产、生活有重要的影响。请回答下列问题:
(1)机动车发动机工作时会引发 与
与 的反应(如图所示),请用热化学方程式表示以下反应
的反应(如图所示),请用热化学方程式表示以下反应___________ 。
(2)已知
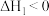 ,
,
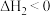 ,下列能量变化示意图中,正确的是___________。
,下列能量变化示意图中,正确的是___________。
(1)机动车发动机工作时会引发
 与
与 的反应(如图所示),请用热化学方程式表示以下反应
的反应(如图所示),请用热化学方程式表示以下反应
(2)已知

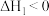 ,
,
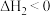 ,下列能量变化示意图中,正确的是___________。
,下列能量变化示意图中,正确的是___________。A.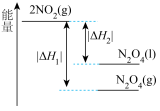 | B.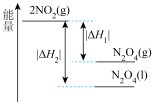 |
C.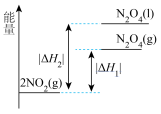 | D.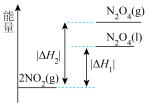 |
您最近一年使用:0次
21-22高一下·上海浦东新·期中
名校
解题方法
2 . 含铝的化合物如氧化铝、氢氧化铝等在工业上用途十分广泛。某兴趣小组从 和
和 的混合物分离出
的混合物分离出 ,流程图如下:
,流程图如下:
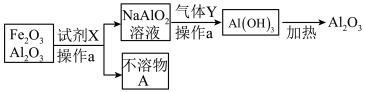
(1)操作a的名称为___________ ;需要的玻璃仪器有烧杯、___________ 。
(2)写出下列物质的化学式:试剂X___________ ;不溶物A___________ ;
(3)气体Y的结构式为___________ ;若通入的Y是足量的,则发生的反应方程式为___________ 。
(4)电解熔融的 可以制备铝单质,而不能通过电解熔融的
可以制备铝单质,而不能通过电解熔融的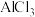 来生产铝,原因是
来生产铝,原因是___________ 。
(5)氢氧化铝是应用广泛的无机阻燃添加剂,阻燃时发生的化学反应为: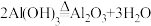 ,根据方程式解释氢氧化铝能做阻燃剂的原因:
,根据方程式解释氢氧化铝能做阻燃剂的原因:___________ 。
 和
和 的混合物分离出
的混合物分离出 ,流程图如下:
,流程图如下:
(1)操作a的名称为
(2)写出下列物质的化学式:试剂X
(3)气体Y的结构式为
(4)电解熔融的
 可以制备铝单质,而不能通过电解熔融的
可以制备铝单质,而不能通过电解熔融的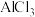 来生产铝,原因是
来生产铝,原因是(5)氢氧化铝是应用广泛的无机阻燃添加剂,阻燃时发生的化学反应为:
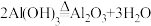 ,根据方程式解释氢氧化铝能做阻燃剂的原因:
,根据方程式解释氢氧化铝能做阻燃剂的原因:
您最近一年使用:0次
名校
3 . 请根据要求回答问题:
(1)合金具有许多优良的性能,我国C919大型飞机上就使用了大量新型材料铝合金。下列物质属于合金的是___________(填选项编号)。
(2)室温下金属钠长期露置在空气中,最终将变为___________(填选项编号)。
(3)为了检验 溶液是否被氧化,可向溶液中加入___________(填选项编号)。
溶液是否被氧化,可向溶液中加入___________(填选项编号)。
(4)冷敷袋俗称冰袋,在日常生活中有降温、保鲜和镇痛等多种用途。制作冷敷袋可以利用___________(填选项编号)。
(1)合金具有许多优良的性能,我国C919大型飞机上就使用了大量新型材料铝合金。下列物质属于合金的是___________(填选项编号)。
| A.水银 | B.青铜 | C.白银 | D.黄金 |
A. | B. | C. | D.NaOH |
 溶液是否被氧化,可向溶液中加入___________(填选项编号)。
溶液是否被氧化,可向溶液中加入___________(填选项编号)。| A.新制氯水 | B.铁片 | C.KSCN溶液 | D.石蕊试液 |
| A.吸热的物理变化 | B.放热的物理变化 | C.吸热的化学变化 | D.放热的化学变化 |
您最近一年使用:0次
名校
4 . Ⅰ.认识反应条件对化学反应方向,限度及快慢的影响,有利于运用这些规律解决实际问题。
(1)下列有关说法正确的是__________
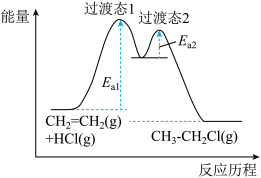
(2) 与
与 的加成反应分为两步,能量与反应历程如图所示。下列说法中正确的是__________
的加成反应分为两步,能量与反应历程如图所示。下列说法中正确的是__________
(3)一定条件下 在催化剂表面与水发生反应
在催化剂表面与水发生反应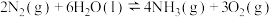 ,
, ,如果反应的平衡常数K值变大,该反应__________
,如果反应的平衡常数K值变大,该反应__________
(4)下列有关可逆反应: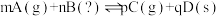 的分析中,一定正确的是__________
的分析中,一定正确的是__________
Ⅱ.金属钛(Ti)在工业领域有着重要用途。目前生产钛的方法之一是先将 转化为
转化为 ,再进一步还原得到钛。工业上将
,再进一步还原得到钛。工业上将 转化为
转化为 的方法为:
的方法为:
碳氯化法:
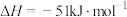
(5)平衡常数表达式
___________ ;恒温恒容时,下列叙述一定能说明该反应达到平衡状态的是___________ 。
A.混合气体的压强保持不变 B.
C.混合气体的密度保持不变 D. 和
和 物质的量相等
物质的量相等
(6)若反应容器的容积为 ,
, 后,测得固体的质量减少
后,测得固体的质量减少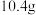 ,则
,则 的平均反应速率为
的平均反应速率为___________ 。从碰撞理论解释升高温度反应速率加快的原因:___________ 。
Ⅲ.工业上将 转化为
转化为 的方法为还有直接氯化法:
的方法为还有直接氯化法:
直接氯化法:
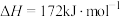
(7)从 和
和 的角度说明碳氯化法的反应趋势远大于直接氯化法的原因:
的角度说明碳氯化法的反应趋势远大于直接氯化法的原因:___________ 。
(8)由 冶炼钛方法有:900℃,
冶炼钛方法有:900℃,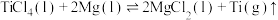 ;从平衡移动角度解释上述冶炼金属钛的反应原理
;从平衡移动角度解释上述冶炼金属钛的反应原理___________ 。
(1)下列有关说法正确的是__________
A.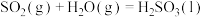 ,该过程熵值增大 ,该过程熵值增大 |
B.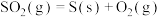 , , ,该反应一定能自发进行 ,该反应一定能自发进行 |
C.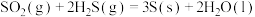 ,该过程熵值增大 ,该过程熵值增大 |
D. , , , , ,此反应低温自发 ,此反应低温自发 |
 与
与 的加成反应分为两步,能量与反应历程如图所示。下列说法中正确的是__________
的加成反应分为两步,能量与反应历程如图所示。下列说法中正确的是__________
| A.决速步骤是第一步 | B.总反应为吸热反应 |
| C.总能量:反应物低于生成物 | D.过渡态1比过渡态2更稳定 |
 在催化剂表面与水发生反应
在催化剂表面与水发生反应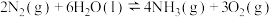 ,
, ,如果反应的平衡常数K值变大,该反应__________
,如果反应的平衡常数K值变大,该反应__________| A.在平衡移动时正反应速率先减小后增大 | B.一定向正反应方向移动 |
| C.在平衡移动时逆反应速率先增大后减小 | D.一定向逆反应方向移动 |
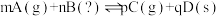 的分析中,一定正确的是__________
的分析中,一定正确的是__________A.增大压强,平衡不移动,则 |
| B.升高温度,A的转化率诚小,则正反应是吸热反应 |
| C.保持容器体积不变,移走C,平衡正向移动,正反应速率增大 |
| D.保持容器体积不变,加入B,容器中D的质量增加,则B是气体 |
Ⅱ.金属钛(Ti)在工业领域有着重要用途。目前生产钛的方法之一是先将
 转化为
转化为 ,再进一步还原得到钛。工业上将
,再进一步还原得到钛。工业上将 转化为
转化为 的方法为:
的方法为:碳氯化法:

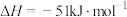
(5)平衡常数表达式

A.混合气体的压强保持不变 B.

C.混合气体的密度保持不变 D.
 和
和 物质的量相等
物质的量相等(6)若反应容器的容积为
 ,
, 后,测得固体的质量减少
后,测得固体的质量减少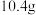 ,则
,则 的平均反应速率为
的平均反应速率为Ⅲ.工业上将
 转化为
转化为 的方法为还有直接氯化法:
的方法为还有直接氯化法:直接氯化法:

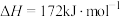
(7)从
 和
和 的角度说明碳氯化法的反应趋势远大于直接氯化法的原因:
的角度说明碳氯化法的反应趋势远大于直接氯化法的原因:(8)由
 冶炼钛方法有:900℃,
冶炼钛方法有:900℃,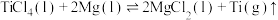 ;从平衡移动角度解释上述冶炼金属钛的反应原理
;从平衡移动角度解释上述冶炼金属钛的反应原理
您最近一年使用:0次
2023-04-30更新
|
349次组卷
|
2卷引用:上海市第二中学2022-2023学年高二下学期期中考试等级考化学试题
5 . 钠及其化合物具有独特的性质和广泛的用途。
I.
(1)下图为钠与水反应的实验示意图。
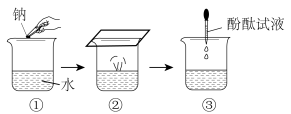
i.②中现象说明钠的密度比水___________ (“大”或“小”)。
ii.实验中观察到钠融成小球,下列能量变化示意图中能解释该现象的是___________ 。
a.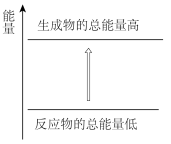 B.
B.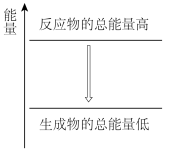
iii.③中加入酚酞试液后的现象是___________ 。
(2)用化学方程式表示由氯化钠制取金属钠的原理。___________
(3)将一定量的 通入
通入 溶液中。所得溶液转移至Y形管的一侧,并放入小磁子;向Y形管另一侧支管中加入
溶液中。所得溶液转移至Y形管的一侧,并放入小磁子;向Y形管另一侧支管中加入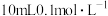 盐酸,Y形管上端连接压强传感器。将Y形管倾斜,使两支管中的溶液混合,启动磁力搅拌器,采集压强数据。当数据变化平缓时,停止采集数据,得到如图所示的实验结果:
盐酸,Y形管上端连接压强传感器。将Y形管倾斜,使两支管中的溶液混合,启动磁力搅拌器,采集压强数据。当数据变化平缓时,停止采集数据,得到如图所示的实验结果:
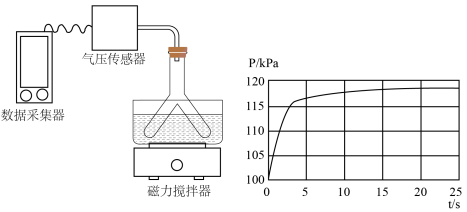
其中0~5s发生反应的离子方程式为___________ 。20s时溶液中的溶质是___________ (不考虑气体在水中的溶解)。
II.过碳酸钠(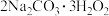 ),俗名固态双氧水,具有去污杀菌等功效。其制备原理为:
),俗名固态双氧水,具有去污杀菌等功效。其制备原理为: (反应放热)
(反应放热)
(4)结合 和
和 的性质,推测制备过碳酸钠的原料中,
的性质,推测制备过碳酸钠的原料中, 与
与 的物质的量之比应
的物质的量之比应___________  。
。
A.大于 B.等于 C.小于
向 中加入
中加入 溶液的速度不能过快,原因是
溶液的速度不能过快,原因是___________ 。
(5)在过碳酸钠的生产过程中需要加入稳定剂,以得到稳定性好的过碳酸钠产品,保证其在一定贮存期内仍具有高活性的氧含量。以不同种类的稳定剂制备过碳酸钠产品,测得其活性氧质量分数随时间的变化如图所示:
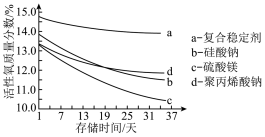
由图可知,制备过碳酸钠时应选择的稳定剂是___________ ,理由是___________ 。
A.a B.b C.c D.d
I.
(1)下图为钠与水反应的实验示意图。

i.②中现象说明钠的密度比水
ii.实验中观察到钠融成小球,下列能量变化示意图中能解释该现象的是
a.
 B.
B.
iii.③中加入酚酞试液后的现象是
(2)用化学方程式表示由氯化钠制取金属钠的原理。
(3)将一定量的
 通入
通入 溶液中。所得溶液转移至Y形管的一侧,并放入小磁子;向Y形管另一侧支管中加入
溶液中。所得溶液转移至Y形管的一侧,并放入小磁子;向Y形管另一侧支管中加入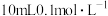 盐酸,Y形管上端连接压强传感器。将Y形管倾斜,使两支管中的溶液混合,启动磁力搅拌器,采集压强数据。当数据变化平缓时,停止采集数据,得到如图所示的实验结果:
盐酸,Y形管上端连接压强传感器。将Y形管倾斜,使两支管中的溶液混合,启动磁力搅拌器,采集压强数据。当数据变化平缓时,停止采集数据,得到如图所示的实验结果:
其中0~5s发生反应的离子方程式为
II.过碳酸钠(
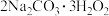 ),俗名固态双氧水,具有去污杀菌等功效。其制备原理为:
),俗名固态双氧水,具有去污杀菌等功效。其制备原理为: (反应放热)
(反应放热)(4)结合
 和
和 的性质,推测制备过碳酸钠的原料中,
的性质,推测制备过碳酸钠的原料中, 与
与 的物质的量之比应
的物质的量之比应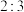 。
。A.大于 B.等于 C.小于
向
 中加入
中加入 溶液的速度不能过快,原因是
溶液的速度不能过快,原因是(5)在过碳酸钠的生产过程中需要加入稳定剂,以得到稳定性好的过碳酸钠产品,保证其在一定贮存期内仍具有高活性的氧含量。以不同种类的稳定剂制备过碳酸钠产品,测得其活性氧质量分数随时间的变化如图所示:

由图可知,制备过碳酸钠时应选择的稳定剂是
A.a B.b C.c D.d
您最近一年使用:0次
22-23高二·上海·单元测试
解题方法
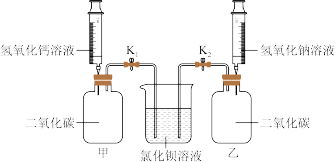
6 . 生产生活中的化学反应都伴随着能量的变化,请根据有关知识回答下列问题:
(1)冷敷袋在日常生活中有降温、保鲜和镇痛等用途。制作冷敷袋可以利用___________ (填“放热”或“吸热”)的化学变化或物理变化。
(2)“即热饭盒”给人们生活带来方便,它可利用下面___________(填字母)反应释放的热量加热食物。
(3)已知:2molH2与足量O2充分燃烧生成液态水时放出572kJ热量。
①该反应的能量变化可用图中的___________ (填字母)表示。
②写出H2燃烧生成液态水的热化学反应方程式___________ 。
(4)已知 键能:436kJ·mol-1,
键能:436kJ·mol-1, 键能:946kJ·mol-1,
键能:946kJ·mol-1, 键能:391kJ·mol-1.根据以上数据写出工业合成氨的热化学反应方程式
键能:391kJ·mol-1.根据以上数据写出工业合成氨的热化学反应方程式___________ 。
(1)冷敷袋在日常生活中有降温、保鲜和镇痛等用途。制作冷敷袋可以利用
(2)“即热饭盒”给人们生活带来方便,它可利用下面___________(填字母)反应释放的热量加热食物。
| A.生石灰和水 | B.浓硫酸和水 | C.纯碱和水 | D.食盐和白醋 |
①该反应的能量变化可用图中的

②写出H2燃烧生成液态水的热化学反应方程式
(4)已知
 键能:436kJ·mol-1,
键能:436kJ·mol-1, 键能:946kJ·mol-1,
键能:946kJ·mol-1, 键能:391kJ·mol-1.根据以上数据写出工业合成氨的热化学反应方程式
键能:391kJ·mol-1.根据以上数据写出工业合成氨的热化学反应方程式
您最近一年使用:0次
21-22高一·全国·假期作业
解题方法
7 . 碱是一类重要的物质,氢氧化钠和氢氧化钙是常见的碱。
(1)我国古代劳动人民在生产、生活中就已经充分利用氢氧化钙。氢氧化钙的俗名是_______ ,请写出氢氧化钙的一种用途_______ 。
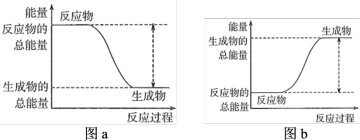
(2)为验证氢氧化钙和氢氧化钠的性质,进行如下图所示实验(装置气密性良好)。
步骤:分别向充满二氧化碳的甲、乙两个容器中注入等体积的氢氧化钙饱和溶液、氢氧化钠饱和溶液;稍后打开弹簧夹K1、K2。
现象与结论:实验过程中甲、乙均有氯化钡溶液进入,进入乙中的液体量较多。从氢氧化钙和氢氧化钠性质的角度分析,产生上述现象的原因_______ 。乙中产生的白色沉淀的化学式是_______ 。
(3)在某15mL氢氧化钠溶液中滴入稀盐酸,稀盐酸的体积与溶液温度的变化关系如下图所示。

I.由上图可知,氢氧化钠溶液与盐酸反应会_______ (选填“放出”或“吸收”)热量;滴入稀盐酸的体积为_______ (选填“a”“b”“c”或“d”)mL时两者恰好完全反应。
II.设计实验,证明上述实验产生的热量来自酸碱中和反应,而不是溶液稀释所导致的。请写出实验方案。_______
(1)我国古代劳动人民在生产、生活中就已经充分利用氢氧化钙。氢氧化钙的俗名是
(2)为验证氢氧化钙和氢氧化钠的性质,进行如下图所示实验(装置气密性良好)。

步骤:分别向充满二氧化碳的甲、乙两个容器中注入等体积的氢氧化钙饱和溶液、氢氧化钠饱和溶液;稍后打开弹簧夹K1、K2。
现象与结论:实验过程中甲、乙均有氯化钡溶液进入,进入乙中的液体量较多。从氢氧化钙和氢氧化钠性质的角度分析,产生上述现象的原因
(3)在某15mL氢氧化钠溶液中滴入稀盐酸,稀盐酸的体积与溶液温度的变化关系如下图所示。

I.由上图可知,氢氧化钠溶液与盐酸反应会
II.设计实验,证明上述实验产生的热量来自酸碱中和反应,而不是溶液稀释所导致的。请写出实验方案。
您最近一年使用:0次
名校
解题方法
8 . 生产生活中的化学反应都伴随着能量的变化,请根据有关知识回答下列问题:
(1)冷敷袋在日常生活中有降温、保鲜和镇痛等用途。制作冷敷袋可以利用_______ (填“放热”或“吸热”)的化学变化或物理变化。“即热饭盒”可以利用下面_______ 放的热量加热食物;
A. 生石灰和水 B. 浓硫酸和水 C. 纯碱和水 D. 食盐和白醋
(2)已知:2mol 与足量
与足量 充分燃烧生成液态水时放出572kJ热量。
充分燃烧生成液态水时放出572kJ热量。
①该反应的能变化可用图中的_______ (填字母)表示。
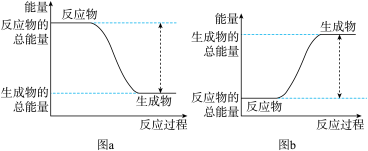
②写出 燃烧生成液态水的热化学反应方程式
燃烧生成液态水的热化学反应方程式_______ 。
(3)下列关于反应热的叙述正确的是_______。
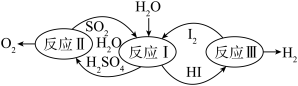
(4)科学家提出的碘硫热化学循环是由Ⅰ、Ⅱ、Ⅲ三步反应组成的(如图所示),下列有关说法正确的是_______。
(5)可用焓变和熵变来判断化学反应进行的方向,下列都是能自发进行的化学反应,其中是吸热反应且反应后熵增的是_______。
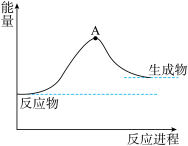
(6)一种分解海水制氢气的方法为 。如图为该反应的能量变化示意图,使用催化剂
。如图为该反应的能量变化示意图,使用催化剂 后,图中A点将
后,图中A点将_______ (填“升高”、“降低”或“不变”)。
(7)已知H-H键能: ,
, 键能:
键能: ,N-H键能:
,N-H键能: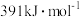 。根据以上数据写出工业合成氨的热化学反应方程
。根据以上数据写出工业合成氨的热化学反应方程_______ 。
(1)冷敷袋在日常生活中有降温、保鲜和镇痛等用途。制作冷敷袋可以利用
A. 生石灰和水 B. 浓硫酸和水 C. 纯碱和水 D. 食盐和白醋
(2)已知:2mol
 与足量
与足量 充分燃烧生成液态水时放出572kJ热量。
充分燃烧生成液态水时放出572kJ热量。①该反应的能变化可用图中的

②写出
 燃烧生成液态水的热化学反应方程式
燃烧生成液态水的热化学反应方程式(3)下列关于反应热的叙述正确的是_______。
A.当 时,表示该反应为吸热反应 时,表示该反应为吸热反应 |
B.lmol 与0. 5mol 与0. 5mol 反应生成1mol水时放出的热量即是 反应生成1mol水时放出的热量即是 的燃烧热 的燃烧热 |
| C.热化学方程式中的化学计量数只能是整数,不能是分数 |
D.1molNaOH分别和1 mol ,lmol ,lmol 反应放出的热量: 反应放出的热量: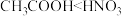 |

| A.该循环总的结果是放热反应 |
B.整个循环过程中产生1mol 的同时产生44.8L 的同时产生44.8L |
C.若反应Ⅰ、Ⅱ、Ⅲ的反应热分别为 、 、 、 、 , ,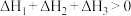 |
| D.图中反应Ⅰ、Ⅱ、Ⅲ均可在常温常压下进行 |
A.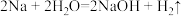 | B. |
C. | D.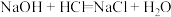 |
 。如图为该反应的能量变化示意图,使用催化剂
。如图为该反应的能量变化示意图,使用催化剂 后,图中A点将
后,图中A点将
(7)已知H-H键能:
 ,
, 键能:
键能: ,N-H键能:
,N-H键能: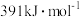 。根据以上数据写出工业合成氨的热化学反应方程
。根据以上数据写出工业合成氨的热化学反应方程
您最近一年使用:0次



