1 . 恒温下,在4L的密闭容器中充入4mol 和3.2mol
和3.2mol ,发生反应
,发生反应 ,反应过程中对
,反应过程中对 的物质的量进行检测,得到的数据如下表所示:
的物质的量进行检测,得到的数据如下表所示:
下列说法错误的是
 和3.2mol
和3.2mol ,发生反应
,发生反应 ,反应过程中对
,反应过程中对 的物质的量进行检测,得到的数据如下表所示:
的物质的量进行检测,得到的数据如下表所示:| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
 | 0.32 | 0.56 | 0.72 | 0.80 | 0.80 | 0.80 |
A.前10分钟,用 表示的化学反应速率为 表示的化学反应速率为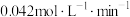 |
B. (逆):5分钟时小于10分钟时 (逆):5分钟时小于10分钟时 |
| C.平衡后,将容器的容积扩大到原来的两倍,再达平衡时,H2的物质的量浓度大于 0.2mol·L-1 |
| D.维持容器容积、温度不变,平衡时再加入CO2和CH3OH各3.2mol,平衡将向正反应方向进行 |
您最近一年使用:0次
解题方法
2 .  与
与 的干法重整(DRM)反应为
的干法重整(DRM)反应为 。向体积为
。向体积为 的恒容密闭容器中通入
的恒容密闭容器中通入 和
和 各
各 ,在不同温度
,在不同温度 、
、 下测得
下测得 随时间变化的曲线如图。下列说法错误的是
随时间变化的曲线如图。下列说法错误的是
 与
与 的干法重整(DRM)反应为
的干法重整(DRM)反应为 。向体积为
。向体积为 的恒容密闭容器中通入
的恒容密闭容器中通入 和
和 各
各 ,在不同温度
,在不同温度 、
、 下测得
下测得 随时间变化的曲线如图。下列说法错误的是
随时间变化的曲线如图。下列说法错误的是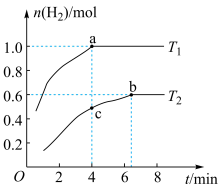
| A.该反应是吸热反应 |
B.a、b点平衡常数: |
C. 时, 时, 的平衡转化率是30% 的平衡转化率是30% |
D.化学反应速率: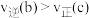 |
您最近一年使用:0次
2024-02-02更新
|
85次组卷
|
3卷引用:山东省济宁市实验中学2023-2024学年高二下学期开学考化学试题
名校
解题方法
3 . 甲醇(CH3OH)在化工生产中应用广泛。其中利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,可能发生的反应如下:
I.CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH1=-41.0kJ·mol-1
Ⅱ.CO(g)+2H2(g)⇌CH3OH(g) ΔH2=-90.0kJ·mol-1
Ⅲ.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH3
(1)ΔH3=___________ ,在上述制备甲醇的两个反应中,反应Ⅱ与反应Ⅲ比较,优点为___________ 。
(2)在一恒温恒容密闭容器中充入1molCO2和3molH2进行反应Ⅲ,测得CO2和CH3OH浓度随时间变化如下图所示。

3min时,反应的v正___________ v逆(填“<”、“>”或“=”)。0~10min内,用H2表示的平均反应速率v=___________ 。
(3)使用不同方法制得的Cu2O(Ⅰ)和Cu2O(Ⅱ)可用于CH3OH的催化脱氢:CH3OH(g)⇌HCHO(g)+H2(g)。在相同的密闭容器中,利用控制变量法进行实验,测得CH3OH的浓度c(mol·L-1)随时间t(min)的变化如下表:
可以判断:实验温度T1___________ T2(填“>”、“<”,下同);催化剂的催化效果Cu2O(Ⅰ)___________ Cu2O(Ⅱ)。
(4)CO与H2反应可制备CH3OH,由CH3OH和O2构成的质子交换膜燃料电池的结构示意如下图所示。电池总反应为2CH3OH+3O2=2CO2+4H2O,则c电极是___________ (填“正极”或“负极”),c电极的电极反应式为___________ 。若外电路中转移2mol电子,则上述燃料电池所消耗的O2在标准状况下的体积为___________ L。

I.CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH1=-41.0kJ·mol-1
Ⅱ.CO(g)+2H2(g)⇌CH3OH(g) ΔH2=-90.0kJ·mol-1
Ⅲ.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH3
(1)ΔH3=
(2)在一恒温恒容密闭容器中充入1molCO2和3molH2进行反应Ⅲ,测得CO2和CH3OH浓度随时间变化如下图所示。

3min时,反应的v正
(3)使用不同方法制得的Cu2O(Ⅰ)和Cu2O(Ⅱ)可用于CH3OH的催化脱氢:CH3OH(g)⇌HCHO(g)+H2(g)。在相同的密闭容器中,利用控制变量法进行实验,测得CH3OH的浓度c(mol·L-1)随时间t(min)的变化如下表:
| 序号 | 温度 | 催化剂 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | Cu2O(Ⅰ) | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | Cu2O(Ⅱ) | 0.050 | 0.0490 | 0.0483 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | Cu2O(Ⅲ) | 0.050 | 0.044 | 0.040 | 0.040 | 0.040 | 0.040 |
(4)CO与H2反应可制备CH3OH,由CH3OH和O2构成的质子交换膜燃料电池的结构示意如下图所示。电池总反应为2CH3OH+3O2=2CO2+4H2O,则c电极是

您最近一年使用:0次
解题方法
4 . 一定条件下,化合物E和TFAA合成H的反应路径如下:
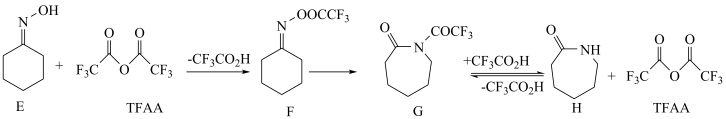
已知反应初始E的浓度为0.10mol·L-1,TFAA的浓度为0.08mol·L-1,部分物种的浓度随时间的变化关系如图所示,忽略反应过程中的体积变化。下列说法错误的是
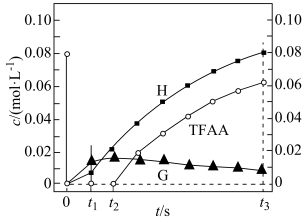

已知反应初始E的浓度为0.10mol·L-1,TFAA的浓度为0.08mol·L-1,部分物种的浓度随时间的变化关系如图所示,忽略反应过程中的体积变化。下列说法错误的是

| A.t1时刻,体系中E的浓度为0.02mol·L-1 |
| B.t2时刻,体系中无E存在 |
| C.t3时刻,F、G、H的浓度和为0.10mol·L-1 |
| D.t3时刻,G的转化率为80% |
您最近一年使用:0次
名校
解题方法
5 . “绿水青山就是金山银山”,运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
(1)汽车是近代重要的交通运输工具,随着汽车量的激增,汽车尾气造成的环境污染也日益严重,汽车尾气中的有害成分主要有 、
、 、
、 、颗粒物和臭氧等。
、颗粒物和臭氧等。
①汽车尾气中 生成过程中的能量变化如图所示,1mol
生成过程中的能量变化如图所示,1mol 和1mol
和1mol 完全反应生成
完全反应生成 会
会___________ (填“吸收”或“放出”)___________ kJ能量。

②一种新型催化剂用于 和
和 的反应:
的反应: ,为测定在某种催化剂作用下该反应的反应速率,在某温度下用气体传感器测得不同时间的
,为测定在某种催化剂作用下该反应的反应速率,在某温度下用气体传感器测得不同时间的 和
和 浓度如下表:
浓度如下表:
前2s内的平均反应速率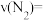
___________ 。
③在容积固定的绝热容器中发生反应 ,下列能说明该反应已达到平衡状态的是
,下列能说明该反应已达到平衡状态的是___________ (填标号)。
A.容器内混合气体温度不再变化 B.容器内的气体压强保持不变
C.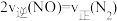 D.容器内混合气体密度保持不变
D.容器内混合气体密度保持不变
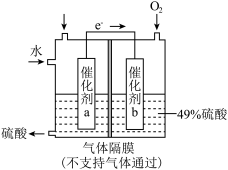
(2)煤燃烧排放的烟气中含有 和
和 ,会污染大气,形成酸雨。将
,会污染大气,形成酸雨。将 转化为重要的化工原料
转化为重要的化工原料 的原理示意图如图。催化剂a表面的电极反应式为
的原理示意图如图。催化剂a表面的电极反应式为___________ 。若得到的硫酸质量分数仍为49%,则理论上参加反应的 与加入的
与加入的 的物质的量之比为
的物质的量之比为___________ 。
(1)汽车是近代重要的交通运输工具,随着汽车量的激增,汽车尾气造成的环境污染也日益严重,汽车尾气中的有害成分主要有
 、
、 、
、 、颗粒物和臭氧等。
、颗粒物和臭氧等。①汽车尾气中
 生成过程中的能量变化如图所示,1mol
生成过程中的能量变化如图所示,1mol 和1mol
和1mol 完全反应生成
完全反应生成 会
会
②一种新型催化剂用于
 和
和 的反应:
的反应: ,为测定在某种催化剂作用下该反应的反应速率,在某温度下用气体传感器测得不同时间的
,为测定在某种催化剂作用下该反应的反应速率,在某温度下用气体传感器测得不同时间的 和
和 浓度如下表:
浓度如下表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
 | 10 | 4.5 | 2.5 | 1.5 | 1.0 | 1.0 |
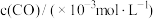 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
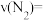
③在容积固定的绝热容器中发生反应
 ,下列能说明该反应已达到平衡状态的是
,下列能说明该反应已达到平衡状态的是A.容器内混合气体温度不再变化 B.容器内的气体压强保持不变
C.
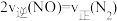 D.容器内混合气体密度保持不变
D.容器内混合气体密度保持不变(2)煤燃烧排放的烟气中含有
 和
和 ,会污染大气,形成酸雨。将
,会污染大气,形成酸雨。将 转化为重要的化工原料
转化为重要的化工原料 的原理示意图如图。催化剂a表面的电极反应式为
的原理示意图如图。催化剂a表面的电极反应式为 与加入的
与加入的 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
6 . 室温下,某溶液初始时仅溶有浓度相等的M和N,同时发生以下两个反应:① ;②
;② 。反应①的速率可表示为
。反应①的速率可表示为 ,反应②的速率可表示为
,反应②的速率可表示为 。M、Z浓度随时间变化曲线如图,下列说法正确的是
。M、Z浓度随时间变化曲线如图,下列说法正确的是

 ;②
;② 。反应①的速率可表示为
。反应①的速率可表示为 ,反应②的速率可表示为
,反应②的速率可表示为 。M、Z浓度随时间变化曲线如图,下列说法正确的是
。M、Z浓度随时间变化曲线如图,下列说法正确的是
| A.曲线b代表M的浓度随时间变化 |
| B.反应①的活化能比反应②的活化能小 |
| C.反应开始后,体系中Y和Z的浓度之比保持不变 |
D.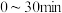 ,反应体系中X的平均生成速率约为 ,反应体系中X的平均生成速率约为 |
您最近一年使用:0次
解题方法
7 . 一定条件下,向1L刚性密闭容器中投入1molA(g)和足量的M(s)发生如下反应: ΔH(相对分子质量:M>N)。测得不同温度下B(g)的体积分数ψ(B)随时间t的变化曲线如图所示。下列说法正确的是
ΔH(相对分子质量:M>N)。测得不同温度下B(g)的体积分数ψ(B)随时间t的变化曲线如图所示。下列说法正确的是

 ΔH(相对分子质量:M>N)。测得不同温度下B(g)的体积分数ψ(B)随时间t的变化曲线如图所示。下列说法正确的是
ΔH(相对分子质量:M>N)。测得不同温度下B(g)的体积分数ψ(B)随时间t的变化曲线如图所示。下列说法正确的是
| A.ΔH>0 |
| B.温度T1,0~t1,混合气体的平均相对分子质量逐渐增大 |
| C.温度T1,再向容器中投入1molA(g),平衡时ψ(B)小于30% |
| D.温度T2,0~t1,该反应的平均反应速率v(A)=0.7mol·L-1·min-1 |
您最近一年使用:0次
解题方法
8 . 利用含有二氧化碳的工业废气为碳源合成甲醇,既可为减少二氧化碳的排放提供一种良好的解决方法,又可为甲醇的合成提供一条绿色合成的新途径。以 、
、 为原料合成
为原料合成 涉及的主要反应如下:
涉及的主要反应如下:
I.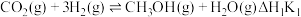
II.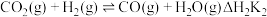
III._______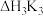
回答下列问题:
(1)已知, ,将反应III的热化学方程式补充完整:
,将反应III的热化学方程式补充完整:_______  ,同时可以推出
,同时可以推出
_______ (用含 、
、 的式子表示)。
的式子表示)。
(2)某温度下(高于100℃),向2L的恒容密闭容器中通入 和
和 发生上述反应,体系的总压强p随时间变化如下表所示。
发生上述反应,体系的总压强p随时间变化如下表所示。
①CO的分压随时间变化如图所示,则从反应开始至体系达平衡时,
_______  (保留两位有效数字)。
(保留两位有效数字)。
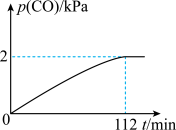
②该温度下, 的平衡浓度为
的平衡浓度为_______  ,反应III的化学平衡常数
,反应III的化学平衡常数
_______  (保留两位有效数字)。
(保留两位有效数字)。
(3)对反应I进行研究,向两恒容密闭容器中均通入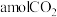 和
和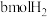 ,其一为绝热过程,另一为恒温过程,两反应体系的压强随时间的变化曲线如图所示。
,其一为绝热过程,另一为恒温过程,两反应体系的压强随时间的变化曲线如图所示。

①
_______ 0(填“>”、“<”或“=”,下同);
②化学平衡常数:
_______  ;
;
③气体总物质的量: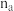
_______ 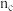 。
。
 、
、 为原料合成
为原料合成 涉及的主要反应如下:
涉及的主要反应如下:I.
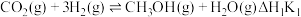
II.
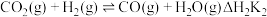
III._______
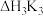
回答下列问题:
(1)已知,
 ,将反应III的热化学方程式补充完整:
,将反应III的热化学方程式补充完整: ,同时可以推出
,同时可以推出
 、
、 的式子表示)。
的式子表示)。(2)某温度下(高于100℃),向2L的恒容密闭容器中通入
 和
和 发生上述反应,体系的总压强p随时间变化如下表所示。
发生上述反应,体系的总压强p随时间变化如下表所示。| t/min | 0 | 20 | 40 | 60 | 80 | 100 | 120 | 140 |
| p/kPa | 40.0 | 36.7 | 34.2 | 32.1 | 30.8 | 30.2 | 30.0 | 30.0 |

 (保留两位有效数字)。
(保留两位有效数字)。
②该温度下,
 的平衡浓度为
的平衡浓度为 ,反应III的化学平衡常数
,反应III的化学平衡常数
 (保留两位有效数字)。
(保留两位有效数字)。(3)对反应I进行研究,向两恒容密闭容器中均通入
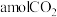 和
和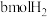 ,其一为绝热过程,另一为恒温过程,两反应体系的压强随时间的变化曲线如图所示。
,其一为绝热过程,另一为恒温过程,两反应体系的压强随时间的变化曲线如图所示。
①

②化学平衡常数:

 ;
;③气体总物质的量:
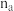
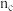 。
。
您最近一年使用:0次
2023-04-22更新
|
214次组卷
|
2卷引用:山东省滨州市2022-2023学年高二下学期2月开学考试化学试题
解题方法
9 . 某反应 的速率方程为
的速率方程为 ,其半衰期(当剩余的反应物恰好是起始的一半时所需的时间)为
,其半衰期(当剩余的反应物恰好是起始的一半时所需的时间)为 。在650K时,反应物浓度不同时的反应速率如表所示。
。在650K时,反应物浓度不同时的反应速率如表所示。
下列说法错误的是
 的速率方程为
的速率方程为 ,其半衰期(当剩余的反应物恰好是起始的一半时所需的时间)为
,其半衰期(当剩余的反应物恰好是起始的一半时所需的时间)为 。在650K时,反应物浓度不同时的反应速率如表所示。
。在650K时,反应物浓度不同时的反应速率如表所示。 | 0.025 | 0.050 | 0.025 |
 | 0.040 | 0.040 | 0.120 |
 |  |  |  |
| A.该反应可能为基元反应 |
B.该反应的速率常数 |
C.当 , , ,650K时的反应速率为 ,650K时的反应速率为 |
| D.在过量的B存在时,反应掉93.75%的A所需的时间是1200min |
您最近一年使用:0次
2023-04-22更新
|
384次组卷
|
2卷引用:山东省滨州市2022-2023学年高二下学期2月开学考试化学试题
解题方法
10 . 实验是化学研究的基础。下列关于各实验装置(夹持装置已略去)的叙述正确的是
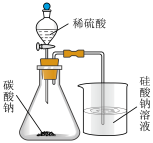 | 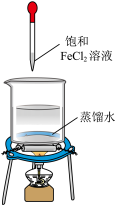 |
A.验证电离常数 | B.可用于制备氢氧化铁胶体 |
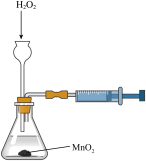 | 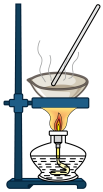 |
C.测定 分解的化学反应速率 分解的化学反应速率 | D.用 溶液制备无水 溶液制备无水 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-04-22更新
|
174次组卷
|
2卷引用:山东省滨州市2022-2023学年高二下学期2月开学考试化学试题



