解题方法
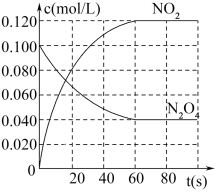
1 . 在容积为1.00L的密闭容器中,通入一定量的N2O4,发生反应:N2O4(g) 2NO2(g)。100℃时,各物质浓度随时间变化如图所示。
2NO2(g)。100℃时,各物质浓度随时间变化如图所示。
请回答:
(1)60s内,v(N2O4)=___ mol/(L•s)。
(2)若升高温度,混合气体的颜色变深,则正反应是___ (填“放热”或吸热”)反应。
(3)100℃时,该反应的化学平衡常数数值为___ 。
(4)平衡时,N2O4的转化率是___ 。
 2NO2(g)。100℃时,各物质浓度随时间变化如图所示。
2NO2(g)。100℃时,各物质浓度随时间变化如图所示。
请回答:
(1)60s内,v(N2O4)=
(2)若升高温度,混合气体的颜色变深,则正反应是
(3)100℃时,该反应的化学平衡常数数值为
(4)平衡时,N2O4的转化率是
您最近一年使用:0次
2022-09-18更新
|
480次组卷
|
3卷引用:甘肃省镇原县第二中学2021-2022学年高二上学期期中考试化学试题
名校
解题方法
2 . 某温度时,在2L恒容密闭容器中X、Y、Z三种气体的物质的量随时间的变化关系如图所示。

(1)由图中的数据分析可知,该反应的化学方程式为_______ 。
(2) 内Z的平均反应速率为
内Z的平均反应速率为_______ 。
(3)已知TiO2(s)+2C(s)+2Cl2(g)⇌TiCl4(g)+2CO(g)。若反应容器的容积为2L,4min后,测得固体的质量减少了10.4g,则Cl2的平均反应速率为_______ mol/(L·min)。(Ti的相对原子质量48)

(1)由图中的数据分析可知,该反应的化学方程式为
(2)
 内Z的平均反应速率为
内Z的平均反应速率为(3)已知TiO2(s)+2C(s)+2Cl2(g)⇌TiCl4(g)+2CO(g)。若反应容器的容积为2L,4min后,测得固体的质量减少了10.4g,则Cl2的平均反应速率为
您最近一年使用:0次
3 . 在一定温度下,2L密闭容器中加入0.4molSO2、0.3molO2,经5min后反应达平衡,测得c(SO3)=0.1mol/L。试求:
(1)用SO2表示该反应0~5min的反应速率为多少_______ ?
(2)平衡时SO2 的转化率为多少_______ ?
(3)平衡常数K为多少_______ ?
(1)用SO2表示该反应0~5min的反应速率为多少
(2)平衡时SO2 的转化率为多少
(3)平衡常数K为多少
您最近一年使用:0次
4 . I.为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
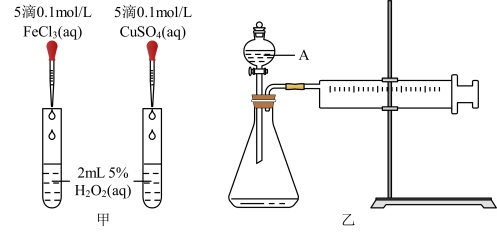
(1)定性分析:如图甲可通过观察__________ 的快慢,定性比较得出结论。有同学提出将FeCl3改为0. 05mol·L-1 Fe2 (SO4)3更为合理,其理由是____________ 。
(2)定量分析:如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。实验中需要测量的数据是________ 。
II.某温度时,在一个2L的密闭容器中, A、B、C三种气体物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:

(3)该反应的化学方程式为________ ;
(4)从开始至2min,A的平均反应速率为________ ;

(1)定性分析:如图甲可通过观察
(2)定量分析:如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。实验中需要测量的数据是
II.某温度时,在一个2L的密闭容器中, A、B、C三种气体物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:

(3)该反应的化学方程式为
(4)从开始至2min,A的平均反应速率为
您最近一年使用:0次
名校
5 . 恒温下,将amolN2与amolH2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g)+3H2(g) 2NH3(g)。
2NH3(g)。
(1)若反应进行到某时刻t时,nt(N2)=13mol,nt(NH3)=6mol,计算a的值_____ 。
(2)反应达平衡时,其中NH3的含量(体积分数为25%。计算平衡时NH3的物质的量为_____ 。
(3)原混合气体与平衡混和气体的压强比____ 。
 2NH3(g)。
2NH3(g)。(1)若反应进行到某时刻t时,nt(N2)=13mol,nt(NH3)=6mol,计算a的值
(2)反应达平衡时,其中NH3的含量(体积分数为25%。计算平衡时NH3的物质的量为
(3)原混合气体与平衡混和气体的压强比
您最近一年使用:0次
名校
6 . 在一定温度下,向体积为2L的恒容密闭容器中充入一定量的A、B发生化学反应(除物质D为固体外,其余的物质均为气体),各物质的含量随时间的变化情况如图所示,请回答下列问题:
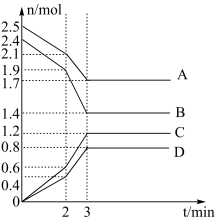
(1)写出该反应的化学方程式:___________ ,0~2min内用C表示的化学反应速率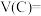
___ 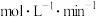 。
。
(2)该反应在2min时改变了某一条件,则该条件可能为___________ 。
(3)下列能说明反应达到平衡的是___________(填标号)。
(4)反应至某时刻,此时压强与初始压强的比值为43:49,则此时B物质的转化率为_________ %(保留三位有效数字),此时该反应________ (填“是”或“否”)达到平衡。

(1)写出该反应的化学方程式:
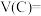
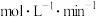 。
。(2)该反应在2min时改变了某一条件,则该条件可能为
(3)下列能说明反应达到平衡的是___________(填标号)。
| A.反应体系内气体的压强不再发生变化 |
| B.反应体系内气体的密度不再发生变化 |
| C.A与C的浓度之比为6:4 |
D.当有 被消耗的同时有 被消耗的同时有 被消耗 被消耗 |
您最近一年使用:0次
2022-07-28更新
|
584次组卷
|
2卷引用:辽宁省营口市普通高中2021-2022学年高一下学期期末化学试题
解题方法
7 . 一定温度下,在某体积为2L的密闭容器中充入1.5molNO2和2molCO,在一定条件下发生反应:NO2(g)+CO(g) CO2(g)+NO(g),2min时,测得容器中NO的物质的量为0.5mol。
CO2(g)+NO(g),2min时,测得容器中NO的物质的量为0.5mol。
(1)此段时间内,用CO2表示的平均反应速率_______ 。
(2)2min时,CO的转化率_______ 。
(3)平衡时,CO为1mol,求CO2的体积分数_______ 。
 CO2(g)+NO(g),2min时,测得容器中NO的物质的量为0.5mol。
CO2(g)+NO(g),2min时,测得容器中NO的物质的量为0.5mol。(1)此段时间内,用CO2表示的平均反应速率
(2)2min时,CO的转化率
(3)平衡时,CO为1mol,求CO2的体积分数
您最近一年使用:0次
解题方法
8 . 合成氨工业为人类解决粮食问题做出了巨大贡献。一定温度下,在2L恒容密闭容器中发生反应 ,反应过程中的部分数据如下表所示:
,反应过程中的部分数据如下表所示:
求:
(1)0~5min内用NH3表示的平均反应速率为_______ 。
(2)N2的平衡转化率_______ ;初始时与平衡时混合气体压强之比________ (要求写出具体计算过程)。
 ,反应过程中的部分数据如下表所示:
,反应过程中的部分数据如下表所示:| t/min | 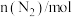 | 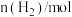 | 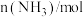 |
| 0 | 1.0 | 1.2 | 0 |
| 5 | 0.9 | 0.9 | x |
| 10 | 0.8 | y | z |
| 15 | w | 0.6 | m |
(1)0~5min内用NH3表示的平均反应速率为
(2)N2的平衡转化率
您最近一年使用:0次
9 . T℃时,在恒容密闭容器中通入 ,发生反应
,发生反应 测得容器内初始压强为40kPa,反应过程中反应速率
测得容器内初始压强为40kPa,反应过程中反应速率 、时间(t)与
、时间(t)与 分压
分压 的关系如图所示。
的关系如图所示。

(1) 时,
时, 的转化率
的转化率
_______ %
(2)反应速率满足 ,
,
_______ 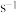 ,
,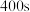 时
时
_______ 
(3)达到平衡时,测得体系的总压强 ,则该反应的平衡常数
,则该反应的平衡常数
_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
 ,发生反应
,发生反应 测得容器内初始压强为40kPa,反应过程中反应速率
测得容器内初始压强为40kPa,反应过程中反应速率 、时间(t)与
、时间(t)与 分压
分压 的关系如图所示。
的关系如图所示。
(1)
 时,
时, 的转化率
的转化率
(2)反应速率满足
 ,
,
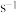 ,
,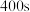 时
时

(3)达到平衡时,测得体系的总压强
 ,则该反应的平衡常数
,则该反应的平衡常数
您最近一年使用:0次
名校
10 . 在容积为2L的密闭容器中进行反应:A(g)+2B(g)⇌3C(g)+nD(g)。开始时A的物质的量为4mol,B的物质的量为6mol;5min末到达平衡状态,此时测得C的物质的量为3mol,反应前后压强之比为5:6。
(1)5min末A的物质的量浓度为_______ 。
(2)前5min内用B表示的化学反应速率v(B)为_______ 。
(3)化学方程式中n的值为_______ 。
(4)若10min后继续往容器中加入3molA和C,此时V正_______ V逆(填“>”、“<”或“=”),理由是________
(1)5min末A的物质的量浓度为
(2)前5min内用B表示的化学反应速率v(B)为
(3)化学方程式中n的值为
(4)若10min后继续往容器中加入3molA和C,此时V正
您最近一年使用:0次
2022-06-22更新
|
393次组卷
|
2卷引用:浙江省宁波效实中学2021-2022学年高一下学期期中考试化学(选考)试题



