解题方法
1 . Bodensteins研究了反应: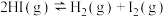
 ,在716 K时,气体混合物中碘化氢的物质的量分数
,在716 K时,气体混合物中碘化氢的物质的量分数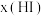 与反应时间t的关系如表所示:
与反应时间t的关系如表所示:
(1)根据上述实验结果,该反应的平衡常数K的计算式为_______ 。
(2)上述反应中,正反应速率 ,逆反应速率
,逆反应速率 ,其中
,其中 、
、 为正、逆反应速率常数,则
为正、逆反应速率常数,则 为
为_______ (用含K和 的代数式表示)。若起始时,
的代数式表示)。若起始时, ,
, ,则在
,则在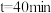 时,
时,
_______ 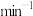 。
。
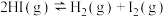
 ,在716 K时,气体混合物中碘化氢的物质的量分数
,在716 K时,气体混合物中碘化氢的物质的量分数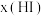 与反应时间t的关系如表所示:
与反应时间t的关系如表所示: | 0 | 20 | 40 | 60 | 80 | 120 |
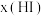 | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
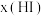 | 0 | 0.6 | 0.73 | 0.773 | 0.78 | 0.784 |
(2)上述反应中,正反应速率
 ,逆反应速率
,逆反应速率 ,其中
,其中 、
、 为正、逆反应速率常数,则
为正、逆反应速率常数,则 为
为 的代数式表示)。若起始时,
的代数式表示)。若起始时, ,
, ,则在
,则在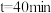 时,
时,
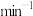 。
。
您最近一年使用:0次
2021-08-01更新
|
575次组卷
|
4卷引用:人教版(2019)高二化学选择性必修1第二章 化学反应速率与化学平衡 第二节 化学平衡 课时2 化学平衡常数及相关计算
人教版(2019)高二化学选择性必修1第二章 化学反应速率与化学平衡 第二节 化学平衡 课时2 化学平衡常数及相关计算选择性必修1(SJ)专题2第二单元课时3 化学平衡常数平衡转化率(已下线)必考点03 化学平衡-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版2019选择性必修1)2.2.3化学平衡常数 课后
名校
解题方法
2 . 氢气既是一种清洁能源,又是重要的化工原料。回答下列问题:
(1)已知:断裂1 molH-H、1 mol O=O、1 molH-O键吸收的能量依次为436 kJ、498 kJ、467 kJ。在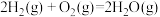 反应中,44.8 LH2 (标准状况)恰好完全反应放出的能量为
反应中,44.8 LH2 (标准状况)恰好完全反应放出的能量为___________ kJ。
(2)实验室用锌粒和稀硫酸反应制备氢气。
①其他条件相同,粗锌制备氢气的速率___________ 纯锌(填“大于”“小于”或“等于”)。
②其他条件相同,相同质量的锌粉和锌粒分别与足量1 mol/L硫酸溶液反应产生氢气的体积与时间的关系如图所示。曲线Ⅱ代表___________ (填“锌粉”或“锌粒”)。

(3)氢氧燃料电池的能量转化率较高,工作原理如图所示。

放电时,负极反应式为___________ ;刚开始放电时,正极附近电解质溶液的pH___________ (填“升高”“降低”或“不变”)。
(4)工业上常利用合成气(H2、CO)合成甲醇,原理为 。一定温度下,向体积为2 L的恒容密闭容器中充入2 mol H2和1 mol CO,在不同催化剂
。一定温度下,向体积为2 L的恒容密闭容器中充入2 mol H2和1 mol CO,在不同催化剂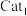 、
、 作用下反应,测得CH3OH的浓度与时间的关系如图所示。
作用下反应,测得CH3OH的浓度与时间的关系如图所示。
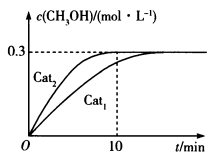
①催化效率:Cat1______ Cat2 (填“>”“<”或“=”)。
②0~10 min内, 作用下用H2表示的平均反应速率v(H2)=
作用下用H2表示的平均反应速率v(H2)=___________ 。
③该温度及Cat2作用下,达到平衡时CO的转化率为___________ (A的平衡转化率 )。
)。
(1)已知:断裂1 molH-H、1 mol O=O、1 molH-O键吸收的能量依次为436 kJ、498 kJ、467 kJ。在
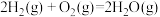 反应中,44.8 LH2 (标准状况)恰好完全反应放出的能量为
反应中,44.8 LH2 (标准状况)恰好完全反应放出的能量为(2)实验室用锌粒和稀硫酸反应制备氢气。
①其他条件相同,粗锌制备氢气的速率
②其他条件相同,相同质量的锌粉和锌粒分别与足量1 mol/L硫酸溶液反应产生氢气的体积与时间的关系如图所示。曲线Ⅱ代表

(3)氢氧燃料电池的能量转化率较高,工作原理如图所示。

放电时,负极反应式为
(4)工业上常利用合成气(H2、CO)合成甲醇,原理为
 。一定温度下,向体积为2 L的恒容密闭容器中充入2 mol H2和1 mol CO,在不同催化剂
。一定温度下,向体积为2 L的恒容密闭容器中充入2 mol H2和1 mol CO,在不同催化剂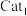 、
、 作用下反应,测得CH3OH的浓度与时间的关系如图所示。
作用下反应,测得CH3OH的浓度与时间的关系如图所示。
①催化效率:Cat1
②0~10 min内,
 作用下用H2表示的平均反应速率v(H2)=
作用下用H2表示的平均反应速率v(H2)=③该温度及Cat2作用下,达到平衡时CO的转化率为
 )。
)。
您最近一年使用:0次
2021-07-21更新
|
831次组卷
|
3卷引用:河南省平顶山市2020-2021学年高一下学期期末调研考试化学试题
解题方法
3 . 为了更好地利用化学反应中物质和能量的变化,在化学研究和工业生产中还需要关注化学反应的快慢和限度。能量、速率与限度是认识和研究化学反应的重要因素。
Ⅰ.某温度下,在2 L的恒容密闭容器中,A、B、C(均为气体)三种物质的物质的量随时间的变化曲线如图所示。

(1)该反应的化学方程式为___________ 。
(2)能说明此时反应已达到了平衡状态的是___________ (填标号)。
a.A、B、C三种物质的浓度保持不变
b.气体A的消耗速率等于气体C的生成速率
c.混合气体的密度不变
d.总压强不变
Ⅱ.某温度下,向2.0 L的恒容密闭容器中充入2.0 molN2和2.0 molH2,发生反应,一段时间后反应达到平衡状态,实验数据如下表所示:
(3)0~50 s内的平均反应速率v(N2)=___________  。
。
(4)键能指在标准状况下,将1 mol气态分子AB(g)解离为气态原子A(g)、B(g)所需的能量,用符号E表示,单位为 ,已知N≡N键的键能为946 kJ/mol,H-H键的键能为436 kJ/mol,N-H键的键能为391 kJ/mol。则生成1 mol NH3的过程中
,已知N≡N键的键能为946 kJ/mol,H-H键的键能为436 kJ/mol,N-H键的键能为391 kJ/mol。则生成1 mol NH3的过程中___________ (填“吸收”或“放出”)的能量为___________  。
。
(5)为加快反应速率,可采取的措施是___________ (填标号)。
a.升高温度 b.增大容器体积 c.恒容时充入He d.加入合适催化剂
Ⅰ.某温度下,在2 L的恒容密闭容器中,A、B、C(均为气体)三种物质的物质的量随时间的变化曲线如图所示。

(1)该反应的化学方程式为
(2)能说明此时反应已达到了平衡状态的是
a.A、B、C三种物质的浓度保持不变
b.气体A的消耗速率等于气体C的生成速率
c.混合气体的密度不变
d.总压强不变
Ⅱ.某温度下,向2.0 L的恒容密闭容器中充入2.0 molN2和2.0 molH2,发生反应,一段时间后反应达到平衡状态,实验数据如下表所示:
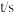 | 0 | 50 | 150 | 250 | 350 |
| n(NH3)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
 。
。(4)键能指在标准状况下,将1 mol气态分子AB(g)解离为气态原子A(g)、B(g)所需的能量,用符号E表示,单位为
 ,已知N≡N键的键能为946 kJ/mol,H-H键的键能为436 kJ/mol,N-H键的键能为391 kJ/mol。则生成1 mol NH3的过程中
,已知N≡N键的键能为946 kJ/mol,H-H键的键能为436 kJ/mol,N-H键的键能为391 kJ/mol。则生成1 mol NH3的过程中 。
。(5)为加快反应速率,可采取的措施是
a.升高温度 b.增大容器体积 c.恒容时充入He d.加入合适催化剂
您最近一年使用:0次
解题方法
4 . 氮元素的单质及其化合物是化学研究的热点。回答下列问题:
(1)肼(N2H4,常温下为液态)是火箭的传统燃料之一,某N2H4-O2原电池的工作原理如图甲。

①a极的电极反应式为_______ 。
②该电池工作时,若有2 mol电子流经外电路,则被还原的O2体积为_______ L(标准状况下)。
(2)一定温度时,在体积为2 L的恒容反应器中发生反应: ,A、B物质的量随时间的变化曲线如图乙所示。
,A、B物质的量随时间的变化曲线如图乙所示。
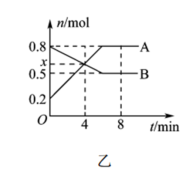
①A为_______ (填化学式)。
②4 min时,v正_______ (填“>”“<”或“=”) v逆。
③ 内该反应的平均反应速率v(H2)=
内该反应的平均反应速率v(H2)=_______ (保留两位有效数字) 。
。
④
_______ ,反应进行4 min时,N2的转化率为_______  。
。
(1)肼(N2H4,常温下为液态)是火箭的传统燃料之一,某N2H4-O2原电池的工作原理如图甲。

①a极的电极反应式为
②该电池工作时,若有2 mol电子流经外电路,则被还原的O2体积为
(2)一定温度时,在体积为2 L的恒容反应器中发生反应:
 ,A、B物质的量随时间的变化曲线如图乙所示。
,A、B物质的量随时间的变化曲线如图乙所示。
①A为
②4 min时,v正
③
 内该反应的平均反应速率v(H2)=
内该反应的平均反应速率v(H2)= 。
。④

 。
。
您最近一年使用:0次
2021-07-17更新
|
703次组卷
|
4卷引用:安徽省合肥市六校2020-2021学年高一下学期期末联考化学试题
名校
5 . 一定温度下,在容积为VL的密闭容器中进行反应,M、N两种气体的物质的量随时间的变化曲线如图所示:
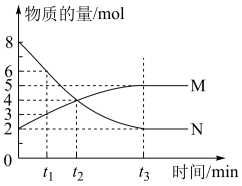
(1)该反应的化学反应方程式是___________ ;
(2) t 1到t 2时刻,以M的浓度变化表示的平均反应速率为:___________ ;
(3)若达到平衡状态的时间是4 min,N物质在该4 min内的平均反应速率为1.5mol⋅L−1⋅min−1,则此容器的容积为V=___________ L;
(4)反应A(g)+B(g) ⇌2C(g),当改变下列条件时,会加快反应速率的是___________ (填序号)
①降低温度 ②保持容器的体积不变,充入氦气
③加入催化剂 ④保持容器的体积不变,增加A(g)的物质的量
(5)用 和
和 组合形成的质子交换膜燃料电池的结构如图:
组合形成的质子交换膜燃料电池的结构如图:
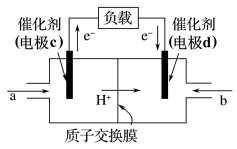
①则电极d是___________  填“正极”或“负极”),电极d的电极反应式为
填“正极”或“负极”),电极d的电极反应式为___________ ;
②若线路中转移2mol电子,则该燃料电池理论上消耗的 在标准状况下的体积为
在标准状况下的体积为___________ L。

(1)该反应的化学反应方程式是
(2) t 1到t 2时刻,以M的浓度变化表示的平均反应速率为:
(3)若达到平衡状态的时间是4 min,N物质在该4 min内的平均反应速率为1.5mol⋅L−1⋅min−1,则此容器的容积为V=
(4)反应A(g)+B(g) ⇌2C(g),当改变下列条件时,会加快反应速率的是
①降低温度 ②保持容器的体积不变,充入氦气
③加入催化剂 ④保持容器的体积不变,增加A(g)的物质的量
(5)用
 和
和 组合形成的质子交换膜燃料电池的结构如图:
组合形成的质子交换膜燃料电池的结构如图:
①则电极d是
 填“正极”或“负极”),电极d的电极反应式为
填“正极”或“负极”),电极d的电极反应式为②若线路中转移2mol电子,则该燃料电池理论上消耗的
 在标准状况下的体积为
在标准状况下的体积为
您最近一年使用:0次
2021-07-09更新
|
825次组卷
|
4卷引用:安徽省安庆市2020-2021学年高一下学期期末考试化学试题
6 . 化学反应速率与限度在生产生活中的运用广泛。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,他在100 mL稀盐酸中加入足量的锌粉,用排水集气法收集反应生成的氢气(标准状况),实验记录如下表(累计值):
在0~1 min、1~2 min、2~3min、3~4 min、4~5 min时间段中,反应速率最大的时间段是___________ ,原因为___________ 。
(2)反应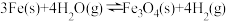 在一容积可变的密闭容器中进行,达到平衡后,增加Fe的量,其正反应速率
在一容积可变的密闭容器中进行,达到平衡后,增加Fe的量,其正反应速率___________ (填“增大”、“不变”或“减小”,下同),保持体积不变,充入Ar使体系压强增大,其逆反应速率___________ 。
(3)一定温度下,将3 mol气体A和1 mol气体B通入一体积为2 L的恒容密闭容器中,发生反应: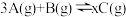 。1 min时,测得剩余1.8 mol A,C的浓度为0.4 mol/L。
。1 min时,测得剩余1.8 mol A,C的浓度为0.4 mol/L。
①x=___________ 。
②反应经2 min达到平衡,平衡时C的浓度___________ (填“大于”、“小于”或“等于”)1 mol/L。
③达到平衡时,容器内混合气体总压强为p,混合气体起始压强为p0。请用p0、p来表示达到平衡时反应物A的转化率:___________ 。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,他在100 mL稀盐酸中加入足量的锌粉,用排水集气法收集反应生成的氢气(标准状况),实验记录如下表(累计值):
| 时间/min | 1 | 2 | 3 | 4 | 5 |
| 氢气体积/mL | 50 | 120 | 232 | 290 | 310 |
(2)反应
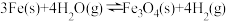 在一容积可变的密闭容器中进行,达到平衡后,增加Fe的量,其正反应速率
在一容积可变的密闭容器中进行,达到平衡后,增加Fe的量,其正反应速率(3)一定温度下,将3 mol气体A和1 mol气体B通入一体积为2 L的恒容密闭容器中,发生反应:
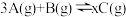 。1 min时,测得剩余1.8 mol A,C的浓度为0.4 mol/L。
。1 min时,测得剩余1.8 mol A,C的浓度为0.4 mol/L。①x=
②反应经2 min达到平衡,平衡时C的浓度
③达到平衡时,容器内混合气体总压强为p,混合气体起始压强为p0。请用p0、p来表示达到平衡时反应物A的转化率:
您最近一年使用:0次
名校
解题方法
7 . 某温度时,在2 L密闭容器中充入NO与O2,反应过程中各物质的物质的量随时间的变化关系如图所示。

(1)NO与O2反应的化学方程式是_______ ,反应现象是_______ 。
(2)上图中表示NO的曲线是_______ (填序号),在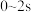 内用NO表示的平均反应速率是
内用NO表示的平均反应速率是_______ 。
(3)为加快该反应的速率,可采取的一种措施是_______ 。
(4)已知该反应为放热反应,下图中能正确表示该反应中能量变化的是_______ (填序号)。
A. B.
B. C.
C.

(1)NO与O2反应的化学方程式是
(2)上图中表示NO的曲线是
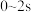 内用NO表示的平均反应速率是
内用NO表示的平均反应速率是(3)为加快该反应的速率,可采取的一种措施是
(4)已知该反应为放热反应,下图中能正确表示该反应中能量变化的是
A.
 B.
B. C.
C.
您最近一年使用:0次
2021-07-05更新
|
322次组卷
|
2卷引用:山西省太原市2020-2021学年高一下学期期末考试化学试题
8 . 反应体系为气体、催化剂为固体的异相催化反应很普遍。设气体在均匀的固体催化剂表面发生单层吸附,各吸附活性中心能量相同,忽略吸附粒子间相互作用,吸附平衡常数不随压力变化。
(1)理想气体X在180 K和3.50 × 105Pa条件下,1 g固体的吸附量为1.242 cm3.在240 K达到相同的吸附量时,需要将压力增加到1.02MPa。估算X在该固体表面的摩尔吸附焓变________ (假设此温度范围内摩尔吸附焓变为定值)。
(2)已知反应A(g)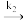 B(g)的反应机理为: A(g)+*
B(g)的反应机理为: A(g)+* 
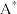
 >B(g)+*,其中*表示固体催化剂表面的活性中心。每个活性中心只能吸附一个气态分 子A(g),形成吸附态分子
>B(g)+*,其中*表示固体催化剂表面的活性中心。每个活性中心只能吸附一个气态分 子A(g),形成吸附态分子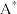 。
。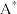 可直接转化生成气相产物B,该表面反应为决速步骤。吸附态
可直接转化生成气相产物B,该表面反应为决速步骤。吸附态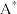 的浓度用表面覆盖度(
的浓度用表面覆盖度( 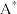 分子所占据的活性中心个数与表面活性中心总个数之比)表示。在298 K测量A(g)
分子所占据的活性中心个数与表面活性中心总个数之比)表示。在298 K测量A(g) 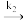 B(g)反应速率常数k2,高压下为5 kPa·s-1,低压下为0.1s-1.试计算气体A分压为50 kPa时,由A生成B的反应速率
B(g)反应速率常数k2,高压下为5 kPa·s-1,低压下为0.1s-1.试计算气体A分压为50 kPa时,由A生成B的反应速率________ 。
(3)假如产物B也发生表面吸附,反应机理变为:
A(g) + *
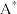
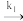

 B(g) + *
B(g) + *
其中由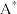 生成
生成 的表面反应为决速步骤。假设ka,kd, k1都和问题(2)中的相同。当产物B的分压pB远大于pA时,A(g)
的表面反应为决速步骤。假设ka,kd, k1都和问题(2)中的相同。当产物B的分压pB远大于pA时,A(g) 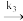 B(g)的反应对于A来说是一级反应,且速率常数k3可表达为pB的函数:K3=
B(g)的反应对于A来说是一级反应,且速率常数k3可表达为pB的函数:K3= kPa·s-1
kPa·s-1
求B(g)在催化剂上的吸附平衡常数KB = ka1/kg1________ 。
(1)理想气体X在180 K和3.50 × 105Pa条件下,1 g固体的吸附量为1.242 cm3.在240 K达到相同的吸附量时,需要将压力增加到1.02MPa。估算X在该固体表面的摩尔吸附焓变
(2)已知反应A(g)
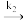 B(g)的反应机理为: A(g)+*
B(g)的反应机理为: A(g)+* 
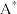
 >B(g)+*,其中*表示固体催化剂表面的活性中心。每个活性中心只能吸附一个气态分 子A(g),形成吸附态分子
>B(g)+*,其中*表示固体催化剂表面的活性中心。每个活性中心只能吸附一个气态分 子A(g),形成吸附态分子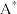 。
。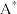 可直接转化生成气相产物B,该表面反应为决速步骤。吸附态
可直接转化生成气相产物B,该表面反应为决速步骤。吸附态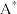 的浓度用表面覆盖度(
的浓度用表面覆盖度( 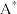 分子所占据的活性中心个数与表面活性中心总个数之比)表示。在298 K测量A(g)
分子所占据的活性中心个数与表面活性中心总个数之比)表示。在298 K测量A(g) 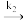 B(g)反应速率常数k2,高压下为5 kPa·s-1,低压下为0.1s-1.试计算气体A分压为50 kPa时,由A生成B的反应速率
B(g)反应速率常数k2,高压下为5 kPa·s-1,低压下为0.1s-1.试计算气体A分压为50 kPa时,由A生成B的反应速率(3)假如产物B也发生表面吸附,反应机理变为:
A(g) + *

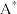
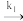

 B(g) + *
B(g) + *其中由
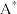 生成
生成 的表面反应为决速步骤。假设ka,kd, k1都和问题(2)中的相同。当产物B的分压pB远大于pA时,A(g)
的表面反应为决速步骤。假设ka,kd, k1都和问题(2)中的相同。当产物B的分压pB远大于pA时,A(g) 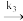 B(g)的反应对于A来说是一级反应,且速率常数k3可表达为pB的函数:K3=
B(g)的反应对于A来说是一级反应,且速率常数k3可表达为pB的函数:K3= kPa·s-1
kPa·s-1求B(g)在催化剂上的吸附平衡常数KB = ka1/kg1
您最近一年使用:0次
名校
解题方法
9 . 将气体A、B置于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g) 2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol。
2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol。
(1)用C表示10s内反应的平均反应速率为___ 。
(2)反应前A的物质的量浓度是___ 。
(3)10s末,生成物D的浓度为___ 。
(4)A与B的平衡转化率之比为___ 。
(5)平衡后,若改变下列条件,生成D的速率如何变化(填“增大”、“减小”或“不变”):降低温度___ ;增大A的浓度___ ;恒容下充入氖气___ 。
 2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol。
2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol。(1)用C表示10s内反应的平均反应速率为
(2)反应前A的物质的量浓度是
(3)10s末,生成物D的浓度为
(4)A与B的平衡转化率之比为
(5)平衡后,若改变下列条件,生成D的速率如何变化(填“增大”、“减小”或“不变”):降低温度
您最近一年使用:0次
2021-06-30更新
|
551次组卷
|
2卷引用:广西玉林市直六所普通高中2020-2021学年高一下学期期中联合考试化学试题
解题方法
10 . 常见的氮氧化物有一氧化氮、二氧化氮、一氧化二氮(N2O)、五氧化二氮(N2O5)等。
(1)在一定条件下,氮气与氧气反应生成1 mol一氧化氮气体,吸收90 kJ的热。该反应的热化学方程式为:N2(g)+O2(g)=2NO(g) ΔH=___________ kJ·mol−1
(2)在2 L密闭容器内,800℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间变化如下表:
2NO2(g)体系中,n(NO)随时间变化如下表:
①用NO表示0~2s内该反应的平均速率v(NO)=___________ mol·L−1·s−1。
②下列措施能够使该反应速率加快的是___________ 。
a.降低温度 b.使用催化剂 c.减小压强
③若上述反应在恒容的密闭容器中进行,下列叙述中能说明该反应已达平衡状态的是___________ 。
a.混合气体的颜色保持不变
b.c(NO)∶c(O2)=2∶1
c.每消耗1 mol O2的同时生成2 mol NO2
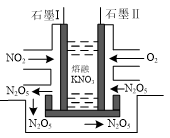
(3)NO2、O2和熔融KNO3可制作燃料电池,其原理如图所示。该电池在放电过程中石墨I电极上生成可循环使用的氧化物N2O5。
①放电时,该电池的负极是___________ (填“石墨Ⅰ”或“石墨Ⅱ”)。
②若电路中有1 mol电子转移,则理论上石墨Ⅱ处需消耗标准状况下的O2___________ L。
(1)在一定条件下,氮气与氧气反应生成1 mol一氧化氮气体,吸收90 kJ的热。该反应的热化学方程式为:N2(g)+O2(g)=2NO(g) ΔH=
(2)在2 L密闭容器内,800℃时反应2NO(g)+O2(g)
 2NO2(g)体系中,n(NO)随时间变化如下表:
2NO2(g)体系中,n(NO)随时间变化如下表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
①用NO表示0~2s内该反应的平均速率v(NO)=
②下列措施能够使该反应速率加快的是
a.降低温度 b.使用催化剂 c.减小压强
③若上述反应在恒容的密闭容器中进行,下列叙述中能说明该反应已达平衡状态的是
a.混合气体的颜色保持不变
b.c(NO)∶c(O2)=2∶1
c.每消耗1 mol O2的同时生成2 mol NO2
(3)NO2、O2和熔融KNO3可制作燃料电池,其原理如图所示。该电池在放电过程中石墨I电极上生成可循环使用的氧化物N2O5。
①放电时,该电池的负极是
②若电路中有1 mol电子转移,则理论上石墨Ⅱ处需消耗标准状况下的O2

您最近一年使用:0次
2021-06-27更新
|
677次组卷
|
2卷引用:江苏省扬州市2020-2021学年高一下学期期末考试化学试题



