真题
名校
1 . 氢气与氧气生成水的反应是氢能源应用的重要途径。下列有关说法正确的是
| A.一定温度下,反应2H2(g)+O2(g) =2H2O(g)能自发进行,该反应的ΔH<0 |
| B.氢氧燃料电池的负极反应为O2+2H2O+4e−=4OH− |
| C.常温常压下,氢氧燃料电池放电过程中消耗11.2 L H2,转移电子的数目为6.02×1023 |
| D.反应2H2(g)+O2(g) =2H2O(g)的ΔH可通过下式估算:∆H=反应中形成新共价键的键能之和-反应中断裂旧共价键的键能之和 |
您最近一年使用:0次
2019-06-10更新
|
5096次组卷
|
30卷引用:湖北省荆州中学2020-2021学年高二12月月考化学试题
湖北省荆州中学2020-2021学年高二12月月考化学试题陕西省渭南市临渭区尚德中学2020届高三上学期第三次月考化学试题陕西省西安中学2020届高三上学期第三次月考化学试题湖南省衡阳市第二十六中学2021届高三上学期9月月考化学试题江苏省苏州市新草桥中学2019-2020学年高二下学期6月月考化学试题(已下线)【浙江新东方】高中化学20210304-003安徽省淮北市树人高级中学2020-2021学年高二上学期第四阶段考试化学试题天津市武清区城关中学2023-2024学年高三上学期第二次阶段性练习化学试题重庆十八中两江实验中学校2022-2023学年高二上学期第一次月考化学试题2019年江苏省高考化学试题(已下线)专题07 化学反应中的能量变化——2019年高考真题和模拟题化学分项汇编山西省祁县第二中学校2020届高三上学期期中考试化学试题2019年秋高三化学复习强化练习——化学反应的方向及判断(已下线)专题九 化学能与热能(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训广西桂林市第十八中学2019-2020学年高二下学期开学考试化学试题(已下线)第六章能力提升检测卷-2021年高考化学一轮复习讲练测江苏省镇江市吕叔湘中学2019-2020学年高二下学期期中考试化学试题(已下线)小题必刷23 焓变与热化学方程式——2021年高考化学一轮复习小题必刷(通用版)(已下线)小题必刷24 盖斯定律及反应热计算——2021年高考化学一轮复习小题必刷(通用版)重庆市缙云教育联盟2020-2021学年高二上学期期末考试化学试题辽宁省沈阳市郊联体2021届高三上学期期末考试化学试题黑龙江省哈尔滨市呼兰区第一中学校等三校2020-2021学年高二上学期期末联考化学试题(已下线)专题05 化学反应与能量——备战2021年高考化学纠错笔记(已下线)【镇江新东方】高二下21心湖期中(已下线)课时29 盖斯定律及反应热计算-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点17 化学反应的热效应-备战2023年高考化学一轮复习考点帮(全国通用)福建省厦门第一中学2020-2021学年高二上学期期中考试化学试题(已下线)2019年高考江苏卷化学试题变式题(不定项选择题)
名校
2 . 25℃和1.01105 Pa时,2N2O5(g) = 4NO2(g) + O2(g) △H=+56.76 kJ/mol,该反应能自发进行的原因是( )
| A.是吸热反应 | B.是放热反应 | C.是熵增大的反应 | D.是熵减少的反应 |
您最近一年使用:0次
2019-04-25更新
|
199次组卷
|
4卷引用:湖北省孝感市新高考联考协作体2022-2023学年高二上学期9月联考化学试题
真题
名校
3 . 运用相关化学知识进行判断,下列结论错误的是
| A.某吸热反应能自发进行,因此该反应是熵增反应 |
| B.NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中 |
| C.可燃冰主要甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底 |
| D.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率 |
您最近一年使用:0次
2019-01-30更新
|
1642次组卷
|
18卷引用:2015届湖北省黄冈中学高三5月模拟考试理综化学试卷
2015届湖北省黄冈中学高三5月模拟考试理综化学试卷2015届河北省衡水冀州中学高三12月月考化学试卷内蒙古北京八中乌兰察布分校2017-2018学年高二下学期第二次调研考试化学试题山西省朔州市怀仁一中2018-2019学年高二上学期第五次月考化学试题2014年全国普通高等学校招生统一考试理科综合能力测试化学(天津卷)2015届云南省红河州弥勒二中高三上学期期中考试化学试卷2015-2016学年江西省吉安一中高二上期中(理)化学试卷2016届陕西省西安铁一中高三上12月模拟化学试卷2015-2016学年江西省赣州市高二上学期期末考试化学试卷2017届河南省郑州一中高三上期中化学试卷青海省平安县第一高级中学2016-2017学年高二下学期期中考试化学试题内蒙古巴彦淖尔市杭锦后旗奋斗中学2017-2018学年高三第一学期第四次月考(期末)化学试题(已下线)2019高考备考一轮复习精品资料 第四章 常见的非金属及其化合物 第1讲 碳、硅及其无机非金属材料【教学案】(已下线)2019高考热点题型和提分秘籍 第四章 常见的非金属及其化合物 第1讲 碳、硅及无机非金属材料 (教学案)(已下线)2019高考备考二轮复习精品资料-专题6 非金属及其化合物(教学案)(已下线)2019高考备考二轮复习精品资料-专题9 化学反应速率与化学平衡(教学案)2020届高三化学选修4二轮专题练——化学反应的方向和限度【选择精编25题】福建省福州福清市2017-2018学年高二上学期期末考试化学试题
名校
4 . 反应Fe(s)+CO2(g) FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g) FeO(s)+H2(g)的平衡常数为K2。在不同温度时K1、K2的值如下表:
FeO(s)+H2(g)的平衡常数为K2。在不同温度时K1、K2的值如下表:
(1)计算温度为973K时,反应CO2(g)+H2(g) CO(g)+H2O(g) K=
CO(g)+H2O(g) K=__________ ;
(2)目前工业上有一种方法是用CO2来生产甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g), 在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2进行反应。
CH3OH(g)+H2O(g), 在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2进行反应。
①该反应能够自发进行的原因是___________________________ 。
②下列措施中能使c(CH3OH)增大的是________ 。
a.降低温度 b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来 d.再充入1 mol CO2和3 mol H2
③在温度T1时,当反应达到平衡时,测得n(H2)=2.4 mol;其他条件不变,在温度T2时,当反应达到平衡时,测得n(CO2)=0.82 mol,则T2________ T1(填“>”、“<”或“=”)。
(3)某实验将一定量的CO2和H2充入一定体积的密闭容器中,在两种不同条件下发生反应:CO2(g) +3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。测得CH3OH的物质的量随时间变化如下图所示,回答问题:
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。测得CH3OH的物质的量随时间变化如下图所示,回答问题:
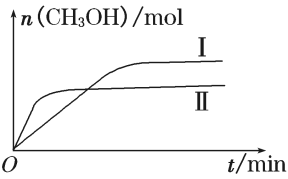
①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ________ KⅡ(填“>”、“<”或“=”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式投入反应物,一段时间后达到平衡。
若甲中平衡后气体的压强为开始时的0.8倍,要使平衡后乙与甲中相同组分的浓度相等,且起始时维持反应逆向进行,则c的取值范围为________________ 。
 FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g) FeO(s)+H2(g)的平衡常数为K2。在不同温度时K1、K2的值如下表:
FeO(s)+H2(g)的平衡常数为K2。在不同温度时K1、K2的值如下表:| 温度(绝对温度) | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
(1)计算温度为973K时,反应CO2(g)+H2(g)
 CO(g)+H2O(g) K=
CO(g)+H2O(g) K=(2)目前工业上有一种方法是用CO2来生产甲醇:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g), 在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2进行反应。
CH3OH(g)+H2O(g), 在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2进行反应。①该反应能够自发进行的原因是
②下列措施中能使c(CH3OH)增大的是
a.降低温度 b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来 d.再充入1 mol CO2和3 mol H2
③在温度T1时,当反应达到平衡时,测得n(H2)=2.4 mol;其他条件不变,在温度T2时,当反应达到平衡时,测得n(CO2)=0.82 mol,则T2
(3)某实验将一定量的CO2和H2充入一定体积的密闭容器中,在两种不同条件下发生反应:CO2(g) +3H2(g)
 CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。测得CH3OH的物质的量随时间变化如下图所示,回答问题:
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。测得CH3OH的物质的量随时间变化如下图所示,回答问题:
①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式投入反应物,一段时间后达到平衡。
| 容器 | 甲 | 乙 |
| 反应物 投入量 | 1 mol CO2、3 mol H2 | a mol CO2、b mol H2、 c mol CH3OH(g)、c mol H2O(g) |
若甲中平衡后气体的压强为开始时的0.8倍,要使平衡后乙与甲中相同组分的浓度相等,且起始时维持反应逆向进行,则c的取值范围为
您最近一年使用:0次
名校
5 . 下列说法不正确的是
| A.Na与H2O的反应是熵增的放热反应,该反应能自发进行 |
| B.原电池中发生的反应达到平衡时,该电池无电流产生 |
| C.FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同 |
D.Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s) Mg2+(aq)+2OH-(aq),其可溶于NH4Cl溶液 Mg2+(aq)+2OH-(aq),其可溶于NH4Cl溶液 |
您最近一年使用:0次
名校
解题方法
6 . 我国钒钛磁铁矿分布广泛,储量丰富,不仅是铁的重要来源,其中伴生的钛、钒、铝等多种成分还具有很高的利用价值。其尾矿是工业提取钛的重要来源
I.钒钛磁铁矿的尾矿(主要成分为FeTiO3,还含有少量FeO、Al2O3、SiO2 等杂质) 经选矿后得到钛精矿过一系列反应制得TiO2:

(1)氢氧化钠净化尾矿的目的是_________________________________ 。
(2)写出钛精矿中FeTiO3与80%硫酸溶液反应的化学方程式:___________________ 。
Ⅱ.以TiO2 为原料制备金属钛,流程如下: TiO2→TiCl4→Ti
(3)已知反应:TiO2(s)十2Cl2(g)=TiCl4(l)十O2(g) △H=十151kJ/mol,但不能由TiO2和Cl2直接反应(即氯化反应)来制取TiCl4试解释原因:___________________________________ 。
(4)当往氯化反应体系中加入碳后,使得该反应在高温条件下能顺利制得TiCl4,从化学平衡的角度解释其原因___________________________________________ 。
(5)已知碳的燃烧热394kJ/mol,请写出TiO2 与Cl2、C反应制取TiCl4的热化学方程式_____________ 。
Ⅲ.以TiO2为原料可以制备Li4Ti5O12(一种锂离子电池的电极材料),过程如下:

(6)不同温度下,TiO2·xH2O与双氧水、氨水反应达到平衡所得实验结果如下表所示:
该过程的理想温度为_______________ ,分析表中数据,解释TiO2·xH2O的转化率随温度变化的原因:_______________________________________ ,该反应的离子方程式为________________________ 。
I.钒钛磁铁矿的尾矿(主要成分为FeTiO3,还含有少量FeO、Al2O3、SiO2 等杂质) 经选矿后得到钛精矿过一系列反应制得TiO2:

(1)氢氧化钠净化尾矿的目的是
(2)写出钛精矿中FeTiO3与80%硫酸溶液反应的化学方程式:
Ⅱ.以TiO2 为原料制备金属钛,流程如下: TiO2→TiCl4→Ti
(3)已知反应:TiO2(s)十2Cl2(g)=TiCl4(l)十O2(g) △H=十151kJ/mol,但不能由TiO2和Cl2直接反应(即氯化反应)来制取TiCl4试解释原因:
(4)当往氯化反应体系中加入碳后,使得该反应在高温条件下能顺利制得TiCl4,从化学平衡的角度解释其原因
(5)已知碳的燃烧热394kJ/mol,请写出TiO2 与Cl2、C反应制取TiCl4的热化学方程式
Ⅲ.以TiO2为原料可以制备Li4Ti5O12(一种锂离子电池的电极材料),过程如下:

(6)不同温度下,TiO2·xH2O与双氧水、氨水反应达到平衡所得实验结果如下表所示:
| 温度/℃ | 30 | 35 | 40 | 45 | 50 |
| TiO2·xH2O 的转化率 | 80% | 90% | 97% | 93% | 82% |
您最近一年使用:0次
名校
7 . 下列有关说法不正确的是( )
| A.Na与H2O的反应是熵增的放热反应,该反应能自发进行 |
| B.某吸热反应能自发进行,因此该反应一定是熵增反应 |
| C.通常情况下,一个放热且熵增的反应也有可能非自发进行 |
| D.反应NH3(g)+HCl(g)====NH4Cl(s)在室温下可自发进行,则该反应的ΔH <0 |
您最近一年使用:0次
2017-10-27更新
|
590次组卷
|
15卷引用:湖北省新高考联考协作体2021-2022学年高二上学期10月联考化学试题
湖北省新高考联考协作体2021-2022学年高二上学期10月联考化学试题湖北省华中师范大学第一附属中学2023-2024学年高二上学期10月月考化学试题江西省宜春市上高二中2017-2018学年高二第一次月考化学试题【全国百强校】黑龙江省牡丹江市第一高级中学2018-2019学年高二(理)10月月考化学试题【校级联考】广东省汕头市达濠华侨中学、东厦中学2018-2019学年高二(理)上学期阶段测试(二)化学试题江西省宜春市樟树市滨江中学2018-2019学年高二上学期第一次月考化学试题黑龙江省哈尔滨师范大学青冈实验中学校2019-2020学年高二10月月考化学试题江西省靖安中学2020-2021学年高二上学期第一次月考化学试题山东省济南市长清第一中学2021-2022学年高二上学期10月阶段性质量检测化学试题河南省新蔡县第一高级中学2021-2022学年高二上学期9月月考化学试题吉林省乾安县第七中学2021-2022学年高二上学期第一次质量检测化学试题北京大学附属中学2023-2024学年高二上学期10月月考化学试题广东省江门市鹤山市第一中学2023-2024学年高二上学期第二阶段考试化学试题河北省石家庄市第二中学2019-2020学年高一下学期期末模拟考试化学试题宁夏固原市隆德县2020-2021学年高二上学期期末考试化学试题
8 . 关于反应进行方向的判断,以下说法错误的是
| A.高锰酸钾加热分解是一个熵增的过程 |
| B.能自发进行的化学反应不一定是ΔH<0、ΔS>0 |
| C.ΔH<0的化学反应均是自发反应,ΔS<0的化学反应均不能自发进行 |
| D.反应2Al2O3(s)+3C(s) = 2Al (s)+ 3CO2(g)在常温下不能自发进行,说明该反应ΔH>0 |
您最近一年使用:0次
2017-08-16更新
|
277次组卷
|
2卷引用:湖北省孝感市八所重点高中教学协作体2016-2017学年高一7月联合考试化学试题
名校
解题方法
9 . 以下对影响反应方向因素的判断不正确的是
| A.有时焓变对反应的方向起决定性作用 |
| B.有时熵变对反应的方向起决定性作用 |
| C.焓变和熵变是判断反应方向的两个主要因素 |
| D.任何情况下,温度都不可能对反应的方向起决定性作用 |
您最近一年使用:0次
2017-07-25更新
|
709次组卷
|
16卷引用:湖北省黄冈麻城市第二中学2021届高三上学期第一次质量检测化学试题
湖北省黄冈麻城市第二中学2021届高三上学期第一次质量检测化学试题河南省南阳市第一中学2017-2018学年高二上学期第二次月考化学试题重庆市北碚区2019-2020学年高二11月联合性测试化学试题新疆博尔塔拉蒙古自治州第五师高级中学2019-2020学年高二上学期第二次月考化学试题河南省洛阳市孟津县第二高级中学2020-2021学年高二上学期9月月考化学试题陕西省黄陵中学2016-2017学年高一(重点班)下学期期末考试化学试题2018-2019学年鲁科版高中化学选修四:第2章检测题贵州省安顺市平坝第一高级中学2018-2019学年高二上学期期中考试化学试题福建省建瓯市芝华中学2019-2020学年高二上学期期中考试化学(1-2班)试题云南省迪庆州维西县第二中学2019-2020学年上学期高二期末考试化学试题陕西省宝鸡市渭滨区2019—2020学年高二上学期期末考试化学试题贵州省雷山县第四中学2019-2020学年高二上学期期末考试化学试题人教版(2019)高二选择性必修第一册 第二章 化学反应速率与化学平衡 第三节 化学反应的方向 作业帮(已下线)2.3 化学反应的方向(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)(已下线)2.3 化学反应的方向(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)吉林江城中学2021-2022学年高二上学期期中考试化学试题
名校
10 . 下列说法错误的是( )
| A.实验室配制FeCl3溶液时,需将FeCl3 (s)溶解在较浓盐酸中,然后加水稀释 |
B.反应2CO+2NO = N2+2CO2在常温下能自发进行,则反应的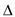 H>0, H>0,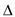 S<0 S<0 |
| C.0.1mol·L-1NH4Cl溶液加水稀释,c(H+)/c(NH4+)的值增大 |
D.反应CH3COOCH3+H2O CH3COOH+CH3OH CH3COOH+CH3OH 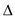 H>0,达到平衡时,加入少量固体NaOH,则乙酸甲酯水解转化率增大 H>0,达到平衡时,加入少量固体NaOH,则乙酸甲酯水解转化率增大 |
您最近一年使用:0次
2017-05-14更新
|
334次组卷
|
3卷引用:湖北省沙市中学2016-2017学年高二下学期第四次双周考(A卷)化学试题



