1 . CH4-H2O催化重整是目前大规模制取氢气的重要方法。其反应原理为:CH4(g)+2H2O(g) CO2(g)+4H2(g)
CO2(g)+4H2(g)  H =+164.6 kJ·mol-1。
H =+164.6 kJ·mol-1。
实验室于同一恒容密闭容器中模拟上述反应过程,在不同温度、不同投料下进行实验,部分相关数据如下表所示。
T1℃时,反应至5 min达到平衡,则0~5 min内H2 的平均反应速率v(H2)=___________ ;根据表格数据计算,判断:T1℃___________ T2℃(选填“>”、“<”或“=”)。
 CO2(g)+4H2(g)
CO2(g)+4H2(g)  H =+164.6 kJ·mol-1。
H =+164.6 kJ·mol-1。实验室于同一恒容密闭容器中模拟上述反应过程,在不同温度、不同投料下进行实验,部分相关数据如下表所示。
| 温度(℃) | 浓度 | CH4 | H2O | CO2 | H2 |
| T1 | 起始浓度(mol·L-1) | 1 | 2 | 0 | 0 |
| 平衡浓度(mol·L-1) | 0.5 | ||||
| T2 | 起始浓度(mol·L-1) | 2.5 | 2 | 0.5 | 0 |
| 平衡浓度(mol·L-1) | 2 | 1 | 1 | 2 |
您最近一年使用:0次
2 . 上海建有以“液态阳光”甲醇为氢源,集制氢、储氢、加氢为一体的新型加氢站。甲醇水蒸气重整制氢的部分原理如下:
反应①:CH3OH(g)+H2O(g) CO2(g)+3H2(g) ∆H1=49kJ·mol−1
CO2(g)+3H2(g) ∆H1=49kJ·mol−1
反应②:H2(g)+CO2(g) CO(g)+H2O(g) ∆H2=41kJ·mol−1
CO(g)+H2O(g) ∆H2=41kJ·mol−1
(1)对反应①的下列判断正确的是___________。
(2)一定条件下,向2L恒容密闭容器中充入2mol CH3OH(g)和4mol H2O(g)发生反应①,2min时测得混合气体的压强是反应前的1.5倍,则2min内的υ(CH3OH)=___________ 。
(3)下列事实不能说明反应①已达到平衡状态的是___________。
(4)向某密闭容器中按下列比例通入CO和H2O发生反应②,在不同温度下,CO的平衡转化率如下表所示:
①比较大小:T1___________ T2(填写“大于”、“小于”或“等于”),判断理由是___________ 。
②T2℃时,反应②的化学平衡常数K =___________ 。
反应①:CH3OH(g)+H2O(g)
 CO2(g)+3H2(g) ∆H1=49kJ·mol−1
CO2(g)+3H2(g) ∆H1=49kJ·mol−1反应②:H2(g)+CO2(g)
 CO(g)+H2O(g) ∆H2=41kJ·mol−1
CO(g)+H2O(g) ∆H2=41kJ·mol−1(1)对反应①的下列判断正确的是___________。
| A.ΔS大于0,低温能自发进行 | B.ΔS小于0,高温能自发进行 |
| C.ΔS小于0,低温能自发进行 | D.ΔS大于0,高温能自发进行 |
(3)下列事实不能说明反应①已达到平衡状态的是___________。
| A.混合气体的平均相对分子质量不变 | B.υ正(CH3OH)=3υ逆(H2) |
| C.CH3OH的浓度不再变化 | D.绝热容器内的温度保持不变 |
| 反应温度(℃) | 进气比[n(CO):n(H2O)] | CO的平衡转化率 |
| T1 | 0.5 | 50% |
| T1 | 1 | 36.67% |
| T2 | 0.5 | 66.67% |
| T2 | 1 | 50% |
②T2℃时,反应②的化学平衡常数K =
您最近一年使用:0次
名校
解题方法
3 . T℃时,向2.0L的恒容密闭容器中充入1.0mol 和0.6mol
和0.6mol ,发生如下反应:
,发生如下反应: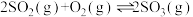 。20s时反应达到平衡,
。20s时反应达到平衡,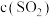 和
和 相等。
相等。
(1)0~20s内,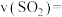
_______  。
。
(2)平衡后向容器中再充入0.4mol 和0.3mol
和0.3mol ,此时,
,此时, _______
_______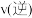 。
。
(3)相同温度下,起始投料变为0.5mol 和0.3mol
和0.3mol ,
, 的平衡转化率_______。
的平衡转化率_______。
 和0.6mol
和0.6mol ,发生如下反应:
,发生如下反应: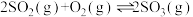 。20s时反应达到平衡,
。20s时反应达到平衡,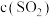 和
和 相等。
相等。(1)0~20s内,
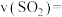
 。
。(2)平衡后向容器中再充入0.4mol
 和0.3mol
和0.3mol ,此时,
,此时, _______
_______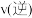 。
。| A.大于 | B.小于 | C.等于 | D.无法判断 |
(3)相同温度下,起始投料变为0.5mol
 和0.3mol
和0.3mol ,
, 的平衡转化率_______。
的平衡转化率_______。| A.增大 | B.不变 | C.减小 | D.无法判断 |
您最近一年使用:0次
名校
4 . 利用反应I可用于在国际空间站中处理二氧化碳,同时伴有副反应II发生。
主反应I:
副反应II:
1.几种化学键的键能如表所示:
表中
___________ 。
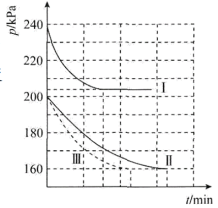
为了进一步研究上述两个反应,某小组在三个10L的刚性容器中,分别充入1mol 和4mol
和4mol ,在三种不同实验条件(见下表)下进行两个反应,反应体系的总压强(p)随时间变化情况如图所示:
,在三种不同实验条件(见下表)下进行两个反应,反应体系的总压强(p)随时间变化情况如图所示:
 ___________
___________ 。
。
3.曲线III对应的实验编号是___________。
4.若在曲线II条件下,10min达到平衡时生成1.2mol ,则10min内反应的平均速率
,则10min内反应的平均速率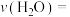
___________  。
。
5.该温度下反应II的平衡常数 ___________。
___________。
6.一定条件下反应I存在: 或
或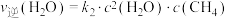 ,反应I的平衡常数
,反应I的平衡常数
___________ (用含 、
、 的代数式表示)。
的代数式表示)。
主反应I:

副反应II:

1.几种化学键的键能如表所示:
| 化学键 |  |  |  |  |
键能/( ) ) | 413 | 436 | 463 | a |

为了进一步研究上述两个反应,某小组在三个10L的刚性容器中,分别充入1mol
 和4mol
和4mol ,在三种不同实验条件(见下表)下进行两个反应,反应体系的总压强(p)随时间变化情况如图所示:
,在三种不同实验条件(见下表)下进行两个反应,反应体系的总压强(p)随时间变化情况如图所示:| 实验编号 | a | b | c |
| 温度/K |  |  |  |
催化剂的比表面积/(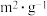 ) ) | 80 | 120 | 120 |
 ___________
___________ 。
。| A.大于 | B.等于 | C.小于 | D.无法确定 |
| A.a | B.b | C.c | D.无法确定 |
 ,则10min内反应的平均速率
,则10min内反应的平均速率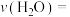
 。
。5.该温度下反应II的平衡常数
 ___________。
___________。| A.1.44 | B.0.44 | C.2.55 | D.0.55 |
 或
或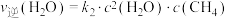 ,反应I的平衡常数
,反应I的平衡常数
 、
、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
解题方法
5 . 研究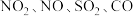 等大气污染气体的处理具有重要意义,有关研究表明氨气在处理大气污染中有一定的作用。利用反应
等大气污染气体的处理具有重要意义,有关研究表明氨气在处理大气污染中有一定的作用。利用反应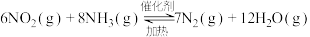 可处理
可处理 。
。
(1)在2L的密闭容器中,2分钟内上述反应混合物的物质的量增加了0.25mol,则2分钟内
_______ 。
(2)写出该反应的化学平衡常数表达式_______ ;
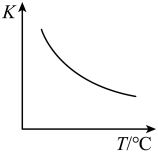
(3)已知该反应平衡常数(K)与温度(T)的关系如下图所示,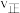
_______ 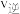 (填“大于”、“小于”或“等于”);反应达到平衡后若缩小反应容器体积,其它条件不变,则混合气体的平均分子量将
(填“大于”、“小于”或“等于”);反应达到平衡后若缩小反应容器体积,其它条件不变,则混合气体的平均分子量将_______ (填“变大”.“变小”或“不变”)。
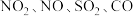 等大气污染气体的处理具有重要意义,有关研究表明氨气在处理大气污染中有一定的作用。利用反应
等大气污染气体的处理具有重要意义,有关研究表明氨气在处理大气污染中有一定的作用。利用反应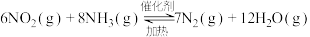 可处理
可处理 。
。(1)在2L的密闭容器中,2分钟内上述反应混合物的物质的量增加了0.25mol,则2分钟内

(2)写出该反应的化学平衡常数表达式
(3)已知该反应平衡常数(K)与温度(T)的关系如下图所示,
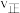
 (填“大于”、“小于”或“等于”);反应达到平衡后若缩小反应容器体积,其它条件不变,则混合气体的平均分子量将
(填“大于”、“小于”或“等于”);反应达到平衡后若缩小反应容器体积,其它条件不变,则混合气体的平均分子量将
您最近一年使用:0次
解题方法
6 . 将6molCO2和8molH2充入一容积为2L的密闭容器中(温度保持不变)。发生反应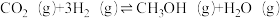
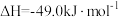 ,测得H2的物质的量随时间变化如图中实线所示(图中字母后的数字表示对应的坐标)。
,测得H2的物质的量随时间变化如图中实线所示(图中字母后的数字表示对应的坐标)。
2.写出反应的平衡常数表达式___________ 。在该温度下,当达到平衡状态时,CO2的转化率是___________ 。
3.仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示。与实线相比,虚线I和虚线Ⅱ改变的条件可能是
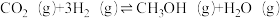
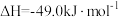 ,测得H2的物质的量随时间变化如图中实线所示(图中字母后的数字表示对应的坐标)。
,测得H2的物质的量随时间变化如图中实线所示(图中字母后的数字表示对应的坐标)。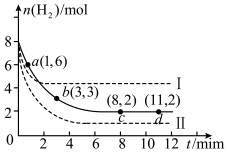
| A.0-1min | B.1-3 min | C.3-8min | D.8-11min |
3.仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示。与实线相比,虚线I和虚线Ⅱ改变的条件可能是
| A.升高温度 增大压强 | B.增大压强 升高温度 |
| C.降低温度 减小压强 | D.减小压强 降低温度 |
您最近一年使用:0次
名校
解题方法
7 . 某实验小组为探究外界条件对化学反应速率的影响进行如下实验:
实验1:探究常温下影响等质量金属与酸反应生成氢气速率的因素:
(1)实验I、Ⅱ探究的是___________ 对反应速率的影响。
(2)实验I、Ⅲ及相应实验现象得到的结论是___________ 。
(3)实验1中三组的反应速率由快到慢的顺序可能是___________ (填编号)。
(4)甲同学在进行实验Ⅲ时又加入了少量硫酸铜固体,发现生成气体速率明显加快,试分析其原因:___________ 。
实验2:探究影响反应 的因素。(编号Ⅳ为对照组)
的因素。(编号Ⅳ为对照组)
(5)请写出表中
___________ 。
(6)实验Ⅵ研究“温度对该反应速率的影响”,请填写合理的数据。①:___________ ;②:___________ ;③:___________ 。
(7)该小组同学依据实V条件进行反应并测定其化学反应速率,所得数据如图所示。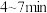 内用
内用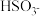 表示的平均反应速率为
表示的平均反应速率为___________  。(写出计算过程)
。(写出计算过程)
实验1:探究常温下影响等质量金属与酸反应生成氢气速率的因素:
| 实验编号 | 金属 | c(酸)/( ) ) | 溶液体积/ |
| I | 铁粉 |  硫酸 硫酸 | 10 |
| Ⅱ | 铁粉 |  盐酸 盐酸 | 10 |
| Ⅲ | 铁块 |  硫酸 硫酸 | 10 |
(1)实验I、Ⅱ探究的是
(2)实验I、Ⅲ及相应实验现象得到的结论是
(3)实验1中三组的反应速率由快到慢的顺序可能是
(4)甲同学在进行实验Ⅲ时又加入了少量硫酸铜固体,发现生成气体速率明显加快,试分析其原因:
实验2:探究影响反应
 的因素。(编号Ⅳ为对照组)
的因素。(编号Ⅳ为对照组)| 实验编号 |  溶液的体积/ 溶液的体积/ | 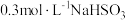 溶液的体积/ 溶液的体积/ | 水的体积/ | 反应温度 |
| Ⅳ | 10 | 10 | 0 |  |
| V | 10 | 5 | a |  |
| Ⅵ | ① | ② | ③ |  |
(5)请写出表中

(6)实验Ⅵ研究“温度对该反应速率的影响”,请填写合理的数据。①:
(7)该小组同学依据实V条件进行反应并测定其化学反应速率,所得数据如图所示。
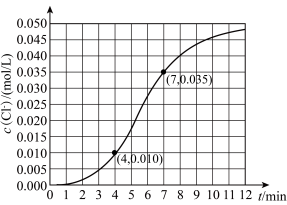
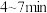 内用
内用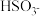 表示的平均反应速率为
表示的平均反应速率为 。(写出计算过程)
。(写出计算过程)
您最近一年使用:0次
8 .  时,将
时,将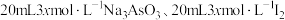 和
和 溶液混合,发生反应:
溶液混合,发生反应: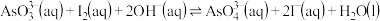 。溶液中
。溶液中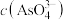 与反应时间(t)的关系如图所示。(忽略混合前后溶液体积的变化)
与反应时间(t)的关系如图所示。(忽略混合前后溶液体积的变化)
2.比较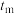 和
和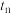 时的化学反应速率,其中
时的化学反应速率,其中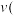 逆)较大的时刻为___________。
逆)较大的时刻为___________。
3.若平衡时溶液的 ,则该反应的平衡常数
,则该反应的平衡常数
___________ 。(用含 和
和 的代数式表示)
的代数式表示)
 时,将
时,将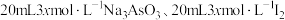 和
和 溶液混合,发生反应:
溶液混合,发生反应: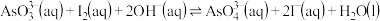 。溶液中
。溶液中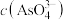 与反应时间(t)的关系如图所示。(忽略混合前后溶液体积的变化)
与反应时间(t)的关系如图所示。(忽略混合前后溶液体积的变化)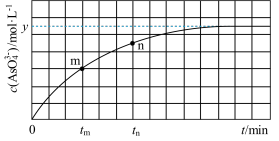
A.溶液的 不再变化 不再变化 | B.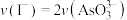 |
C.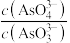 不再变化 不再变化 | D.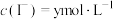 |
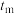 和
和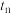 时的化学反应速率,其中
时的化学反应速率,其中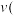 逆)较大的时刻为___________。
逆)较大的时刻为___________。A. | B.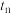 | C.两者相等 | D.无法比较 |
 ,则该反应的平衡常数
,则该反应的平衡常数
 和
和 的代数式表示)
的代数式表示)
您最近一年使用:0次
解题方法
9 . Ⅰ.随着碳中和目标的提出,CO2回收技术已成为科学研究热点问题,其中逆水煤气变换反应引起了广泛关注。该反应是将CO2加氢转化为CH3OH等高附加值化学品的关键步骤。
在催化剂作用下,逆水煤气变换体系中存在以下反应:
①CO2(g)+3H2(g) CH3OH(g)+H2O(g);∆H1= ‒ 49.5 kJ∙mol-1;K1
CH3OH(g)+H2O(g);∆H1= ‒ 49.5 kJ∙mol-1;K1
②CO2(g)+H2(g) CO(g)+H2O(g);∆H2= 41.2 kJ∙mol-1;K2
CO(g)+H2O(g);∆H2= 41.2 kJ∙mol-1;K2
③CO(g)+2H2(g) CH3OH(g);∆H3= ‒ 90.7 kJ∙mol-1;K3
CH3OH(g);∆H3= ‒ 90.7 kJ∙mol-1;K3
(1)K1=___________ (用K2、K3表示)。
Ⅱ.将6 mol CO2和8 mol H2充入容积为2L的密闭容器中,分别在T1、T2温度下发生反应①,H2的物质的量变化如表所示:
(2)T1温度下,5~10min内以CO2表示该反应速率v(CO2)=___________ 。该温度下,若各物质的起始量n(CO2) = n(H2) = n(CH3OH) = n(H2O) = 2 mol,则v(正)___________ v(逆)。
A.> B.= C.<
(3)下列说法正确的是___________。
Ⅲ.一定条件下,将原料气n(CO2)∶n(H2)=1∶3进行投料,在恒容密闭容器中模拟上述三个反应,CO和CH3OH在含碳产物(CH3OH和CO)中物质的量分数及CO2的平衡转化率随温度变化的情况如图所示___________ 。曲线___________ 代表CH3OH在含碳产物中物质的量分数。
A.m B.n
(5)有利于提高CO2转化为CH3OH的平衡转化率的措施有___________。
Ⅳ.光催化CO2也可以制备甲醇、甲烷等燃料,反应原理示意图如下图所示:
(7)写出a区的电极反应式___________ 。
在催化剂作用下,逆水煤气变换体系中存在以下反应:
①CO2(g)+3H2(g)
 CH3OH(g)+H2O(g);∆H1= ‒ 49.5 kJ∙mol-1;K1
CH3OH(g)+H2O(g);∆H1= ‒ 49.5 kJ∙mol-1;K1②CO2(g)+H2(g)
 CO(g)+H2O(g);∆H2= 41.2 kJ∙mol-1;K2
CO(g)+H2O(g);∆H2= 41.2 kJ∙mol-1;K2③CO(g)+2H2(g)
 CH3OH(g);∆H3= ‒ 90.7 kJ∙mol-1;K3
CH3OH(g);∆H3= ‒ 90.7 kJ∙mol-1;K3(1)K1=
Ⅱ.将6 mol CO2和8 mol H2充入容积为2L的密闭容器中,分别在T1、T2温度下发生反应①,H2的物质的量变化如表所示:
| 物质的量/mol | T1/℃ | T2/℃ | |||||
| 0 | 5min | 10min | 15min | 20min | 25min | 30min | |
| H2 | 8.0 | 3.5 | 2.0 | 2.0 | 1.7 | 1.5 | 1.5 |
(2)T1温度下,5~10min内以CO2表示该反应速率v(CO2)=
A.> B.= C.<
(3)下列说法正确的是___________。
| A.T1 < T2 |
| B.混合气体的密度保持不变时,反应已达到平衡 |
| C.平衡后向容器中充入稀有气体,平衡不发生移动 |
| D.加入合适的催化剂可以降低反应的活化能,∆H减小 |
Ⅲ.一定条件下,将原料气n(CO2)∶n(H2)=1∶3进行投料,在恒容密闭容器中模拟上述三个反应,CO和CH3OH在含碳产物(CH3OH和CO)中物质的量分数及CO2的平衡转化率随温度变化的情况如图所示
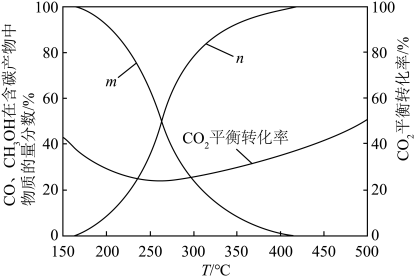
A.m B.n
(5)有利于提高CO2转化为CH3OH的平衡转化率的措施有___________。
| A.使用催化性能好的催化剂 | B.降低反应温度 |
| C.投料比不变,增加反应物的浓度 | D.增大CO2和H2的初始投料比 |
Ⅳ.光催化CO2也可以制备甲醇、甲烷等燃料,反应原理示意图如下图所示:
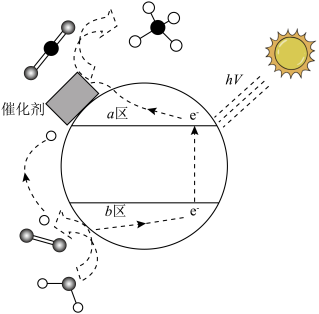
| A.H+由a区向b区移动 |
| B.b区电极反应为2H2O-4e-=O2↑+4H+ |
| C.CH4是氧化产物 |
| D.该装置实现了电能转化为化学能 |
(7)写出a区的电极反应式
您最近一年使用:0次
名校
10 . 可通过下列方法合成中性肥料尿素:
第一步:
 (反应速率较快)
(反应速率较快)
第二步: (反应速率较慢)
(反应速率较慢)
第一步反应的平衡常数的表达式为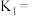
___________ 。
在1个 的密闭容器中加入
的密闭容器中加入 和
和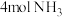 ,在一定条件下反应,
,在一定条件下反应, 时测得
时测得 和尿素的物质的量均为
和尿素的物质的量均为 ,
,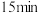 后
后 的物质的量为
的物质的量为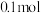 ,如图所示。若用单位时间内物质的量的变化来表示固体或纯液体的反应速率,则
,如图所示。若用单位时间内物质的量的变化来表示固体或纯液体的反应速率,则 内第一步中生成
内第一步中生成 (氨基甲酸铵)的平均反应速率为
(氨基甲酸铵)的平均反应速率为___________ 。
第一步:

 (反应速率较快)
(反应速率较快)第二步:
 (反应速率较慢)
(反应速率较慢)第一步反应的平衡常数的表达式为
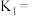
在1个
 的密闭容器中加入
的密闭容器中加入 和
和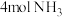 ,在一定条件下反应,
,在一定条件下反应, 时测得
时测得 和尿素的物质的量均为
和尿素的物质的量均为 ,
,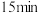 后
后 的物质的量为
的物质的量为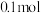 ,如图所示。若用单位时间内物质的量的变化来表示固体或纯液体的反应速率,则
,如图所示。若用单位时间内物质的量的变化来表示固体或纯液体的反应速率,则 内第一步中生成
内第一步中生成 (氨基甲酸铵)的平均反应速率为
(氨基甲酸铵)的平均反应速率为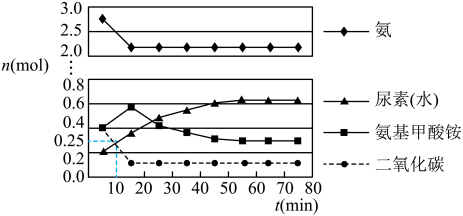
您最近一年使用:0次



