名校
1 . 硫酸是重要的化工原料,工业制硫酸的其中一步重要反应是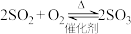 ,正反应放热。一定条件下,恒容密闭容器中发生该反应,各物质浓度随时间变化的曲线如下图所示。
,正反应放热。一定条件下,恒容密闭容器中发生该反应,各物质浓度随时间变化的曲线如下图所示。 的平均反应速率为
的平均反应速率为___________ 。
(2)图中a点,正反应速率___________ 逆反应速率(填“>”“<”或“=”)。
(3)反应进行到第___________ 分钟时恰好达到平衡,此时 的转化率为
的转化率为___________ 。
(4)下列说法正确的是___________。
(5)硫酸厂产生的尾气中含有少量 。双碱法脱硫的原理示意图如下:
。双碱法脱硫的原理示意图如下:___________ ,过程I的离子方程式为___________ 。
②理论上,过程 中消耗1mol氧气时,过程I中吸收
中消耗1mol氧气时,过程I中吸收 的体积(标准状况)是
的体积(标准状况)是___________ L。
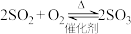 ,正反应放热。一定条件下,恒容密闭容器中发生该反应,各物质浓度随时间变化的曲线如下图所示。
,正反应放热。一定条件下,恒容密闭容器中发生该反应,各物质浓度随时间变化的曲线如下图所示。
 的平均反应速率为
的平均反应速率为(2)图中a点,正反应速率
(3)反应进行到第
 的转化率为
的转化率为(4)下列说法正确的是___________。
A.反应过程中, 和 和 的转化率始终相等 的转化率始终相等 |
B.通过调控反应条件,可以实现 的完全转化 的完全转化 |
| C.其他条件不变,升高温度,正反应速率和逆反应速率均增大 |
| D.使用催化剂可以提高反应速率,提高生产效率 |
(5)硫酸厂产生的尾气中含有少量
 。双碱法脱硫的原理示意图如下:
。双碱法脱硫的原理示意图如下: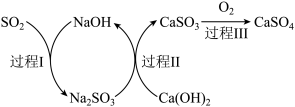
②理论上,过程
 中消耗1mol氧气时,过程I中吸收
中消耗1mol氧气时,过程I中吸收 的体积(标准状况)是
的体积(标准状况)是
您最近一年使用:0次
名校
2 . 为了减轻大气污染,可将汽车尾气中 和
和 转化为无污染气体。
转化为无污染气体。
Ⅰ.在一定条件下,向一容积为 的恒容密闭容器中充入
的恒容密闭容器中充入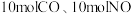 ,使之在催化剂作用下发生反应
,使之在催化剂作用下发生反应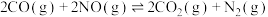 ,测得反应过程中部分物质的物质的量随反应时间变化的曲线如图所示。
,测得反应过程中部分物质的物质的量随反应时间变化的曲线如图所示。 的物质的量随时间变化的曲线为
的物质的量随时间变化的曲线为_______ (填“Ⅰ”“Ⅱ”或“Ⅲ”); 内,
内, 的平均反应速率为
的平均反应速率为_______  。
。
(2)反应达到平衡时, 的转化率为
的转化率为_______ ;设平衡时容器内压强为 ,反应起始时容器内压强为
,反应起始时容器内压强为 ,则
,则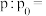
_______ 。
Ⅱ.为减少汽车尾气污染,生活中的交通工具逐步向着新能源汽车发展。比如人们乘坐以氢燃料电池(装置如图所示,电极均为石墨电极,总反应为 )为动力源的公交车绿色出行,减少碳排放。
)为动力源的公交车绿色出行,减少碳排放。_______ (填化学式),电子移动方向:电极_______ (填“a”或“b”)→_______ →电极_______ (填“a”或“b”)。
②电池工作时, 移向电极
移向电极_______ (填“a”或“b”),电池工作一段时间后,电解质溶液的浓度_______ (填“增大”“减小”或“无变化”)。
 和
和 转化为无污染气体。
转化为无污染气体。Ⅰ.在一定条件下,向一容积为
 的恒容密闭容器中充入
的恒容密闭容器中充入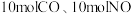 ,使之在催化剂作用下发生反应
,使之在催化剂作用下发生反应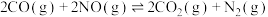 ,测得反应过程中部分物质的物质的量随反应时间变化的曲线如图所示。
,测得反应过程中部分物质的物质的量随反应时间变化的曲线如图所示。
 的物质的量随时间变化的曲线为
的物质的量随时间变化的曲线为 内,
内, 的平均反应速率为
的平均反应速率为 。
。(2)反应达到平衡时,
 的转化率为
的转化率为 ,反应起始时容器内压强为
,反应起始时容器内压强为 ,则
,则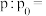
Ⅱ.为减少汽车尾气污染,生活中的交通工具逐步向着新能源汽车发展。比如人们乘坐以氢燃料电池(装置如图所示,电极均为石墨电极,总反应为
 )为动力源的公交车绿色出行,减少碳排放。
)为动力源的公交车绿色出行,减少碳排放。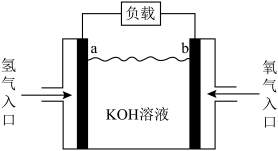
②电池工作时,
 移向电极
移向电极
您最近一年使用:0次
3 . 在甲、乙均为1L的恒容密闭容器中均充入2molNO和2molCO,在恒温和绝热两种条件下仅发生反应2NO(g)+2CO(g) N2(g)+2CO2(g) ∆H=-747kJ/mol,测得压强变化如图所示。下列说法
N2(g)+2CO2(g) ∆H=-747kJ/mol,测得压强变化如图所示。下列说法错误 的是
 N2(g)+2CO2(g) ∆H=-747kJ/mol,测得压强变化如图所示。下列说法
N2(g)+2CO2(g) ∆H=-747kJ/mol,测得压强变化如图所示。下列说法
| A.甲容器中的反应条件为绝热 |
| B.乙容器中0~4min内υ(NO)=0.4mol•L-1•min-1 |
| C.a点放出的热量为597.6kJ |
| D.Kb>Ka |
您最近一年使用:0次
名校
4 . 用纯净的 与100mL稀盐酸反应制取
与100mL稀盐酸反应制取 ,实验过程记录如图所示(
,实验过程记录如图所示( 的体积已折算为标准状况下的体积)。下列分析正确的是
的体积已折算为标准状况下的体积)。下列分析正确的是
 与100mL稀盐酸反应制取
与100mL稀盐酸反应制取 ,实验过程记录如图所示(
,实验过程记录如图所示( 的体积已折算为标准状况下的体积)。下列分析正确的是
的体积已折算为标准状况下的体积)。下列分析正确的是
| A.OE段的平均反应速率最快 |
| B.EF段,用盐酸表示该反应的平均反应速率为0.2mol/(L·min) |
C.OE、EF、FG三段中,该反应用 表示的平均反应速率之比为2∶4∶1 表示的平均反应速率之比为2∶4∶1 |
D.F点收集到的 的量最多 的量最多 |
您最近一年使用:0次
解题方法
5 . 工业制硫酸的一步重要反应是SO2的催化氧化。在2L密闭容器中,充入SO2和足量O2在催化剂、500℃的条件下发生反应。SO2、SO3的物质的量随时间的变化如图所示。下列说法正确的是
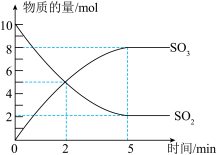
A.该反应的化学方程式是2SO2+O2 2SO3 2SO3 |
| B.反应到2min时,达到了化学平衡状态 |
| C.反应开始至5min末,以SO2浓度的变化表示该反应的平均反应速率是1.6mol/(L•min) |
| D.5min时,逆反应速率达到最大 |
您最近一年使用:0次
名校
6 . 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:___________ ,Y的转化率为___________ 。
(2)该反应的化学方程式为___________ 。
(3)下列能表示该反应达平衡状态的是___________(填选项字母)。
(4)10s后保持其他条件不变,判断改变下列条件后反应速率的变化情况:
A.继续通入一定量的X:___________ (填“增大”、“减小”或“不变”,下同)。
B.继续通入一定量的He:___________ 。
(5)下列图像或实验属于放热反应的是___________ (填序号)。___________ (填物质名称),负极的电极反应式为___________ 。

(2)该反应的化学方程式为
(3)下列能表示该反应达平衡状态的是___________(填选项字母)。
| A.容器内气体质量不再发生变化 |
| B.容器内气体压强不再发生变化 |
| C.X的体积分数不再改变 |
| D.容器内混合气体的密度不再发生变化 |
(4)10s后保持其他条件不变,判断改变下列条件后反应速率的变化情况:
A.继续通入一定量的X:
B.继续通入一定量的He:
(5)下列图像或实验属于放热反应的是

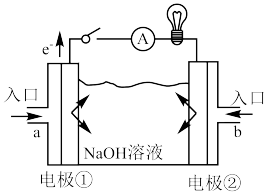
您最近一年使用:0次
名校
解题方法
7 . Ⅰ.铁是生产生活、科学研究中的重要物质,研究与Fe相关的反应时要关注反应的快慢和程度,某些有铁参与的反应可设计成原电池。
(1)以下是相同条件下,等体积等浓度的H2O2溶液分解的对比实验时,放出 O2的体积随时间的变化关系示意图(线a为使用FeCl3作催化剂,线b为不使用催化剂),其中正确的图像是______(填字母)。
Ⅱ.已知下列热化学为程式:
①Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g) △H1=﹣25 kJ·mol-1
②Fe2O3(s)+CO(g) = 2FeO(s)+CO2(g) △H2=﹣3 kJ·mol-1
(2)写出Fe被CO2氧化成FeO(s) 和 CO的热化学方程式_______ 。
一定温度下,向某密闭容器中加入足量铁并充入一定量的CO2气体,发生第(2)题的反应。反应过程中CO2气体和CO气体的浓度变化与时间的关系如图所示。_____ v逆(CO2)(填“>”“<”或“=”)。
(4)0~4min内, CO的平均反应速率v(CO)=____ 。
(5)仅改变下列条件,化学反应速率减小的是___ (填字母)。
A.减少铁的质量 B.降低温度 C.保持压强不变,充入He使容器的体积增大
Ⅲ.某化学兴趣小组利用反应Cu + 2FeCl3 = CuCl2 + 2FeCl2,设计了如图所示的原电池装置。___ 极(填“正”或“负”),。
(7)写出b电极上的电极反应式______ 。
(1)以下是相同条件下,等体积等浓度的H2O2溶液分解的对比实验时,放出 O2的体积随时间的变化关系示意图(线a为使用FeCl3作催化剂,线b为不使用催化剂),其中正确的图像是______(填字母)。
A. | B.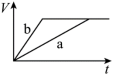 |
C.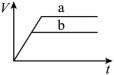 | D.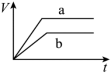 |
Ⅱ.已知下列热化学为程式:
①Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g) △H1=﹣25 kJ·mol-1
②Fe2O3(s)+CO(g) = 2FeO(s)+CO2(g) △H2=﹣3 kJ·mol-1
(2)写出Fe被CO2氧化成FeO(s) 和 CO的热化学方程式
一定温度下,向某密闭容器中加入足量铁并充入一定量的CO2气体,发生第(2)题的反应。反应过程中CO2气体和CO气体的浓度变化与时间的关系如图所示。
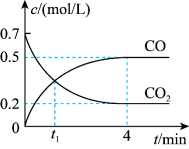
(4)0~4min内, CO的平均反应速率v(CO)=
(5)仅改变下列条件,化学反应速率减小的是
A.减少铁的质量 B.降低温度 C.保持压强不变,充入He使容器的体积增大
Ⅲ.某化学兴趣小组利用反应Cu + 2FeCl3 = CuCl2 + 2FeCl2,设计了如图所示的原电池装置。
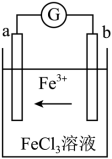
(7)写出b电极上的电极反应式
您最近一年使用:0次
名校
解题方法
8 . 某温度时,在容积为3 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。由图中数据分析,下列结论正确的是

| A.该反应的化学方程式为2Z+Y = 3X |
| B.3min 时,正、逆反应都不再继续进行,反应达到化学平衡 |
| C.反应到3min时,容器中的反应完成程度达到了最大 |
| D.温度、体积不变,3min 时充入1 mol He使压强增大,正逆反应速率都增大 |
您最近一年使用:0次
解题方法
9 . 一定温度下,在 的密闭容器中,
的密闭容器中, 两种气体的物质的量随时间变化的曲线如图所示:
两种气体的物质的量随时间变化的曲线如图所示:_______ 。
(2)反应达到最大限度的时间是______  ,该时间内的平均反应速率
,该时间内的平均反应速率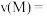
______ 。
(3)判断该反应达到平衡状态的依据是_______。
(4)能加快反应速率的措施是_______。
(5)反应进行到4min时,N的转化率为_______ 。
 的密闭容器中,
的密闭容器中, 两种气体的物质的量随时间变化的曲线如图所示:
两种气体的物质的量随时间变化的曲线如图所示: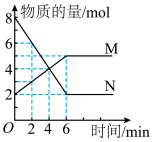
(2)反应达到最大限度的时间是
 ,该时间内的平均反应速率
,该时间内的平均反应速率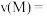
(3)判断该反应达到平衡状态的依据是_______。
| A.该条件下,正、逆反应速率都为零 |
| B.该条件下,混合气体的密度不再发生变化 |
| C.该条件下,混合气体的压强不再发生变化 |
D.该条件下,单位时间内消耗 的同时,消耗 的同时,消耗 |
(4)能加快反应速率的措施是_______。
| A.升高温度 |
B.容器容积不变,充入惰性气体 |
C.容器压强不变,充入惰性气体 |
| D.使用催化剂 |
(5)反应进行到4min时,N的转化率为
您最近一年使用:0次
名校
解题方法
10 . 工业上,常用水蒸气通过炽热的焦炭制得水煤气(主要成分为CO和 ),其反应的化学方程式为
),其反应的化学方程式为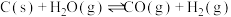 ,请回答下列问题:
,请回答下列问题:
(1)上述反应的能量变化图像如图所示。下列反应的能量变化与上述反应相同的是_______。
(2)一定条件下,焦炭和水蒸气在体积一定的密闭容器中进行反应,下列有关说法正确的是_______。
(3)在体积均为2L的甲、乙两个恒容密闭容器中,分别加入相同质量的一定量炭粉和2.8mol水蒸气,在不同温度下反应的过程如图所示: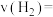
_______ 。
②甲容器中,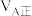
_______ 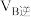 (填“<”“>”或“=”下同)。
(填“<”“>”或“=”下同)。
③反应过程中,两个容器温度:甲_______ 乙。
(4)乙容器中C点时,CO的物质的量百分数为_______ 。
 ),其反应的化学方程式为
),其反应的化学方程式为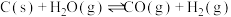 ,请回答下列问题:
,请回答下列问题:(1)上述反应的能量变化图像如图所示。下列反应的能量变化与上述反应相同的是_______。

| A.铝粉与氧化铁的反应 | B.氯化铵与 的反应 的反应 |
| C.锌片与稀硫酸的反应 | D.钠与冷水的反应 |
(2)一定条件下,焦炭和水蒸气在体积一定的密闭容器中进行反应,下列有关说法正确的是_______。
| A.充入He使容器压强增大,提高反应速率 |
B.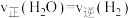 ,说明反应达到平衡状态 ,说明反应达到平衡状态 |
| C.容器中焦炭的质量不再变化,说明反应达到平衡状态 |
D.容器中水蒸气与氢气的体积比为 时,说明反应达到平衡状态 时,说明反应达到平衡状态 |
(3)在体积均为2L的甲、乙两个恒容密闭容器中,分别加入相同质量的一定量炭粉和2.8mol水蒸气,在不同温度下反应的过程如图所示:
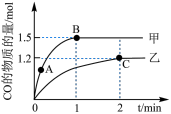
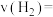
②甲容器中,
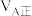
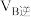 (填“<”“>”或“=”下同)。
(填“<”“>”或“=”下同)。③反应过程中,两个容器温度:甲
(4)乙容器中C点时,CO的物质的量百分数为
您最近一年使用:0次
2024-05-03更新
|
290次组卷
|
2卷引用:广东省东莞市东华高级中学2023-2024学年高一下学期前段考试化学试题



