解题方法
1 . 乙醇因其含氢量高、毒性低、价格低廉且来源广泛,成为理想的液态储氢载体之一。乙醇―水催化重整可获得 ,其主要反应为:
,其主要反应为:
Ⅰ.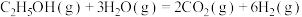

Ⅱ.

回答下列问题:
(1)已知:298K时,相关物质的相对能量如下表:
则a=___________ 。
(2)在恒温恒容条件下,投入1mol 和3mol
和3mol 发生反应
发生反应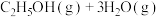
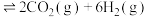 ,下列情况表明该反应达到平衡状态的是___________(填标号)。
,下列情况表明该反应达到平衡状态的是___________(填标号)。
(3)科学家研究了Grubbs催化剂作用于乙醇水溶液重整产氢的反应,测得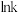 (k为速率常数)与反应温度倒数(
(k为速率常数)与反应温度倒数( )的相关关系及线性拟合如图1所示。请分析该反应的k随反应温度T的变化关系:
)的相关关系及线性拟合如图1所示。请分析该反应的k随反应温度T的变化关系:___________ 。 下,
下,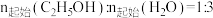 时,若仅考虑以上反应Ⅰ和Ⅱ,平衡时
时,若仅考虑以上反应Ⅰ和Ⅱ,平衡时 和CO的选择性及
和CO的选择性及 的产率随温度的变化如图2所示。
的产率随温度的变化如图2所示。 的选择性
的选择性
①图中表示 产率随温度变化的曲线是
产率随温度变化的曲线是___________ (填字母),判断依据是___________ 。
②一定温度下,加入 可以提高平衡时
可以提高平衡时 的产率,其原因是
的产率,其原因是___________ 。
(5)向一容积为2L的恒容密闭容器中通入2mol 和6mol
和6mol ,一定温度下发生反应
,一定温度下发生反应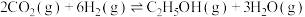 。若起始时气体的总压为p Pa,20min时达到平衡状态,测得
。若起始时气体的总压为p Pa,20min时达到平衡状态,测得 的物质的量分数为12.5%。
的物质的量分数为12.5%。
①平衡时气体的总压为___________ Pa(用含p的分数表示,需化简)。
②0~20min内,用 浓度的变化表示的平均反应速率
浓度的变化表示的平均反应速率
___________ ;该温度下,上述反应的平衡常数
___________ 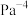 (用含p的分数表示,需化简;用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(用含p的分数表示,需化简;用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
 ,其主要反应为:
,其主要反应为:Ⅰ.
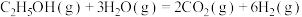

Ⅱ.


回答下列问题:
(1)已知:298K时,相关物质的相对能量如下表:
| 物质 |  |  |  |  |  |
相对能量/( ) ) | ―242 | ―393 | 0 | ―110 | a |
(2)在恒温恒容条件下,投入1mol
 和3mol
和3mol 发生反应
发生反应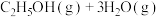
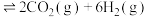 ,下列情况表明该反应达到平衡状态的是___________(填标号)。
,下列情况表明该反应达到平衡状态的是___________(填标号)。| A.混合气体的密度保持不变 | B.混合气体的总压强保持不变 |
| C.混合气体的平均摩尔质量保持不变 | D.产物的浓度之比保持不变 |
(3)科学家研究了Grubbs催化剂作用于乙醇水溶液重整产氢的反应,测得
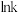 (k为速率常数)与反应温度倒数(
(k为速率常数)与反应温度倒数( )的相关关系及线性拟合如图1所示。请分析该反应的k随反应温度T的变化关系:
)的相关关系及线性拟合如图1所示。请分析该反应的k随反应温度T的变化关系: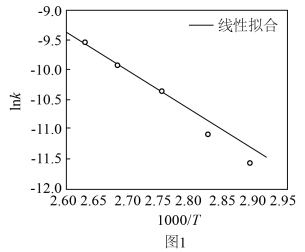
 下,
下,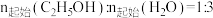 时,若仅考虑以上反应Ⅰ和Ⅱ,平衡时
时,若仅考虑以上反应Ⅰ和Ⅱ,平衡时 和CO的选择性及
和CO的选择性及 的产率随温度的变化如图2所示。
的产率随温度的变化如图2所示。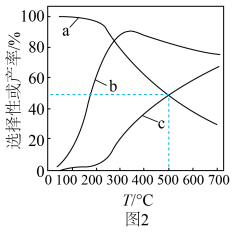
 的选择性
的选择性
①图中表示
 产率随温度变化的曲线是
产率随温度变化的曲线是②一定温度下,加入
 可以提高平衡时
可以提高平衡时 的产率,其原因是
的产率,其原因是(5)向一容积为2L的恒容密闭容器中通入2mol
 和6mol
和6mol ,一定温度下发生反应
,一定温度下发生反应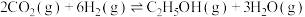 。若起始时气体的总压为p Pa,20min时达到平衡状态,测得
。若起始时气体的总压为p Pa,20min时达到平衡状态,测得 的物质的量分数为12.5%。
的物质的量分数为12.5%。①平衡时气体的总压为
②0~20min内,用
 浓度的变化表示的平均反应速率
浓度的变化表示的平均反应速率

 (用含p的分数表示,需化简;用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(用含p的分数表示,需化简;用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
您最近一年使用:0次
2 . 氨是重要的化工原料,我国目前氨的生产能力居世界首位。随着科技的发展,氨的合成途径越来越多。回答下列问题:
(1)有一种新的以 载氮体的碳基化学链合成氨的方法,其原理为:
载氮体的碳基化学链合成氨的方法,其原理为:
①该反应分两步进行:
(Ⅰ)
(Ⅱ)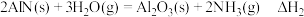
已知反应(Ⅰ):反应物总键能比生成物总键能多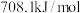 ;反应(Ⅱ):正反应活化能比逆反应活化能小
;反应(Ⅱ):正反应活化能比逆反应活化能小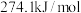 ,则
,则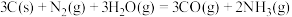 的
的
___________ 。
②反应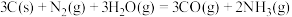 能自发进行的条件为:
能自发进行的条件为:___________ 。
A.高温 B.低温 C.任何温度
(2)传统的合成氨反应为: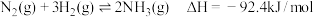 ,
,
①恒温条件下,将 和
和 按物质的量之比
按物质的量之比 投入到恒容密闭容器中发生反应:
投入到恒容密闭容器中发生反应: ,下列描述能说明达到化学平衡状态的有
,下列描述能说明达到化学平衡状态的有___________ (填序号)。
A. 和
和 的物质的量之比不变 B.容器的压强不再改变
的物质的量之比不变 B.容器的压强不再改变
C.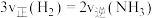 D.断裂3个
D.断裂3个 键的同时断裂6个
键的同时断裂6个 键
键
②合成氨速率方程为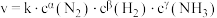 ,其中k为速率常数,根据表中数据分析:
,其中k为速率常数,根据表中数据分析:
则
___________ ,
___________ 。
③在恒温条件下,向 恒容密闭容器中充入
恒容密闭容器中充入 和
和 ,反应经过
,反应经过 后达到平衡,压强减小了
后达到平衡,压强减小了 ,则从开始到平衡,
,则从开始到平衡,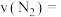
___________  后再向里面加入
后再向里面加入 和
和 各
各 ,正逆反应速率的大小关系为:
,正逆反应速率的大小关系为:
___________ (填“>”、“<”或“=”) 。
。
(1)有一种新的以
 载氮体的碳基化学链合成氨的方法,其原理为:
载氮体的碳基化学链合成氨的方法,其原理为:
①该反应分两步进行:
(Ⅰ)

(Ⅱ)
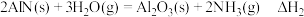
已知反应(Ⅰ):反应物总键能比生成物总键能多
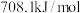 ;反应(Ⅱ):正反应活化能比逆反应活化能小
;反应(Ⅱ):正反应活化能比逆反应活化能小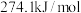 ,则
,则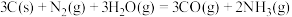 的
的
②反应
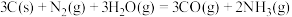 能自发进行的条件为:
能自发进行的条件为:A.高温 B.低温 C.任何温度
(2)传统的合成氨反应为:
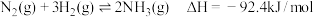 ,
,①恒温条件下,将
 和
和 按物质的量之比
按物质的量之比 投入到恒容密闭容器中发生反应:
投入到恒容密闭容器中发生反应: ,下列描述能说明达到化学平衡状态的有
,下列描述能说明达到化学平衡状态的有A.
 和
和 的物质的量之比不变 B.容器的压强不再改变
的物质的量之比不变 B.容器的压强不再改变C.
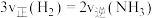 D.断裂3个
D.断裂3个 键的同时断裂6个
键的同时断裂6个 键
键②合成氨速率方程为
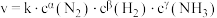 ,其中k为速率常数,根据表中数据分析:
,其中k为速率常数,根据表中数据分析:| 实验 | 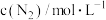 | 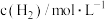 |  |
| 1 | m | n | q |
| 2 | 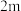 | n |  |
| 3 | m |  | 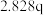 |


③在恒温条件下,向
 恒容密闭容器中充入
恒容密闭容器中充入 和
和 ,反应经过
,反应经过 后达到平衡,压强减小了
后达到平衡,压强减小了 ,则从开始到平衡,
,则从开始到平衡,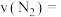
 后再向里面加入
后再向里面加入 和
和 各
各 ,正逆反应速率的大小关系为:
,正逆反应速率的大小关系为:
 。
。
您最近一年使用:0次
3 . 甲醇是一种可再生的清洁能源,二氧化碳催化加氢制甲醇,有利于实现“碳达峰”、“碳中和”。已知有关 的热化学方程式如下:
的热化学方程式如下:
Ⅰ. ,
,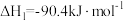 ;
;
Ⅱ. ,
, ;
;
Ⅲ. ,
,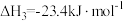 ;
;
Ⅳ. ,
,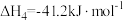 ;
;
请回答下列问题:
(1)

_______ 。
(2)在体积一定的密闭容器中按物质的量比1:2充入CO和 ,发生上述反应Ⅰ,充分反应达平衡后,如图是平衡混合物中
,发生上述反应Ⅰ,充分反应达平衡后,如图是平衡混合物中 的体积分数在不同压强下随温度变化的平衡曲线。
的体积分数在不同压强下随温度变化的平衡曲线。 ,温度为300℃时,反应Ⅰ的压强平衡常数
,温度为300℃时,反应Ⅰ的压强平衡常数
_______ 。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
②反应Ⅰ达平衡后,下列措施能提高 产率的是
产率的是_______ (填字母)。
A.加入适量一氧化碳 B.升高温度 C.使用高效催化剂 D.增大压强
(3)一定温度下,向容积为1L的恒容密闭容器中,充入 和
和 ,发生上述反应Ⅱ,测得各物质的物质的量浓度变化如图所示:
,发生上述反应Ⅱ,测得各物质的物质的量浓度变化如图所示:_______ 的浓度随时间的变化; 内,
内, 的平均反应速率为
的平均反应速率为_______  。
。
(4)对于反应Ⅲ,其速率方程式为 ,
, ,
, ,
, 为速率常数且只与温度有关,则该反应的平衡常数
为速率常数且只与温度有关,则该反应的平衡常数
_______ (用含 、
、 的代数式表示)。
的代数式表示)。
已知某温度下,上述反应平衡常数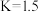 ,在密闭容器中充入一定物质的量的
,在密闭容器中充入一定物质的量的 ,反应到某时刻测得各组分的物质的量如下:
,反应到某时刻测得各组分的物质的量如下:
此时正、逆反应速率的大小:
_______  。
。
 的热化学方程式如下:
的热化学方程式如下:Ⅰ.
 ,
,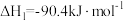 ;
;Ⅱ.
 ,
, ;
;Ⅲ.
 ,
,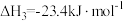 ;
;Ⅳ.
 ,
,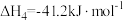 ;
;请回答下列问题:
(1)


(2)在体积一定的密闭容器中按物质的量比1:2充入CO和
 ,发生上述反应Ⅰ,充分反应达平衡后,如图是平衡混合物中
,发生上述反应Ⅰ,充分反应达平衡后,如图是平衡混合物中 的体积分数在不同压强下随温度变化的平衡曲线。
的体积分数在不同压强下随温度变化的平衡曲线。
 ,温度为300℃时,反应Ⅰ的压强平衡常数
,温度为300℃时,反应Ⅰ的压强平衡常数
②反应Ⅰ达平衡后,下列措施能提高
 产率的是
产率的是A.加入适量一氧化碳 B.升高温度 C.使用高效催化剂 D.增大压强
(3)一定温度下,向容积为1L的恒容密闭容器中,充入
 和
和 ,发生上述反应Ⅱ,测得各物质的物质的量浓度变化如图所示:
,发生上述反应Ⅱ,测得各物质的物质的量浓度变化如图所示: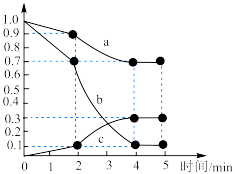
 内,
内, 的平均反应速率为
的平均反应速率为 。
。(4)对于反应Ⅲ,其速率方程式为
 ,
, ,
, ,
, 为速率常数且只与温度有关,则该反应的平衡常数
为速率常数且只与温度有关,则该反应的平衡常数
 、
、 的代数式表示)。
的代数式表示)。已知某温度下,上述反应平衡常数
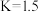 ,在密闭容器中充入一定物质的量的
,在密闭容器中充入一定物质的量的 ,反应到某时刻测得各组分的物质的量如下:
,反应到某时刻测得各组分的物质的量如下:| 物质 |  |  | 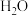 |
| 物质的量/mol | 0.2 | 0.2 | 0.2 |

 。
。
您最近一年使用:0次
4 . CO是一种重要化工原料,也是一种燃料.工业上,合成 的原理为
的原理为 (正反应是放热反应).向1L恒容密闭容器中充人
(正反应是放热反应).向1L恒容密闭容器中充人 和
和 ,发生上述反应.测得CO浓度随时间,温度变化如图所示.
,发生上述反应.测得CO浓度随时间,温度变化如图所示.
(1)温度
_______  (填“>” “<”或 “=”),判断依据是
(填“>” “<”或 “=”),判断依据是___________ .
(2)下列叙述能说明该反应达到平衡状态的是________(填字母).
(3)a点:正反应速率逆反应速率__________ (填“>” “<”或 “=”,下同),逆反应速率:a_____ b.
(4) 温度下,2~6min内
温度下,2~6min内 的平均反应速率为
的平均反应速率为__________  .
.
(5) 温度下,CO平衡转化率为
温度下,CO平衡转化率为______________ .
(6)CO空气碱性燃料电池放电效率高,写出负极的电极反应式:_____________ .
 的原理为
的原理为 (正反应是放热反应).向1L恒容密闭容器中充人
(正反应是放热反应).向1L恒容密闭容器中充人 和
和 ,发生上述反应.测得CO浓度随时间,温度变化如图所示.
,发生上述反应.测得CO浓度随时间,温度变化如图所示.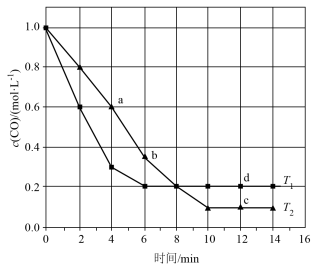
(1)温度

 (填“>” “<”或 “=”),判断依据是
(填“>” “<”或 “=”),判断依据是(2)下列叙述能说明该反应达到平衡状态的是________(填字母).
| A.混合气体密度不随时间变化 |
| B.气体总压强不随时间变化 |
C. 体积分数不随时间变化 体积分数不随时间变化 |
D.CO消耗速率等于 生成速率 生成速率 |
(3)a点:正反应速率逆反应速率
(4)
 温度下,2~6min内
温度下,2~6min内 的平均反应速率为
的平均反应速率为 .
.(5)
 温度下,CO平衡转化率为
温度下,CO平衡转化率为(6)CO空气碱性燃料电池放电效率高,写出负极的电极反应式:
您最近一年使用:0次
5 . T℃时,在2L的密闭容器中, (均为气体)的物质的量随时间的变化曲线如图所示,下列说法错误的是
(均为气体)的物质的量随时间的变化曲线如图所示,下列说法错误的是
 (均为气体)的物质的量随时间的变化曲线如图所示,下列说法错误的是
(均为气体)的物质的量随时间的变化曲线如图所示,下列说法错误的是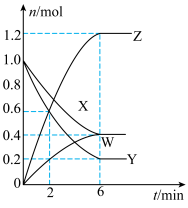
A.反应的化学方程式为 |
| B.适当升高温度,正反应速率和逆反应速率均增大 |
| C.初始时的压强与平衡时的压强比为10:11 |
D.若该反应在绝热容器中进行,也在 时达到平衡 时达到平衡 |
您最近一年使用:0次
解题方法
6 . 将1mol  充入10L恒容密闭容器中,在一定温度下发生反应:①
充入10L恒容密闭容器中,在一定温度下发生反应:①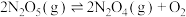

 ;②
;②
 。10min末,该反应达到平衡,此时
。10min末,该反应达到平衡,此时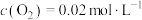 ,
, ,下列说法错误的是
,下列说法错误的是
 充入10L恒容密闭容器中,在一定温度下发生反应:①
充入10L恒容密闭容器中,在一定温度下发生反应:①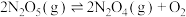

 ;②
;②
 。10min末,该反应达到平衡,此时
。10min末,该反应达到平衡,此时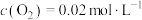 ,
, ,下列说法错误的是
,下列说法错误的是A.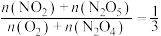 |
B.0~10min, |
C.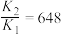 |
D.反应达到平衡后,保持其他条件不变,仅充入少量氦气,则 的反应速率保持不变 的反应速率保持不变 |
您最近一年使用:0次
7 . 乙烯可用于制备乙醇: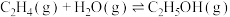 △H<0。向10L某恒容密闭容器中通入2mol
△H<0。向10L某恒容密闭容器中通入2mol (g)和a mol
(g)和a mol  (g),发生上述反应,测得
(g),发生上述反应,测得 (g)的平衡转化率与投料比X[
(g)的平衡转化率与投料比X[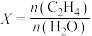 ]以及温度的关系如图所示。回答下列问题:
]以及温度的关系如图所示。回答下列问题:
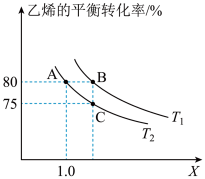
(1)反应从开始分别进行到A、B、C点时,放出的热量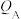 、
、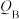 、
、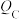 由大到小的顺序为
由大到小的顺序为___________ 。
(2)
___________ (填“>”“<”或“=”) 。已知该反应的反应速率表达式为
。已知该反应的反应速率表达式为 ,
,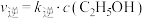 ,其中
,其中 、
、 为速率常数,只与温度有关。若其他条件不变,则温度从
为速率常数,只与温度有关。若其他条件不变,则温度从 变化到
变化到 的过程中,下列推断合理的是
的过程中,下列推断合理的是___________ (填字母)。
A. 减小的倍数大于
减小的倍数大于 B.
B. 减小的倍数小于
减小的倍数小于
C. 增大的倍数大于
增大的倍数大于 D.
D. 增大的倍数小于
增大的倍数小于
(3)若A点对应的体系中,反应从开始到达到平衡所用时间是2min,则0~2min内 (g)的平均反应速率
(g)的平均反应速率
___________  。
。 温度下,反应的平衡常数K=
温度下,反应的平衡常数K=___________ 。
(4)B点对应的体系中,a=___________ ;A、B、C点对应体系的气体总压强 、
、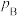 、
、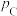 由大到小的顺序为
由大到小的顺序为___________ (气体均看作理想气体)。
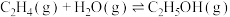 △H<0。向10L某恒容密闭容器中通入2mol
△H<0。向10L某恒容密闭容器中通入2mol (g)和a mol
(g)和a mol  (g),发生上述反应,测得
(g),发生上述反应,测得 (g)的平衡转化率与投料比X[
(g)的平衡转化率与投料比X[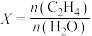 ]以及温度的关系如图所示。回答下列问题:
]以及温度的关系如图所示。回答下列问题:
(1)反应从开始分别进行到A、B、C点时,放出的热量
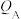 、
、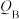 、
、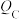 由大到小的顺序为
由大到小的顺序为(2)

 。已知该反应的反应速率表达式为
。已知该反应的反应速率表达式为 ,
,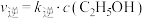 ,其中
,其中 、
、 为速率常数,只与温度有关。若其他条件不变,则温度从
为速率常数,只与温度有关。若其他条件不变,则温度从 变化到
变化到 的过程中,下列推断合理的是
的过程中,下列推断合理的是A.
 减小的倍数大于
减小的倍数大于 B.
B. 减小的倍数小于
减小的倍数小于
C.
 增大的倍数大于
增大的倍数大于 D.
D. 增大的倍数小于
增大的倍数小于
(3)若A点对应的体系中,反应从开始到达到平衡所用时间是2min,则0~2min内
 (g)的平均反应速率
(g)的平均反应速率
 。
。 温度下,反应的平衡常数K=
温度下,反应的平衡常数K=(4)B点对应的体系中,a=
 、
、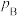 、
、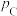 由大到小的顺序为
由大到小的顺序为
您最近一年使用:0次
解题方法
8 . 在容积为2L的密闭容器中发生反应: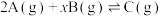 。图甲表示200℃时容器中A、B、C物质的量随时间的变化,图乙表示温度100℃和200℃平衡时C的体积分数随起始
。图甲表示200℃时容器中A、B、C物质的量随时间的变化,图乙表示温度100℃和200℃平衡时C的体积分数随起始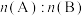 的变化关系,下列说法正确的是
的变化关系,下列说法正确的是

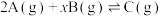 。图甲表示200℃时容器中A、B、C物质的量随时间的变化,图乙表示温度100℃和200℃平衡时C的体积分数随起始
。图甲表示200℃时容器中A、B、C物质的量随时间的变化,图乙表示温度100℃和200℃平衡时C的体积分数随起始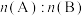 的变化关系,下列说法正确的是
的变化关系,下列说法正确的是
A.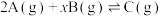 中, 中, |
B.200℃,反应从开始到平衡的平均速率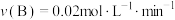 |
C.由图乙可知,反应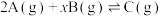 的 的 ,且 ,且 |
| D.当外界条件由200℃降温到100℃,原平衡一定被破坏,且正、逆反应速率均增大 |
您最近一年使用:0次
9 . 一定温度下, 溶液发生催化分解。不同时刻测得生成的
溶液发生催化分解。不同时刻测得生成的 的体积(已折算为标准状况下)如表。
的体积(已折算为标准状况下)如表。
下列叙述正确的是(溶液体积变化忽略不计)
 溶液发生催化分解。不同时刻测得生成的
溶液发生催化分解。不同时刻测得生成的 的体积(已折算为标准状况下)如表。
的体积(已折算为标准状况下)如表。| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
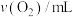 | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
A. 或 或 可以催化 可以催化 分解 分解 |
| B.第4min时的瞬时速率小于第6min时的瞬时速率 |
C.反应至6min时, 分解率为50% 分解率为50% |
D.0~6min的平均反应速率: |
您最近一年使用:0次
10 . 氨是一种重要的化工产品。回答下列问题:
(1)已知:①N2(g)+3H2(g) 2NH3(g) ΔH=-92.0kJ/mol
2NH3(g) ΔH=-92.0kJ/mol
②H2(g)+ O2(g)
O2(g) H2O(g) ΔH=-240.0kJ/mol
H2O(g) ΔH=-240.0kJ/mol
③2Fe(s)+ O2(g)
O2(g) Fe2O3(s) ΔH=-1644.0kJ/mol
Fe2O3(s) ΔH=-1644.0kJ/mol
则反应2NH3(g)+Fe2O3(s) N2(g)+3H2O(g)+2Fe(s) ΔH=
N2(g)+3H2O(g)+2Fe(s) ΔH=___________ kJ/mol,该反应在___________ (填“高温”“低温”或“任意温度”)下能自发进行。
(2)下列关于合成氨工艺的理解中,正确的有___________(填标号)。
(3)温度为T℃,压强恒定为pMPa,用Fe2O3处理NH3和HCN(起始时NH3的体积分数为58%)的混合气体,部分气体的体积分数随时间的变化如图,反应经30min达到平衡。

①0~30min内用NH3的压强变化表示的反应速率v(NH3)=___________ MPa·min-1。
②反应2NH3(g)+Fe2O3(s) N2(g)+3H2O(g)+2Fe(s)的平衡常数Kp=
N2(g)+3H2O(g)+2Fe(s)的平衡常数Kp=___________ (MPa)2 (列出计算式即可);若升高温度,该反应的平衡常数将___________ (填“增大”“减小”或“不变”)。
(4)在催化剂作用下,可用NH3去除NO,其反应原理为4NH3+6NO=5N2+6H2O。不同温度条件下,n(NH3):n(NO)分别为4:1、3∶1、1:3时,得到的NO脱除率曲线如图所示:
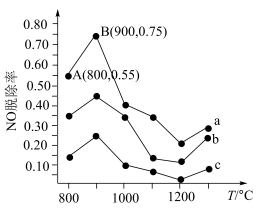
①曲线a中,在温度超过900℃时,NO脱除率骤然下降的原因可能是___________ 。
②曲线b对应的NH3与NO的物质的量之比是___________ 。
(1)已知:①N2(g)+3H2(g)
 2NH3(g) ΔH=-92.0kJ/mol
2NH3(g) ΔH=-92.0kJ/mol②H2(g)+
 O2(g)
O2(g) H2O(g) ΔH=-240.0kJ/mol
H2O(g) ΔH=-240.0kJ/mol③2Fe(s)+
 O2(g)
O2(g) Fe2O3(s) ΔH=-1644.0kJ/mol
Fe2O3(s) ΔH=-1644.0kJ/mol则反应2NH3(g)+Fe2O3(s)
 N2(g)+3H2O(g)+2Fe(s) ΔH=
N2(g)+3H2O(g)+2Fe(s) ΔH=(2)下列关于合成氨工艺的理解中,正确的有___________(填标号)。
| A.控制温度远高于室温,是为了保证尽可能高的平衡转化率和快的反应速率 |
| B.合成氨反应在不同温度下的ΔH和ΔS都小于零 |
| C.NH3易液化,不断将液氨移去,利于反应正向进行 |
| D.原料气中N2由分离空气得到,H2由天然气与水蒸气反应生成,原料气需要经过净化处理,以防催化剂中毒和安全事故发生 |
(3)温度为T℃,压强恒定为pMPa,用Fe2O3处理NH3和HCN(起始时NH3的体积分数为58%)的混合气体,部分气体的体积分数随时间的变化如图,反应经30min达到平衡。

①0~30min内用NH3的压强变化表示的反应速率v(NH3)=
②反应2NH3(g)+Fe2O3(s)
 N2(g)+3H2O(g)+2Fe(s)的平衡常数Kp=
N2(g)+3H2O(g)+2Fe(s)的平衡常数Kp=(4)在催化剂作用下,可用NH3去除NO,其反应原理为4NH3+6NO=5N2+6H2O。不同温度条件下,n(NH3):n(NO)分别为4:1、3∶1、1:3时,得到的NO脱除率曲线如图所示:

①曲线a中,在温度超过900℃时,NO脱除率骤然下降的原因可能是
②曲线b对应的NH3与NO的物质的量之比是
您最近一年使用:0次



