名校
1 . 下图为有关分子在催化剂作用下发生转化的示意图,下列叙述正确的是
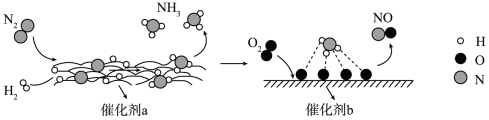
A. , , 均属于氮的固定 均属于氮的固定 |
| B.催化剂a、b表面均有极性共价键形成 |
C.如果向容器中放入1mol 和3mol 和3mol ,最终可以生成2mol ,最终可以生成2mol |
D.在催化剂b表面2.24L 反应生成NO转移电子数目为0.5NA 反应生成NO转移电子数目为0.5NA |
您最近一年使用:0次
2022-05-27更新
|
371次组卷
|
3卷引用:宁夏平罗中学2022-2023学年高一下学期期中考试化学试题
名校
解题方法
2 . Ni单原子催化剂具有良好的电催化性能,催化转化CO2的历程如下。
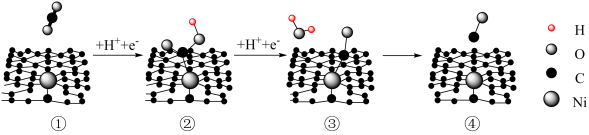
下列说法不正确 的是

下列说法
| A.过程①→②中C的杂化方式发生改变 |
| B.过程②→③涉及极性键的断裂与生成 |
| C.生成1molCO,需要2mol电子 |
| D.从反应历程看,Ni未参与反应 |
您最近一年使用:0次
2022-11-06更新
|
363次组卷
|
3卷引用:宁夏回族自治区银川市贺兰县第一中学2023-2024学年高三第三阶段化学考试
名校
解题方法
3 . 我国科技工作者运用DFT计算研究HCOOH在不同催化剂(Pd和Rh)表面分解产生 的部分反应过程如图所示,其中吸附在催化剂表面的物种用*表示。下列说法正确的是
的部分反应过程如图所示,其中吸附在催化剂表面的物种用*表示。下列说法正确的是
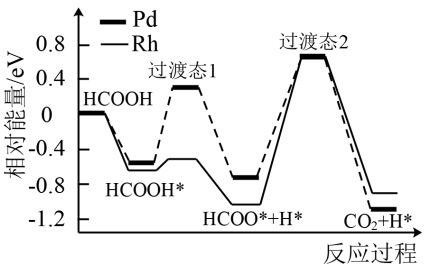
 的部分反应过程如图所示,其中吸附在催化剂表面的物种用*表示。下列说法正确的是
的部分反应过程如图所示,其中吸附在催化剂表面的物种用*表示。下列说法正确的是
A.Pd、Rh作催化剂时HCOOH分解产生 的 的 相同 相同 |
B.反应 在Pd和Rh表面进行时均为放热过程 在Pd和Rh表面进行时均为放热过程 |
C.HCOOH吸附在催化剂表面的过程 |
D.反应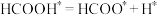 对总反应的速率影响相对较大 对总反应的速率影响相对较大 |
您最近一年使用:0次
2022-03-10更新
|
203次组卷
|
3卷引用:宁夏石嘴山市平罗中学2021-2022学年高二下学期第一次月考化学试题
名校
解题方法
4 . 化学反应的速率和限度对人类生产生活有重要的意义。
(1)已知Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O。甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响,设计实验如表(所取溶液体积均为2mL):
①上述实验中溶液最先变浑浊的是___________ (填实验编号,下同)。
②控制变量是科学研究的重要方法,为探究浓度对化学反应速率的影响,应选择___________
(2)在10 L的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
请回答:
①该反应的化学平衡常数表达式为K =___________ 。
②该反应为___________ (填“吸热”或“放热”)反应。
③能说明该反应达到化学平衡状态的是___________ (填字母)。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
④某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为___________ ℃。
(1)已知Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O。甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响,设计实验如表(所取溶液体积均为2mL):
| 实验编号 | 温度/℃ | c(Na2S2O3)/mol·L-1 | c(H2SO4)/mol·L-1 |
| Ⅰ | 25 | 0.1 | 0.1 |
| Ⅱ | 25 | 0.2 | 0.1 |
| Ⅲ | 50 | 0.2 | 0.1 |
①上述实验中溶液最先变浑浊的是
②控制变量是科学研究的重要方法,为探究浓度对化学反应速率的影响,应选择
(2)在10 L的密闭容器中,进行如下化学反应:CO2(g)+H2(g)
 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
请回答:
①该反应的化学平衡常数表达式为K =
②该反应为
③能说明该反应达到化学平衡状态的是
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
④某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为
您最近一年使用:0次
解题方法
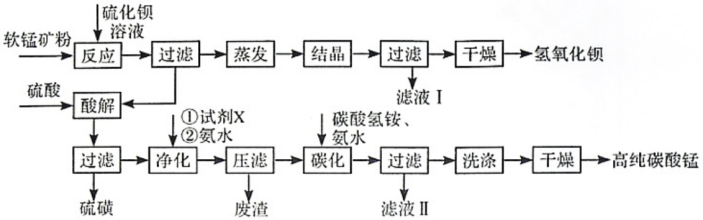
5 . 用软锰矿(主要成分为MnO2,所含杂质为质量分数约8%Fe3O4和约5%Al2O3)和BaS制备高纯MnCO3,同时制得Ba(OH)2,工艺流程如下:
已知:25℃时相关物质的Ksp见下表
回答下列问题:
(1)MnO2与BaS溶液反应转化为MnO的化学方程式为___________ ,能否通过加热的方式加快该反应的速率,___________ (填“能”或“否”)
(2)已知MnO2为两性氧化物,保持BaS投料量不变,随软锰矿粉与BaS投料比增大,S的量达到最大值后无明显变化,而Ba(OH)2的量达到最大值后会减小,减小的原因是___________ 。
(3)在实验室进行过滤操作时,除了使用铁架台和烧杯以外,还需要的玻璃仪器为___________ 。
(4)净化时需先加入的试剂X为___________ (填化学式) 。再使用氨水调溶液的pH,则pH的理论最小值为___________ (当溶液中某离子浓度小于1.0×10-5mol•L-1时,可认为该离子沉淀完全)。
(5)碳化过程中发生反应的离子方程式为___________ 。

已知:25℃时相关物质的Ksp见下表
| 物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 |
| Ksp | 1×10-16.3 | 1×10-38.6 | 1×10-32.3 | 1×10-12.7 |
(1)MnO2与BaS溶液反应转化为MnO的化学方程式为
(2)已知MnO2为两性氧化物,保持BaS投料量不变,随软锰矿粉与BaS投料比增大,S的量达到最大值后无明显变化,而Ba(OH)2的量达到最大值后会减小,减小的原因是
(3)在实验室进行过滤操作时,除了使用铁架台和烧杯以外,还需要的玻璃仪器为
(4)净化时需先加入的试剂X为
(5)碳化过程中发生反应的离子方程式为
您最近一年使用:0次
2021-03-14更新
|
445次组卷
|
3卷引用:宁夏石嘴山市2021届高三下学期3月高考质量监测(一模) 化学试题
10-11高一下·江西上饶·期中
名校
解题方法
6 . 影响化学反应速率的主要因素是
| A.浓度 | B.催化剂 | C.反应物本身的性质 | D.温度 |
您最近一年使用:0次
2021-01-14更新
|
615次组卷
|
50卷引用:宁夏银川市长庆高级中学2019-2020学年高一下学期期中考试化学试题
宁夏银川市长庆高级中学2019-2020学年高一下学期期中考试化学试题宁夏回族自治区石嘴山市平罗县平罗中学2020-2021学年高二上学期期中考试化学试题宁夏长庆高级中学2020-2021学年高一上学期期中考试化学试题2(已下线)2010-2011学年江西省鄱阳县油墩街中学高一下学期期中考试化学试卷(已下线)2010-2011学年河南省许昌市高一下学期四校期中联考化学试卷(已下线)2011-2012学年四川省金堂中学高一下学期期中考试化学试卷(已下线)2011-2012学年四川成都外国语学校高一下学期期中考试化学试卷(已下线)2011-2012学年广东省连州中学高一下学期期中考试化学试卷(已下线)2012—2013学年中大附中三水实验学校高二上期中文科化学试卷(已下线)2012-2013学年福建省福州文博中学高一下学期期末考试化学试卷(已下线)2012-2013学年四川省资阳市高一下学期期末检测化学试卷(已下线)2013-2014四川省资阳市高一下学期期末考试化学试卷(已下线)2014-2015学年山西大学附中第一学期高二化学试卷2015-2016学年黑龙江大庆铁人中学高二上9月考化学试卷2015-2016学年河北省望都中学高二上学期第二次月考化学试卷2015-2016学年四川省香港马会第五中学高二上10月月考化学试卷2015-2016学年吉林省吉林五十五中学高二上学期期末考试化学试卷2015-2016学年青海省西宁四中高二上学期期末化学试卷2015-2016学年浙江金华、温州、台州三市部分学校高一下期中化学卷2016-2017学年湖北省宜昌市葛洲坝中学高二上期中化学卷浙江省台州市书生中学2017-2018学年高二上学期第一次月考化学试题黑龙江省大庆市东风中学2017-2018学年高二上学期期中考试化学试题广东省深圳市罗湖区2017-2018学年高二上学期期末模拟化学试题河南省项城三高2017-2018学年高一下学期第二次段考(B卷)化学试题黑龙江省大庆十中2017-2018学年高一下学期期末考试化学试题浙江省宁波市咸祥中学2018-2019学年高二上学期期中考试化学试题湖北省利川市第五中学2018-2019学年高二上学期期中模拟考试化学试题内蒙古自治区巴彦淖尔市临河三中2018-2019学年高二上学期期中考试化学试题陕西省吴起高级中学2018-2019学年高一下学期第二次月考基础卷化学试题云南省弥勒市第二中学2019-2020学年高二上学期开学考试化学试题吉林省白山市抚松六中2019-2020学年高二上学期第一次月考化学试卷河北省唐山市开滦第二中学2019-2020学年高二上学期期中考试化学试题广东省广州市2019-2020学年高二上学期期中模拟测试化学试题(二)重庆市云阳县2019-2020学年高二上学期期中考试化学试题新疆吐蕃市高昌区第二中学2019-2020学年高一下学期期末考试化学试题福建省福州福清市2017-2018学年高二上学期期末考试化学试题(已下线)2.1.2 影响化学反应速率的因素(基础练)——2020-2021学年高二化学上学期十分钟同步课堂专练(苏教版选修4)四川省宜宾翠屏棠湖学校2020-2021学年高二上学期10月月考化学试题吉林油田第十一中学2020-2021学年高二上学期期中考试化学试题河北省石家庄市康福外国语学校2020-2021学年高二10月月考化学试题陕西省子洲中学2018-2019学年高一下学期期中考试化学试题福建省莆田第十五中学2018-2019学年高二上学期期末考试化学试题河北省唐山市丰润区第二中学2020-2021学年高二上学期1月月考化学试题江苏省淮安市高中校协作体2020-2021学年高一下学期期中考试化学试题新疆喀什巴楚县第一中学2020-2021学年高二下学期期中考试化学试题四川省成都市简阳市阳安中学2021-2022学年高二上学期9月月考化学试卷辽宁省清原满族自治县第二高级中学2020-2021学年高二上学期期中考试化学试题广东省肇庆市实验中学2021-2022学年高二上学期期中考试化学试题广东省珠海市2023-2024年高二上学期期中联考化学试题四川省眉山市仁寿第一中学校(北校区)2023-2024学年高二上学期11月期中化学试题
13-14高一下·天津·期中
名校
解题方法
7 . 少量铁片与l00mL 0.01mol/L的稀盐酸反应,反应速率太慢,为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )
①加H2O ②加KNO3溶液 ③滴入几滴浓盐酸 ④加入少量铁粉 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用10mL 0.1mol/L盐酸
①加H2O ②加KNO3溶液 ③滴入几滴浓盐酸 ④加入少量铁粉 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用10mL 0.1mol/L盐酸
| A.①⑥⑦ | B.③⑤ | C.③⑦⑧ | D.③④⑥⑦⑧ |
您最近一年使用:0次
2020-06-20更新
|
674次组卷
|
31卷引用:宁夏育才中学2017-2018学年高二上学期期中化学试题
宁夏育才中学2017-2018学年高二上学期期中化学试题宁夏育才中学2017-2018学年高二上学期期中考试化学试题(已下线)2013-2014天津市耀华中学高一下学期期中考试化学试卷2016届山东省新泰一中北校高三上学期第二次单元测试化学试卷2015-2016学年天津市耀华中学高一下期中化学试卷2015-2016学年湖南东部六校高一下期中化学试卷2015-2016学年山西省右玉一中高一下学期期中考试化学试卷2015-2016学年甘肃省天水一中高一下期中文科化学试卷2015-2016学年吉林长春第十一中高一下期末考化学2017届甘肃省兰州一中高三上12月月考化学试卷湖南省益阳市箴言中学2016-2017学年高一下学期期末化学试题吉林省乾安县第七中学2017-2018学年高二上学期月考化学试题山西省太原市小店区2017—2018学年高二化学上学期10月月考试题山西大学附属中学2017-2018学年高二上学期10月模块诊断化学试题辽宁省辽河油田第二高级中学2017-2018学年高二上学期月考化学试题甘肃省兰州第一中学2017-2018学年高二上学期期中考试化学(理)试题吉林省延边第二中学2017-2018学年高二上学期第二次月考化学试题【全国百强校】江西省高安中学2017-2018学年高一下学期期末考试化学试题【全国百强校】江西省南昌市第二中学2018-2019学年高二上学期第一次月考化学试题【全国百强校】山西省临汾市第一中学2018-2019学年高二上学期10月月考化学试题【全国百强校】江苏省启东中学2018-2019学年高二上学期期中考试化学试题辽宁省普兰店市第一中学2018-2019学年高二(理)上学期期中考试化学试题(已下线)考点11 化学反应速率——备战2019年浙江新高考化学考点江苏省大丰市新丰中学2018-2019学年高二下学期期中考试化学试题黑龙江省双鸭山市第一中学2019-2020学年高二上学期期中考试化学试题甘肃省武威第六中学2020届高三上学期第六次诊断考试化学试题吉林省辽源市田家炳高级中学2019-2020学年高一下学期期中考试化学试题江西省南昌市进贤县第一中学2019-2020学年高一下学期第二次月考化学试题江西省宜春市奉新县第一中学2019-2020学年高一下学期第二次月考化学试题人教版(2019)高二选择性必修第一册 第二章 化学反应速率与化学平衡 第一节 化学反应速率山西省临汾市县底中学校2020-2021学年高二上学期开学考试化学试题
名校
解题方法
8 . 已知分解1mol H2O2放出热量98kJ,在含少量I-的溶液中,H2O2的分解机理为:
H2O2+I-→H2O+IO-慢
H2O2+IO-→H2O+O2+I-快
下列说法正确的是
H2O2+I-→H2O+IO-慢
H2O2+IO-→H2O+O2+I-快
下列说法正确的是
| A.该反应的速率与I-的浓度有关 |
| B.IO-也是该反应的催化剂 |
| C.总反应中反应物的总能量小于生成物的总能量 |
| D.在相同时间内:v(H2O2)=v(H2O)=v(O2) |
您最近一年使用:0次
2022-04-22更新
|
203次组卷
|
3卷引用:宁夏石嘴山市平罗中学2021-2022学年高一下学期期中考试化学试题
宁夏石嘴山市平罗中学2021-2022学年高一下学期期中考试化学试题浙江省七彩阳光新高考研究联盟2021-2022学年高一下学期期中联考化学试题(已下线)【2023】【高一下】【期中考】【杭九】【高中化学】【赵燕丽收集】
名校
9 . 某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)实验室中现有Na2SO3、MgSO4、Ag2SO4、K2SO4等4种溶液,可与实验中CuSO4溶液起相似作用的是_______ ;
(2)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
①请完成此实验设计,其中: V9=_______ ;
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因_______ 。
(3)一定量的锌粉和6mol·L-1的过量盐酸反应,当向其中加入少量的下列物质时,能够加快反应速率,又不影响产生H2的总量的是
①石墨 ②CuO ③铜粉 ④铁粉 ⑤浓硫酸
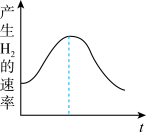
(4)把锌片投入盛有盐酸的敞口容器中,产生氢气的速率变化曲线如图所示,刚开始反应速率增大的原因是_______ ,后反应速率又减小的原因是_______ 。(填正确选项前的序号)
①盐酸的浓度 ②镁条的表面积 ③溶液的温度 ④Cl-的浓度
(1)实验室中现有Na2SO3、MgSO4、Ag2SO4、K2SO4等4种溶液,可与实验中CuSO4溶液起相似作用的是
(2)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 实验/混合溶液 | A | B | C | D | E | F |
| 4mol/L H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因
(3)一定量的锌粉和6mol·L-1的过量盐酸反应,当向其中加入少量的下列物质时,能够加快反应速率,又不影响产生H2的总量的是
①石墨 ②CuO ③铜粉 ④铁粉 ⑤浓硫酸
| A.①②④ | B.①③⑤ | C.③④⑤ | D.①③④ |
①盐酸的浓度 ②镁条的表面积 ③溶液的温度 ④Cl-的浓度

您最近一年使用:0次
名校
10 . 把下列四种X溶液分别加入四个盛有10mL 2mol/L的盐酸的烧杯中,立即加水均稀释到50mL,此时X溶液和盐酸进行反应,其中反应速率最大的是
| A.10mL 4mol/L的X溶液 | B.30mL 2mol/L的X溶液 |
| C.3mL 10mol/L的X溶液 | D.15mL 3mol/L的X溶液 |
您最近一年使用:0次
2020-07-25更新
|
602次组卷
|
7卷引用:宁夏银川市第二中学2021-2022学年高一下学期期中考试化学试题
宁夏银川市第二中学2021-2022学年高一下学期期中考试化学试题云南省昆明市官渡区第一中学2019-2020学年高二下学期期中考试化学试题(已下线)2.2 影响化学反应速率的因素(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)(已下线)第二章 化学反应速率和化学平衡(基础过关)-2020-2021学年高二化学单元测试定心卷(人教版选修4)人教版(2019)高二化学选择性必修1第二章 化学反应速率与化学平衡 第一节 化学反应速率 课时2 影响化学反应速率的因素吉林省长春市九台师范高中2020-2021学年高一下学期第一阶段考试化学试题河南省南阳市第一中学校2022-2023学年高二上学期开学考试化学试题



