名校
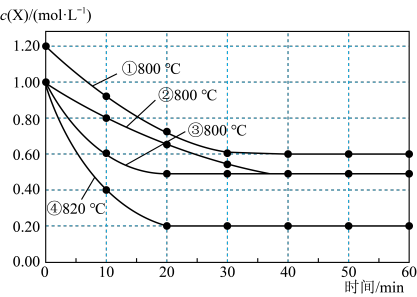
1 . 研究反应2X(g) Y(g)+Z(g)的速率影响因素,在不同条件下进行4组实验,Y、Z起始浓度为0,反应物X的浓度
Y(g)+Z(g)的速率影响因素,在不同条件下进行4组实验,Y、Z起始浓度为0,反应物X的浓度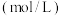 随反应时间
随反应时间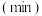 的变化情况如下图所示。下列说法不正确的是
的变化情况如下图所示。下列说法不正确的是
 Y(g)+Z(g)的速率影响因素,在不同条件下进行4组实验,Y、Z起始浓度为0,反应物X的浓度
Y(g)+Z(g)的速率影响因素,在不同条件下进行4组实验,Y、Z起始浓度为0,反应物X的浓度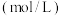 随反应时间
随反应时间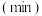 的变化情况如下图所示。下列说法不正确的是
的变化情况如下图所示。下列说法不正确的是
| A.比较实验②、④得出:升高温度,化学反应速率加快 |
| B.比较实验①、④得出:升高温度,化学反应速率加快 |
| C.实验③一定是使用了催化剂,催化剂能同等程度改变正、逆反应速率 |
D.在0 10min之间,实验②的平均速率 10min之间,实验②的平均速率 |
您最近一年使用:0次
名校
2 . 某科研人员研究得出,HCHO可在羟基磷灰石(HAP)表面催化氧化生成CO2和H2O,其历程示意图如下(图中只画出了HAP的部分结构)。
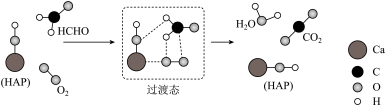
| A.HAP加快了HCHO与O2反应的速率,同时提高了HCHO的平衡转化率 |
B.HCHO的电子式为: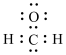 |
| C.根据图示信息,反应中既有极性键、非极性键的断裂,也有极性键、非极性键的形成 |
D.该过程的总反应是HCHO+O2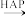 CO2+H2O CO2+H2O |
您最近一年使用:0次
2023-09-29更新
|
84次组卷
|
2卷引用:宁夏回族自治区银川一中2023-2024学年高三上学期第二次月考理科综合化学试题
名校
解题方法
3 . 如图所示为CFCl3破坏臭氧层的过程,下列说法不正确的是
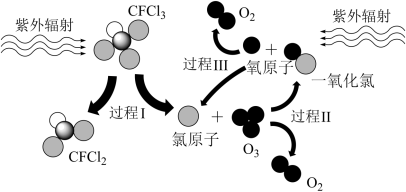
| A.过程Ⅰ中断裂C—Cl键 | B.过程Ⅱ可表示为O3+Cl=ClO+O2 |
| C.过程Ⅲ中O+O=O2是吸热过程 | D.上述过程说明CFCl3中的氯原子是破坏臭氧层的催化剂 |
您最近一年使用:0次
2023-09-13更新
|
203次组卷
|
62卷引用:宁夏回族自治区银川一中2020届高三下学期第五次模拟考试理综化学试题
宁夏回族自治区银川一中2020届高三下学期第五次模拟考试理综化学试题宁夏六盘山市高级中学2020-2021学年高三下学期第二次模拟测试理综化学试题河南省林州市第一中学2018届高三8月调研考试化学试题辽宁省大连育明高级中学2018届高三人教版选修四同步周测三化学试题河南省豫南豫北名校2018届高三精英联赛化学试题1陕西省陕师大附中2018届高三第五次月考化学试题河南省豫南豫北名校2018届高三精英联赛化学试题2北京市第十中学2019届高三第一学期10月月考化学试题北京市海淀区101中学2018-2019学年下学期高二期中考试化学试题河北省张家口第一中学2019-2020学年高二9月月考化学试题北京市昌平区新学道临川学校2020届高三上学期期中考试化学试题陕西省西安中学2019-2020学年高二上学期期中考试化学试题山东省济南市历城二中2020届高三一轮复习验收化学试题(已下线)《2020年新高考政策解读与配套资源》模拟试题11-2020年北京新高考化学模拟试题(已下线)考点06 化学能与热能-2020年高考化学命题预测与模拟试题分类精编北京市通州区2020届高三第一次模拟考试化学试题四川省攀枝花市第十五中学2019-2020学年高二上学期第二次月考化学试题安徽省六安市舒城中学2019-2020学年高一下学期第一次月考化学试题内蒙古自治区乌兰察布市集宁一中2019-2020学年高一下学期第三次月考化学试题湖南省岳阳市2019-2020学年高二下学期期末考试化学试题河北省张家口市宣化区宣化第一中学2020-2021学年高二上学期9月月考化学试题鲁科版(2019)高一必修第二册 第2章 化学键 反应规律 章末综合检测卷江西省南昌市第二中学2020-2021学年高二上学期第一次月考化学试题河北省沧州市泊头市第一中学2020-2021学年高二上学期第一次月考化学试题山西省长治市第二中学校2020-2021学年高二上学期第一次月考化学试题北京首都师范大学第二附属中学2021届高三10月月考化学试题山东省济宁市曲阜市第一中学2020-2021学年高二上学期阶段性检测(9月月考)化学试题海南儋州市第一中学2020-2021学年高二上学期第一次月考化学试题山东省烟台市中英文学校2021届高三上学期冬学竞赛化学试题(人教版2019)必修第二册 第六章 化学反应与能量 第一节 化学反应与能量变化湖南省炎德英才大联考长沙市第一中学2021届高三上学期第五次月考化学试题河北省衡水市安平中学2020-2021学年高一下学期第一次月考化学试题河北省唐山市一中2020-2021学年高二下学期期中考试化学试题山东省日照市莒县2020-2021学年高一下学期期中考试化学试题江西省名校2021-2022学年高二上学期第一次月考化学试题江西省南昌八一中学2021-2022学年高二上学期10月份月考化学试题安徽省淮北市树人高级中学2021-2022学年高二上学期第一次月考化学试题广东省普宁市第二中学2021-2022学年高二上学期9月份第一次月考化学试题福建省莆田市第二中学2021-2022学年高二上学期10月阶段检测化学试题广东省执信中学番禺附属学校2021-2022学年高二上学期期中考试化学试题浙江省S9联盟2021-2022学年高二上学期期中联考化学试题浙江省金衢六校联盟2021-2022学年高二上学期期末联考化学试题广东省佛山市第一中学2021-2022学年高二上学期第一次段考化学试题 吉林省松原市长岭县第三中学2021-2022学年高二上学期第三次考试化学试题福建省厦门双十中学2021-2022学年高一下学期期中考试化学试题福建省厦门双十中学2021-2022学年高一下学期期中考试化学试题山东省新泰市第一中学2021-2022学年高一下学期期中考试化学试题河北省沧州市泊头市第一中学2021-2022学年高二上学期第一次月考化学试题新疆柯坪县柯坪湖州国庆中学2021-2022学年高二下学期期末考试化学试题四川省成都外国语学校2022-2023学年高二上学期期中考试化学试题河北省藁城新冀明中学2021-2022学年高三上学期第一次月考化学试题北京市第三十五中学2022-2023学年高二上学期10月月考化学试题辽宁省葫芦岛市第八高级中学2021–2022学年高二上学期期中考试化学试题山东省滨州市博兴第二中学2022-2023学年高一下学期第二次月考化学试题广西柳州地区民族高级中学2022-2023学年高二下学期期中考试化学试题河南省洛阳市2022-2023学年高二下学期质量检测化学试题(已下线)2023年湖南卷高考真题变式题(选择题6-10)河南省洛阳市 洛宁县第一高级中学2022-2023学年高二下学期5月质量检测化学试题江苏省连云港市东海县石榴高级中学2022-2023学年高二上学期第一次学情测试化学试题广东省佛山市三水中学2022-2023学年高二上学期10月第一次统测化学试题北京市首都师范大学附属中学2023-2024学年高三下学期3月月考化学试题广西防城港市实验高级中学2023-2024学年高二下学期期中考试化学试题
名校
4 . 为探究锌与0.1 mol/L稀硫酸的反应速率[以υ(H2)表示],对反应物作出如下改变。下列判断正确的是
| A.加入NH4HSO4固体,υ(H2)不变 |
| B.加入少量水,υ(H2)减小 |
| C.把0.1 mol/L稀硫酸改为0.2 mol/L盐酸,υ(H2)增大 |
| D.把稀硫酸改为98%的浓硫酸,υ(H2)增大 |
您最近一年使用:0次
2023-08-27更新
|
773次组卷
|
4卷引用:宁夏青铜峡市宁朔中学2023-2024学年高二上学期期中考试化学试题
名校
5 . 反应
 ,在一定条件下达到平衡状态,下列有关叙述正确的有
,在一定条件下达到平衡状态,下列有关叙述正确的有
①增加A的量,平衡向正反应方向移动;
②加入催化剂,B的转化率不变;
③压强增大一倍,平衡不移动,υ(正)、υ(逆)不变;
④增大B的浓度,υ(正)>υ(逆);
⑤升高温度,平衡向逆反应方向移动,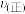 减小
减小

 ,在一定条件下达到平衡状态,下列有关叙述正确的有
,在一定条件下达到平衡状态,下列有关叙述正确的有①增加A的量,平衡向正反应方向移动;
②加入催化剂,B的转化率不变;
③压强增大一倍,平衡不移动,υ(正)、υ(逆)不变;
④增大B的浓度,υ(正)>υ(逆);
⑤升高温度,平衡向逆反应方向移动,
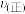 减小
减小| A.1个 | B.2个 | C.3个 | D.4个 |
您最近一年使用:0次
2023-07-14更新
|
331次组卷
|
3卷引用:宁夏青铜峡市宁朔中学2023-2024学年高二上学期期中考试化学试题
名校
解题方法
6 . 已知CaCO3和盐酸反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑,下列措施中可使生成CO2的速率加快的是(不考虑CaCO3与盐酸接触面积改变的影响)
| A.增加CaCO3的量 |
| B.增加盐酸的浓度 |
| C.增加盐酸的量 |
| D.减小CaCl2的浓度 |
您最近一年使用:0次
2023-07-05更新
|
448次组卷
|
11卷引用:【全国百强校】宁夏回族自治区银川一中2018-2019学年高一下学期期中考试化学试题
【全国百强校】宁夏回族自治区银川一中2018-2019学年高一下学期期中考试化学试题吉林省汪清县第六中学2016-2017学年高一下学期第二次月考化学试题河北省唐山市开滦第二中学2016-2017学年高二下学期期末考试化学试题四川省广安市岳池县顾县中学2019—2020学年第一学期高二上学期期中测试化学(选修四)试题人教版(2019)高二化学选择性必修1第二章 化学反应速率与化学平衡 第一节 化学反应速率 课时2 影响化学反应速率的因素专题2 第一单元 第2课时 物质的检验 物质性质和变化的探究-高中化学苏教2019版必修第一册海南省三亚华侨学校(南新校区)2021-2022学年高二上学期10月月考化学试题 (已下线)第11讲 物质的性质和变化探究-【暑假自学课】2023年新高一暑假精品课(苏教版2019)江西省吉安市吉州区部分学校联考2022-2023学年高一下学期7月期末考试化学试题云南省大理白族自治州民族中学2022-2023学年高二下学期开学考试化学试题(已下线)6.2.1化学反应的速率-随堂练习
名校
解题方法
7 . 将盐酸滴到碳酸钙固体上,能使反应的最初速率加快的是:
| A.盐酸浓度不变,使用量增大1倍 |
| B.盐酸浓度增加1倍,用量减至1/2 |
| C.将碳酸钙粉末改为块状 |
| D.使反应在较低温度下进行 |
您最近一年使用:0次
名校
8 . 定条件下,发生反应A(g)+B(g) C(g) △H>0,达到平衡后根据下列图像判断:
C(g) △H>0,达到平衡后根据下列图像判断:
A.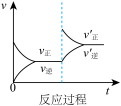 B.
B.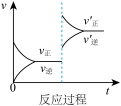 C.
C. D.
D.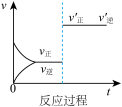 E.
E.
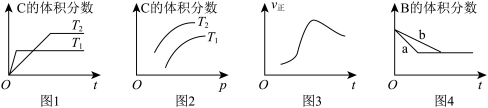
(1)表示升高温度,达到新平衡的是图______ (填“A”、“B”、“C”、“D”或“E”,下同),新平衡中C的质量分数______ (填“增大”、“减小”或“不变”,下同)。
(2)表示降低压强,达到新平衡的是图______ ,A的转化率______ 。
(3)表示减少C的浓度,达到新平衡的是图______ ,表示使用催化剂,达新平衡的是图。
(4)增加A的浓度,达到新平衡的是图______ ,达到平衡后A的转化率______ 。
 C(g) △H>0,达到平衡后根据下列图像判断:
C(g) △H>0,达到平衡后根据下列图像判断:A.
 B.
B. C.
C. D.
D. E.
E.
(1)表示升高温度,达到新平衡的是图
(2)表示降低压强,达到新平衡的是图
(3)表示减少C的浓度,达到新平衡的是图
(4)增加A的浓度,达到新平衡的是图
您最近一年使用:0次
2023-04-24更新
|
266次组卷
|
2卷引用:宁夏青铜峡市宁朔中学2023-2024学年高二上学期期中考试化学试题
名校
解题方法
9 . 某化学研究小组探究外界条件对化学反应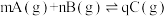 的速率和平衡的影响,如图所示,下列判断错误的是
的速率和平衡的影响,如图所示,下列判断错误的是
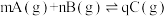 的速率和平衡的影响,如图所示,下列判断错误的是
的速率和平衡的影响,如图所示,下列判断错误的是
A.由图1可知, ,该反应的正反应为放热反应 ,该反应的正反应为放热反应 |
B.由图2可知,该反应的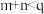 |
| C.图3是绝热条件下正反应速率和时间的图像(从反应物开始投料),由此说明该反应放热 |
| D.图4中,曲线a可能使用了催化剂 |
您最近一年使用:0次
2023-04-01更新
|
462次组卷
|
3卷引用:宁夏青铜峡市宁朔中学2023-2024学年高二上学期期中考试化学试题
名校
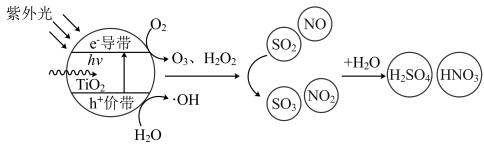
10 . 近年来光催化处理船舶尾气技术被称为是一种“绿色友好”技术,以 半导体为基底的纳米催化剂,表面经光激发后产生空穴和光生电子,光生空穴被表面吸附水或氢氧根离子捕获生成
半导体为基底的纳米催化剂,表面经光激发后产生空穴和光生电子,光生空穴被表面吸附水或氢氧根离子捕获生成 自由基,光生电子则与
自由基,光生电子则与 等反应在催化剂表面生成
等反应在催化剂表面生成 、
、 等氧化物,这些氧化物作用于尾气中的
等氧化物,这些氧化物作用于尾气中的 、
、 等污染物并将其氧化降解,原理见图。下列说法错误的是
等污染物并将其氧化降解,原理见图。下列说法错误的是
 半导体为基底的纳米催化剂,表面经光激发后产生空穴和光生电子,光生空穴被表面吸附水或氢氧根离子捕获生成
半导体为基底的纳米催化剂,表面经光激发后产生空穴和光生电子,光生空穴被表面吸附水或氢氧根离子捕获生成 自由基,光生电子则与
自由基,光生电子则与 等反应在催化剂表面生成
等反应在催化剂表面生成 、
、 等氧化物,这些氧化物作用于尾气中的
等氧化物,这些氧化物作用于尾气中的 、
、 等污染物并将其氧化降解,原理见图。下列说法错误的是
等污染物并将其氧化降解,原理见图。下列说法错误的是
A.含有氮氧化物、硫氧化物的尾气排放到大气中易形成酸雨, 小于7的雨水为酸雨 小于7的雨水为酸雨 |
B.除 、NO的总反应分别为 、NO的总反应分别为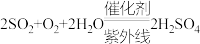 、 、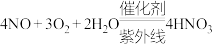 |
| C.催化剂可以改变氮氧化物、硫氧化物被氧化的速率 |
| D.尾气中含有大量有害物质,但经过科学的处理可以转化为多种有实用价值的物质 |
您最近一年使用:0次
2023-03-25更新
|
413次组卷
|
4卷引用:宁夏回族自治区银川一中2022-2023学年高一下学期期中考试化学试题



