2022·山东·模拟预测
名校
解题方法
1 . 氨气是重要的基础化工品。回答下列问题:
I. 在尿素合成塔中发生的反应可表示为: 2NH3(g)+CO2(g)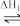 NH2COONH4(l)
NH2COONH4(l)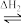 [CO(NH2)2](s)+H2O(g);已知第一步反应为快速反应,△H1=-119.2kJ·mol-1,第二步反应为慢速反应,△H2=+15.5kJ·mol-1,
[CO(NH2)2](s)+H2O(g);已知第一步反应为快速反应,△H1=-119.2kJ·mol-1,第二步反应为慢速反应,△H2=+15.5kJ·mol-1,
(1)下列图像能表示尿素合成塔中发生反应的能量变化历程的是_______(填标号)。
II.工业上使用氨气生产尿素,在一个体积恒为1L的恒温密闭容器中充入2mol CO2和4mol NH3的混合气体,经历反应1、2合成CO(NH2)2,经历如下两个过程:
反应1;2NH3(g)+CO2(g)⇌NH2COONH4(s) ΔH1= - 159.50kJ·mol-1
反应2:NH2COONH4(s)⇌CO(NH2)2(s) + H2O(g) ΔH2= + 72.50kJ·mol-1
(2)能说明反应1达到平衡状态的是(暂不考虑反应2)__ (填标号)。
①混合气体的压强不变
②混合气体的密度不变
③相同时间内断裂3molN-H键,同时形成1molCO2
④混合气体的平均相对分子质量不变
⑤NH3的体积分数不变
(3)混合气体中氨气体积分数及气体总浓度随时间变化如图所示,对于反应I,A点正反应速率与B点逆反应速率大小关系是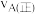
_______ 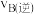 (填“>”“<”或“=”),在B点氨气的转化率为
(填“>”“<”或“=”),在B点氨气的转化率为__ 。

III.恒温恒容的密闭容器中,在某催化剂表面上发生2NH3(g)⇌N2(g)+3H2(g) 。测得在同种催化剂下分解的实验数据如下表所示:
。测得在同种催化剂下分解的实验数据如下表所示: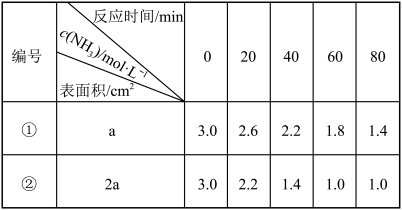
(4)根据组①数据,随着反应进行,c(NH3)减小,平均反应速率_______ (填“变大”“变小”或“不变”),对该变化的合理解释是_______ 。
(5)在科学家推出合成氨反应在接近平衡时净反应速率方程式为: ,
, ,
, 分别为正、逆反应速率常数,p代表各组分的分压,如
分别为正、逆反应速率常数,p代表各组分的分压,如 ,其中
,其中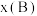 为平衡体系中B的体积分数,p为平衡总压强16MPa,以铁为催化剂时
为平衡体系中B的体积分数,p为平衡总压强16MPa,以铁为催化剂时 ,一定条件下,向容器中充入5mol N2和15mol
,一定条件下,向容器中充入5mol N2和15mol 的混合气体,平衡时氨气的质量分数为40%,试计算
的混合气体,平衡时氨气的质量分数为40%,试计算
_______ 。
I. 在尿素合成塔中发生的反应可表示为: 2NH3(g)+CO2(g)
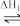 NH2COONH4(l)
NH2COONH4(l)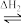 [CO(NH2)2](s)+H2O(g);已知第一步反应为快速反应,△H1=-119.2kJ·mol-1,第二步反应为慢速反应,△H2=+15.5kJ·mol-1,
[CO(NH2)2](s)+H2O(g);已知第一步反应为快速反应,△H1=-119.2kJ·mol-1,第二步反应为慢速反应,△H2=+15.5kJ·mol-1,(1)下列图像能表示尿素合成塔中发生反应的能量变化历程的是_______(填标号)。
A.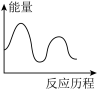 | B. | C. | D. |
II.工业上使用氨气生产尿素,在一个体积恒为1L的恒温密闭容器中充入2mol CO2和4mol NH3的混合气体,经历反应1、2合成CO(NH2)2,经历如下两个过程:
反应1;2NH3(g)+CO2(g)⇌NH2COONH4(s) ΔH1= - 159.50kJ·mol-1
反应2:NH2COONH4(s)⇌CO(NH2)2(s) + H2O(g) ΔH2= + 72.50kJ·mol-1
(2)能说明反应1达到平衡状态的是(暂不考虑反应2)
①混合气体的压强不变
②混合气体的密度不变
③相同时间内断裂3molN-H键,同时形成1molCO2
④混合气体的平均相对分子质量不变
⑤NH3的体积分数不变
(3)混合气体中氨气体积分数及气体总浓度随时间变化如图所示,对于反应I,A点正反应速率与B点逆反应速率大小关系是
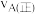
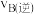 (填“>”“<”或“=”),在B点氨气的转化率为
(填“>”“<”或“=”),在B点氨气的转化率为
III.恒温恒容的密闭容器中,在某催化剂表面上发生2NH3(g)⇌N2(g)+3H2(g)
 。测得在同种催化剂下分解的实验数据如下表所示:
。测得在同种催化剂下分解的实验数据如下表所示:
(4)根据组①数据,随着反应进行,c(NH3)减小,平均反应速率
(5)在科学家推出合成氨反应在接近平衡时净反应速率方程式为:
 ,
, ,
, 分别为正、逆反应速率常数,p代表各组分的分压,如
分别为正、逆反应速率常数,p代表各组分的分压,如 ,其中
,其中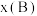 为平衡体系中B的体积分数,p为平衡总压强16MPa,以铁为催化剂时
为平衡体系中B的体积分数,p为平衡总压强16MPa,以铁为催化剂时 ,一定条件下,向容器中充入5mol N2和15mol
,一定条件下,向容器中充入5mol N2和15mol 的混合气体,平衡时氨气的质量分数为40%,试计算
的混合气体,平衡时氨气的质量分数为40%,试计算
您最近一年使用:0次
解题方法
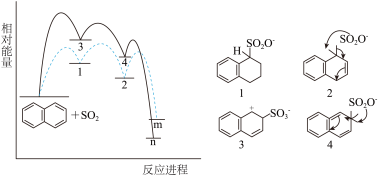
2 . 萘与三氧化硫反应同时生成α-萘磺酸(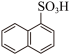 )与β-萘磺酸(
)与β-萘磺酸(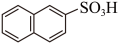 ),稳定性β-萘磺酸>α-萘磺酸,反应过程中的能量变化如图所示,1、2、3、4是中间产物,m、n各代表一种产物。下列说法正确的是
),稳定性β-萘磺酸>α-萘磺酸,反应过程中的能量变化如图所示,1、2、3、4是中间产物,m、n各代表一种产物。下列说法正确的是
 )与β-萘磺酸(
)与β-萘磺酸( ),稳定性β-萘磺酸>α-萘磺酸,反应过程中的能量变化如图所示,1、2、3、4是中间产物,m、n各代表一种产物。下列说法正确的是
),稳定性β-萘磺酸>α-萘磺酸,反应过程中的能量变化如图所示,1、2、3、4是中间产物,m、n各代表一种产物。下列说法正确的是
| A.较高温度下,反应的主要产物是β-萘磺酸 |
| B.升高相同温度,生成β-萘磺酸的反应速率变化更大 |
| C.实验中测得2的浓度大于4,是因为生成m的反应焓变更大 |
| D.选择不同催化剂,对产物中m、n的含量不会产生影响 |
您最近一年使用:0次
解题方法
3 . Rh(I)-3-羟基-2-硝基吡啶催化甲醇羰基化制备乙酸具有更好的稳定性和更高的催化剂活性,其机理如图所示。已知:TS1、TS2、TS3表示过渡态。下列说法正确的是
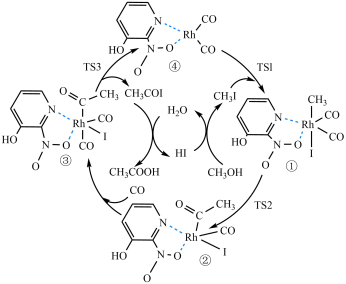
A.①→②反应过程中仅有 键的断裂与形成 键的断裂与形成 |
| B.CO做配体时,C的配位能力小于O |
| C.增大Rh(I)-3-羟基-2-硝基吡啶的用量,甲醇的平衡转化率增大 |
| D.通过定量测定发现,反应过程中物质②含量最少,其可能原因是②→③为快反应 |
您最近一年使用:0次
2023-04-25更新
|
512次组卷
|
3卷引用:山东省菏泽市2023届高三二模化学试题
名校
4 . 氨( )中氢含量高,是一种优良的储氢载体,可通过氨热分解法制氢气。在一定温度下,将
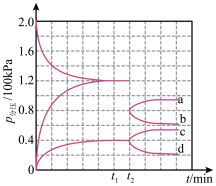
)中氢含量高,是一种优良的储氢载体,可通过氨热分解法制氢气。在一定温度下,将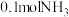 通入3L的刚性密闭容器中进行反应(此时容器内总压为200kPa),各物质的分压随时间的变化曲线如图所示。下列说法错误的是
通入3L的刚性密闭容器中进行反应(此时容器内总压为200kPa),各物质的分压随时间的变化曲线如图所示。下列说法错误的是
 )中氢含量高,是一种优良的储氢载体,可通过氨热分解法制氢气。在一定温度下,将
)中氢含量高,是一种优良的储氢载体,可通过氨热分解法制氢气。在一定温度下,将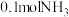 通入3L的刚性密闭容器中进行反应(此时容器内总压为200kPa),各物质的分压随时间的变化曲线如图所示。下列说法错误的是
通入3L的刚性密闭容器中进行反应(此时容器内总压为200kPa),各物质的分压随时间的变化曲线如图所示。下列说法错误的是
A. 时反应达到平衡, 时反应达到平衡, 时间内的反应速率 时间内的反应速率 |
B.该反应的平衡常数为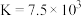 |
C. 时将容器容积迅速缩小至原来的一半并保持不变,曲线b表示压缩后 时将容器容积迅速缩小至原来的一半并保持不变,曲线b表示压缩后 分压的变化 分压的变化 |
D. 时加入催化剂可同时改变该反应的速率和 时加入催化剂可同时改变该反应的速率和 |
您最近一年使用:0次
2023-01-13更新
|
202次组卷
|
3卷引用:山东省临沂第一中学2021-2022学年高二上学期期末检测化学试题
5 . 反应Ⅰ、Ⅱ、Ⅲ均会在工业生产硝酸过程中发生,其中反应Ⅰ、Ⅱ发生在氧化炉中,反应Ⅲ发生在氧化塔中,不同温度下各反应的化学平衡常数如下表所示。下列说法正确的是
| 温度/K | 化学平衡常数 | |||
| 反应Ⅰ:4NH3+5O2=4NO+6H2O | 反应Ⅱ:4NH3+3O2=2N2+6H2O | 反应Ⅲ:2NO+O2=2NO2 | ||
| 500 | 1.1×1026 | 7.1×1034 | 1.3×102 | |
| 700 | 2.1×1019 | 2.6×1025 | 1.0 | |
| A.使用选择性催化反应Ⅰ的催化剂不能增大氧化炉中NO的含量 |
| B.通过改变氧化炉的温度可促进反应Ⅰ而抑制反应Ⅱ |
| C.通过改变氧化炉的压强可促进反应Ⅰ而抑制反应Ⅱ |
| D.氧化炉出气在进入氧化塔前应进一步降低温度 |
您最近一年使用:0次
2022-10-11更新
|
114次组卷
|
2卷引用:山东省莱州一中2022-2023学年高二上学期第一次月考化学试题
名校
解题方法
6 . 大气中温室气体含量剧增是导致异常天气出现的原因之一,温室气体二氧化碳和甲烷的再利用一直备受关注。研究发现CH4和CO2在催化剂作用下转化为CH3COOH,该反应在不同温度下,其催化剂催化效率和乙酸生成速率变化如图。下列关于该反应的说法错误的是
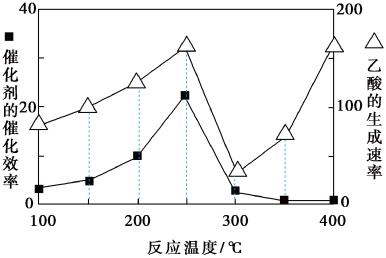

| A.及时分离出乙酸,可以提高该反应的速率 |
| B.温度超过250℃后,催化剂降低该反应活化能的功效在下降 |
| C.根据图象可知,实际生产中选择的适宜温度是250℃ |
| D.温度低于250℃时,乙酸生成速率加快是催化剂和反应温度协同作用的结果 |
您最近一年使用:0次
2022-09-20更新
|
184次组卷
|
2卷引用:山东省潍坊高密市第三中学2021-2022学年高二上学期12月月考化学试题
7 . CH4超干重整CO2技术可得到富含CO的气体,该技术中的化学反应为:CH4(g)+3CO2(g) 2H2O(g)+4CO(g) △H>0。图1表示初始投料比n(CH4):n(CO2)为1∶3或1∶4时,CH4的转化率与温度、压强的关系(投料比用a1、a2表示)。图2表示该反应的催化转化原理。下列说法正确的是
2H2O(g)+4CO(g) △H>0。图1表示初始投料比n(CH4):n(CO2)为1∶3或1∶4时,CH4的转化率与温度、压强的关系(投料比用a1、a2表示)。图2表示该反应的催化转化原理。下列说法正确的是
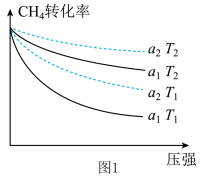
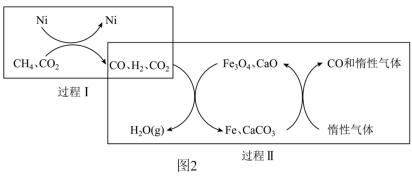
 2H2O(g)+4CO(g) △H>0。图1表示初始投料比n(CH4):n(CO2)为1∶3或1∶4时,CH4的转化率与温度、压强的关系(投料比用a1、a2表示)。图2表示该反应的催化转化原理。下列说法正确的是
2H2O(g)+4CO(g) △H>0。图1表示初始投料比n(CH4):n(CO2)为1∶3或1∶4时,CH4的转化率与温度、压强的关系(投料比用a1、a2表示)。图2表示该反应的催化转化原理。下列说法正确的是

| A.其他条件不变,按照a2投料,产物CO的百分含量最高 |
| B.a1=1:3,T2>T1 |
| C.过程II的催化剂为CaO和Fe |
| D.过程I和过程II中均只发生氧化还原反应 |
您最近一年使用:0次
名校
解题方法
8 . 乙苯与 在光照条件下反应生成两种一氯取代物,反应过程中的能量变化如图所示。下列说法错误的是
在光照条件下反应生成两种一氯取代物,反应过程中的能量变化如图所示。下列说法错误的是
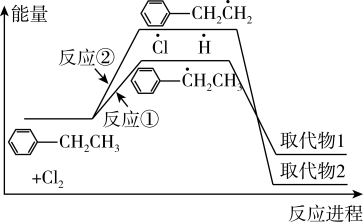
 在光照条件下反应生成两种一氯取代物,反应过程中的能量变化如图所示。下列说法错误的是
在光照条件下反应生成两种一氯取代物,反应过程中的能量变化如图所示。下列说法错误的是
A.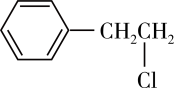 比 比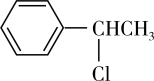 稳定 稳定 |
| B.反应①比反应②的速率快 |
| C.选择合适催化剂可提高单位时间内取代物2的含量 |
| D.若升温时取代物2的含量提高,则原因是反应②平衡正向移动 |
您最近一年使用:0次
2022-01-25更新
|
600次组卷
|
5卷引用:山东省威海市2021-2022学年高三上学期期末考试化学试题
山东省威海市2021-2022学年高三上学期期末考试化学试题河南省豫北名校2021-2022学年高二下学期4月份教学质量检测化学试题(已下线)【直击双一流】03-备战2022年高考化学名校进阶模拟卷(通用版)上海市南洋模范中学2022届高三等级考模拟训练七化学试题湖南省衡阳市第八中学2022-2023学年高二下学期第二次月考化学试题
名校
9 . 下列关于反应速率与反应限度的说法正确的是
| A.钠与水反应时,增加水的用量能明显增大反应速率 |
| B.合成氨工业采用循环操作的主要目的是提高平衡体系中氨的含量 |
| C.催化剂能加快反应速率的原因是它能降低反应的活化能,减小反应的焓变 |
| D.升温能提高反应物的能量,增大反应物间的碰撞频率,加快反应速率 |
您最近一年使用:0次
2021-11-18更新
|
141次组卷
|
2卷引用:山东省青岛市4区市2021-2022学年高二上学期期中考试化学试题
10 . 亚硝酰硫酸(NOSO4H)是一种浅黄色液体,遇水易分解,溶于浓硫酸,主要用于染料、医药领域的重氮化反应。实验室用如图装置(夹持装置略)制备少量NOSO4H,并测定产品中杂质硝酸的含量。
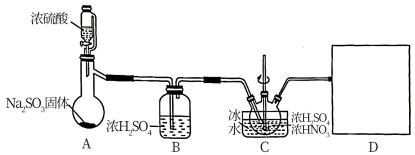
回答下列问题:
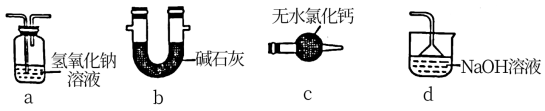
(1)装置A中盛装Na2SO3固体的仪器名称是_______ ,装置D最好选用_______ (填序号)。
(2)装置C中浓HNO3与SO2在浓H2SO4作用下反应制得NOSO4H。
①装置C中温度过高产率降低的原因是_______ 。
②开始通SO2时,反应缓慢,待生成少量NOSO4H后,温度变化不大,但反应速率明显加快,其原因是_______ 。
(3)测定亚硝酰硫酸产品中杂质硝酸的含量。
称取1.400g产品放入250mL锥形瓶中,加80mL浓硫酸,用
 标准溶液滴定,消耗标准溶液20.00mL。
标准溶液滴定,消耗标准溶液20.00mL。
已知: 可与NO生成粉红色的FeSO4·NO。
可与NO生成粉红色的FeSO4·NO。
①锥形瓶中加入浓硫酸的作用是_______ 。
②判断滴定达到终点的现象是_______ 。
③亚硝酰硫酸中硝酸的含量为_______ 。

回答下列问题:
(1)装置A中盛装Na2SO3固体的仪器名称是

(2)装置C中浓HNO3与SO2在浓H2SO4作用下反应制得NOSO4H。
①装置C中温度过高产率降低的原因是
②开始通SO2时,反应缓慢,待生成少量NOSO4H后,温度变化不大,但反应速率明显加快,其原因是
(3)测定亚硝酰硫酸产品中杂质硝酸的含量。
称取1.400g产品放入250mL锥形瓶中,加80mL浓硫酸,用

 标准溶液滴定,消耗标准溶液20.00mL。
标准溶液滴定,消耗标准溶液20.00mL。已知:
 可与NO生成粉红色的FeSO4·NO。
可与NO生成粉红色的FeSO4·NO。①锥形瓶中加入浓硫酸的作用是
②判断滴定达到终点的现象是
③亚硝酰硫酸中硝酸的含量为
您最近一年使用:0次
2021-05-28更新
|
624次组卷
|
3卷引用:山东省潍坊市2021届高三三模化学试题



