1 . 下列实验设计及现象、结论合理的是
| 选项 | 实验目的 | 实验设计及现象 | 结论 |
| A | 探究 是否具有还原性 是否具有还原性 | 向一定浓度的 溶液中滴加少量酸性高锰酸钾溶液,高锰酸钾溶液紫红色褪去 溶液中滴加少量酸性高锰酸钾溶液,高锰酸钾溶液紫红色褪去 |  具有还原性 具有还原性 |
| B | 检验 气体中是否混有 气体中是否混有 | 将气体依次通过饱和 溶液和澄清石灰水,澄清石灰水变浑浊 溶液和澄清石灰水,澄清石灰水变浑浊 |  气体中混有 气体中混有 |
| C | 在 与 与 的混合液中再加入 的混合液中再加入 固体 固体 | 溶液颜色变浅 | 增大生成物浓度,平衡逆向移动 |
| D | 探究不同催化剂的催化效率 | 两支试管中分别盛相同温度、相同浓度、相同体积的 溶液,分别滴加相同浓度、相同体积的 溶液,分别滴加相同浓度、相同体积的 溶液与 溶液与 溶液,滴加 溶液,滴加 溶液得试管中产生气体更快 溶液得试管中产生气体更快 |  对 对 分解的催化效率更高 分解的催化效率更高 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2 . 下列实验操作不能达到相应实验目的的是
| 选项 | 实验目的 | 实验操作 |
| A | 比较水与乙醇中羟基氢的活泼性 | 分别将少量钠投入到乙醇和水中,观察现象 |
| B | 检验淀粉的水解反应是否进行完全 | 向水解液中加入碘水,观察溶液是否变蓝 |
| C | 检验淀粉水解是否产生葡萄糖 | 将淀粉和稀硫酸混合加热段时间后,再加入新制的 悬浊液,加热 悬浊液,加热 |
| D | 验证催化剂对化学反应速率的影响 | 在两支试管中各加入5mL 12%  溶液,将其中一支中加入 溶液,将其中一支中加入 ,观察并比较实验现象 ,观察并比较实验现象 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
3 . 下列实验过程能达到目的,且现象和结论正确的是
| 选项 | 实验目的 | 实验过程 | 现象和结论 |
| A | 比较AgCl和AgI的 大小 大小 | 向2mL0.1mol/L 溶液中滴2滴0.1mol/LNaCl溶液,产生白色沉淀后再滴加2滴0.1mol/LKI溶液 溶液中滴2滴0.1mol/LNaCl溶液,产生白色沉淀后再滴加2滴0.1mol/LKI溶液 | 又生成黄色沉淀,说明 |
| B | 探究不同催化剂对反应速率的影响 | 在两支大小相同的试管中均加2mL5% 溶液,分别滴入2滴1mol/L 溶液,分别滴入2滴1mol/L 溶液和1mol/L 溶液和1mol/L 溶液 溶液 | 加 溶液的试管产生气泡速率更快,说明 溶液的试管产生气泡速率更快,说明 的催化效果强于 的催化效果强于 |
| C | 比较HCN、 的 的 大小 大小 | 用pH计分别测定浓度均为0.1mol/L的NaCN和 的pH 的pH |  的pH更大,所以 的pH更大,所以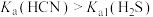 |
| D | 探究可逆反应的热效应 | 已知 溶液中存在下列平衡: 溶液中存在下列平衡: (蓝) (蓝)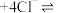 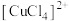 (黄) (黄)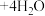 ,取一定浓度的 ,取一定浓度的 溶液,升高温度 溶液,升高温度 | 溶液由蓝色变为黄色,说明该反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-06-22更新
|
258次组卷
|
2卷引用:四川省德阳市第五中学2022-2023学年高二下学期6月月考化学试题
名校
解题方法
4 . 生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关四环素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN-氧化的反应)
相关资料
①氰化物主要以CN-和[Fe(CN)6]3-两种形式存在
②Cu2+可作为双氧水氧化法破氰处理过程中的催化剂,Cu2+在偏碱性条件下对双氧水分解影响较弱,可以忽略不计。
③[Fe(CN)6]3-较CN-难被双氧水氧化,且pH值越大,越稳定,越难被氧化。
实验过程
(1)请完成以下实验设计表(表中不要留空格)
实验测得含氰废水中的总氰浓度(以CN-表示)随时间变化关系如图所示。
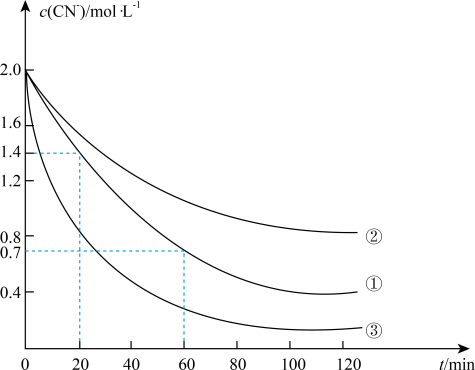
(2)实验①中20~60min时间段反应速率:υ(CN-)=___ mol•L-1•min-1。
(3)实验①和实验②结果表明,含氰废水的初始pH增大,破氰反应速率减小,其原因可能是__ (填一点即可),在偏碱性条件下,含氰废水中的CN-最终被双氧水氧化为HCO3-,同时放出NH3,试写出该反应的离子方程式___ 。
(4)该兴趣小组同学要探究Cu2+是否对双氧水氧化法破氰反应起催化作用,请你帮助他设计实验并验证上述结论,完成表2中内容。(已知:废水中的CN-浓度可用离子色谱仪测定)___
相关资料
①氰化物主要以CN-和[Fe(CN)6]3-两种形式存在
②Cu2+可作为双氧水氧化法破氰处理过程中的催化剂,Cu2+在偏碱性条件下对双氧水分解影响较弱,可以忽略不计。
③[Fe(CN)6]3-较CN-难被双氧水氧化,且pH值越大,越稳定,越难被氧化。
实验过程
(1)请完成以下实验设计表(表中不要留空格)
| 实验 序号 | 实验目的 | 初始pH | 废水样品体积/mL | CuSO4溶液的体积/mL | 双氧水溶液的体积/mL | 蒸馏水的体积/mL |
| 1 | 为以下实验操作参考 | 7 | 60 | 10 | 10 | 20 |
| 2 | 废水的初始pH对破氰反应速率的影响 | 12 | 60 | 10 | 10 | 20 |
| 3 | 7 | 60 | 10 |

(2)实验①中20~60min时间段反应速率:υ(CN-)=
(3)实验①和实验②结果表明,含氰废水的初始pH增大,破氰反应速率减小,其原因可能是
(4)该兴趣小组同学要探究Cu2+是否对双氧水氧化法破氰反应起催化作用,请你帮助他设计实验并验证上述结论,完成表2中内容。(已知:废水中的CN-浓度可用离子色谱仪测定)
| 实验步骤(不要写出具体操作过程) | 预期实验现象和结论 |
您最近一年使用:0次
解题方法
5 . 下列实验过程可以达到实验目的的是( )
| 选项 | 实验目的 | 实验过程 |
| A | 配制Fe(NO3)2溶液 | 将Fe(NO3)2·9H2O溶于较浓硝酸,然后加水稀释 |
| B | 探究SO2的漂白性 | 向盛有2mL黄色氯化铁溶液的试管中通入SO2,观察颜色变化 |
| C | 探究AgBr、AgI的溶度积大小 | 向2支盛有2mL不同浓度NaBr、NaI溶液的试管中分别滴入2滴相同浓度的AgNO3稀溶液,观察实验现象 |
| D | 探究催化剂对化学反应速率的影响 | 向2支试管中分别加入2mL0.01mol· L-1 KMnO4溶液,一支中加小粒MnSO4固体,然后2支试管中同时加入2mL0.1mol·L-1H2C2O4溶液,比较褪色时间快慢 |
A.A  | B.B  | C.C  | D.D |
您最近一年使用:0次
2020-01-21更新
|
560次组卷
|
3卷引用:黑龙江省齐齐哈尔市拜泉四中2019-2020学年高三上学期第四次月考化学试题
名校
解题方法
6 . 近年来,研究人员提出用I—作为水溶液中SO2歧化反应的催化剂,实现含SO2工业污水的处理,其催化过程分两步完成:
i.SO2+4I—+4H+= S↓+2I2+2H2O
ii. I2+ 2H2O+SO2 = + 4H++ 2I—
+ 4H++ 2I—
为探究i、ii反应速率与 SO2歧化反应速率的关系,实验如下:分别将18mLSO2饱和溶液加入2mL下列试剂中,密闭放置,观察现象(已知:I2易溶解在KI溶液中)
(1)KI的电子式为________ , 用KI固体配制50ml 0.4mol·L-1KI溶液,下图中的仪器需要使用到的有________ (填写名称)。
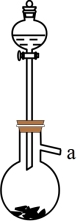
(2)实验室利用下图制备SO2气体的化学方程式为_______ 。
(3)水溶液中SO2歧化反应的离子方程式为________ 。
(4)实验①和②是对照实验,则a=_______ ,比较实验①和②可得出结论_______ 。
(5)实验③试剂X为________ 。比较实验②和③可知H+单独存在时不能催化SO2的歧化反应。
(6)实验表明,SO2歧化反应速率④>①,结合i和ii的反应速率,解释反应速率④>①的原因__________ 。
i.SO2+4I—+4H+= S↓+2I2+2H2O
ii. I2+ 2H2O+SO2 =
 + 4H++ 2I—
+ 4H++ 2I—为探究i、ii反应速率与 SO2歧化反应速率的关系,实验如下:分别将18mLSO2饱和溶液加入2mL下列试剂中,密闭放置,观察现象(已知:I2易溶解在KI溶液中)
| 序号 | ① | ② | ③ | ④ |
| 试剂组成 | 0.4 mol·L-1 KI | a mol·L-1KI 0.2 mol·L-1 H2SO4 | x | 0.2 mol·L-1KI 0.002 mol·L-1 I2 |
| 实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊比①快 | 无明显现象 | 棕褐色溶液迅速褪色,变成黄色,出现浑浊比①快 |

(2)实验室利用下图制备SO2气体的化学方程式为

(3)水溶液中SO2歧化反应的离子方程式为
(4)实验①和②是对照实验,则a=
(5)实验③试剂X为
(6)实验表明,SO2歧化反应速率④>①,结合i和ii的反应速率,解释反应速率④>①的原因
您最近一年使用:0次
7 . 我国对世界郑重承诺:2030年前实现碳达峰,2060年前实现碳中和,而研发CO2的碳捕捉和碳利用技术则是关键。
(1)大气中的CO2主要来自于煤、石油及其他含碳化合物的燃烧,CH4与CO2重整是CO2利用的研究热点之一。该重整反应体系主要涉及以下反应:
①CH4(g) C(s)+2H2(g) ΔH1=akJ•mol-1
C(s)+2H2(g) ΔH1=akJ•mol-1
②CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=bkJ•mol-1
CO(g)+H2O(g) ΔH2=bkJ•mol-1
③2CO(g) CO2(g)+C(s) ΔH3=ckJ•mol-1
CO2(g)+C(s) ΔH3=ckJ•mol-1
反应CH4(g)+CO2(g) 2CO(g)+2H2(g)的ΔH=
2CO(g)+2H2(g)的ΔH=_____ kJ•mol-1。
(2)多晶Cu是目前唯一被实验证实能高效催化CO2还原为烃类(如C2H4)的金属。如图所示,电解装置中分别以多晶Cu和Pt为电极材料,用阴离子交换膜分隔开阴、阳极室,反应前后KHCO3浓度基本保持不变,温度控制在10℃左右。生成C2H4的电极反应式为_____ 。

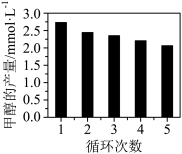
(3)CO2与H2反应如果用Co/C作为催化剂,可以得到含有少量甲酸的甲醇。为了研究催化剂的催化效率,将Co/C催化剂循环使用,相同条件下,随着循环使用次数的增加,甲醇的产量如图所示,试推测甲醇产量变化的可能原因_____ 。
(4)常温下,以NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。用1LNa2CO3溶液将2.33gBaSO4固体全都转化为BaCO3,再过滤,所用的Na2CO3溶液的物质的量浓度至少为_____ mol•L-1。[已知:常温下Ksp(BaSO4)=1×10-11,Ksp(BaCO3)=1×10-10;忽略溶液体积变化]
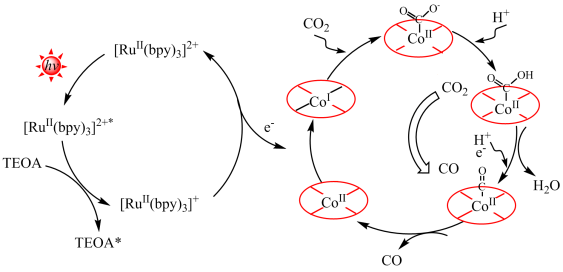
(5)某课题组通过温和的自光刻技术制备出富含氧空位的Co(CO3)0.5(OH)•0.11H2O纳米线(用CoII表示),测试结果表明,该CoII在可见光下具有优异的光催化CO2还原活性。分析表明,该CO2还原催化机理为典型的CoII/CoI反应路径(如图)。首先,光敏剂([Ru(bpy)3]2+)通过可见光照射被激发到激发态([Ru(bpy)3]2+*),随后([Ru(bpy)3]2+*)被TEOA淬灭得到([Ru(bpy)3]+)还原物种,该还原物种将向CoII供激发电子将CoII还原为CoI,_____ 。(结合图示,描述CO2还原为CO的过程)
(1)大气中的CO2主要来自于煤、石油及其他含碳化合物的燃烧,CH4与CO2重整是CO2利用的研究热点之一。该重整反应体系主要涉及以下反应:
①CH4(g)
 C(s)+2H2(g) ΔH1=akJ•mol-1
C(s)+2H2(g) ΔH1=akJ•mol-1②CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2=bkJ•mol-1
CO(g)+H2O(g) ΔH2=bkJ•mol-1③2CO(g)
 CO2(g)+C(s) ΔH3=ckJ•mol-1
CO2(g)+C(s) ΔH3=ckJ•mol-1反应CH4(g)+CO2(g)
 2CO(g)+2H2(g)的ΔH=
2CO(g)+2H2(g)的ΔH=(2)多晶Cu是目前唯一被实验证实能高效催化CO2还原为烃类(如C2H4)的金属。如图所示,电解装置中分别以多晶Cu和Pt为电极材料,用阴离子交换膜分隔开阴、阳极室,反应前后KHCO3浓度基本保持不变,温度控制在10℃左右。生成C2H4的电极反应式为

(3)CO2与H2反应如果用Co/C作为催化剂,可以得到含有少量甲酸的甲醇。为了研究催化剂的催化效率,将Co/C催化剂循环使用,相同条件下,随着循环使用次数的增加,甲醇的产量如图所示,试推测甲醇产量变化的可能原因

(4)常温下,以NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。用1LNa2CO3溶液将2.33gBaSO4固体全都转化为BaCO3,再过滤,所用的Na2CO3溶液的物质的量浓度至少为
(5)某课题组通过温和的自光刻技术制备出富含氧空位的Co(CO3)0.5(OH)•0.11H2O纳米线(用CoII表示),测试结果表明,该CoII在可见光下具有优异的光催化CO2还原活性。分析表明,该CO2还原催化机理为典型的CoII/CoI反应路径(如图)。首先,光敏剂([Ru(bpy)3]2+)通过可见光照射被激发到激发态([Ru(bpy)3]2+*),随后([Ru(bpy)3]2+*)被TEOA淬灭得到([Ru(bpy)3]+)还原物种,该还原物种将向CoII供激发电子将CoII还原为CoI,

您最近一年使用:0次
8 . 我国对世界郑重承诺:2030年前实现碳达峰,2060年前实现碳中和,而研发CO2的碳捕捉和碳利用技术则是关键。
(1)大气中的CO2主要来自于煤、石油及其他含碳化合物的燃烧,CH4与CO2重整是CO2利用的研究热点之一。该重整反应体系主要涉及以下反应:
①CH4(g) C(s)+2H2(g) ΔH1=akJ•mol-1
C(s)+2H2(g) ΔH1=akJ•mol-1
②CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=bkJ•mol-1
CO(g)+H2O(g) ΔH2=bkJ•mol-1
③2CO(g) CO2(g)+C(s) ΔH3=ckJ•mol-1
CO2(g)+C(s) ΔH3=ckJ•mol-1
反应CH4(g)+CO2(g) 2CO(g)+2H2(g)的ΔH=
2CO(g)+2H2(g)的ΔH=____ kJ•mol-1。
(2)多晶Cu是目前唯一被实验证实能高效催化CO2还原为烃类(如C2H4)的金属。如图1所示,电解装置中分别以多晶Cu和Pt为电极材料,用阴离子交换膜分隔开阴、阳极室,反应前后KHCO3浓度基本保持不变,温度控制在10℃左右。生成C2H4的电极反应式为_____ 。

(3)CO2的电化学催化还原具有条件温和、对环境友好的优点。Cu对CO2的电还原有一定的催化作用。在0.1mol•L-1CuSO4/H2SO4溶液中,改变沉积时间,进行恒电位沉积制备纳米Cu电极。图2是根据不同沉积时间制备的纳米Cu电极的循环伏安曲线作出的CO2的还原峰电流(峰电流越大,表明纳米Cu电极催化效果越好)与沉积时间的关系图,沉积时间超过50s,进一步延长沉积时间,纳米Cu电极催化效果减弱的原因是____ 。

(4)常温下,以NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。用1LNa2CO3溶液将2.33gBaSO4固体全都转化为BaCO3,再过滤,所用的Na2CO3溶液的物质的量浓度至少为____ mol•L-1。
[已知:常温下Ksp(BaSO4)=1×10-11,Ksp(BaCO3)=1×10-10;忽略溶液体积变化]
(5)章根强课题组通过温和的自光刻技术制备出富含氧空位的Co(CO3)0.5(OH)•0.11H2O纳米线(用CoⅡ表示),测试结果表明,该CoⅡ在可见光下具有优异的光催化CO2还原活性。分析表明,该CO2还原催化机理为典型的CoⅡ/CoI反应路径(如图3)。首先,光敏剂([Ru(bpy)3]2+)通过可见光照射被激发到激发态([Ru(bpy)3]2+*),随后([Ru(bpy)3]2+*)被TEOA淬灭得到([Ru(bpy)3]+)还原物种,该还原物种将向CoⅡ供激发电子将CoⅡ还原为CoI,_____ 。(结合图示,描述CO2还原为CO的过程)

(1)大气中的CO2主要来自于煤、石油及其他含碳化合物的燃烧,CH4与CO2重整是CO2利用的研究热点之一。该重整反应体系主要涉及以下反应:
①CH4(g)
 C(s)+2H2(g) ΔH1=akJ•mol-1
C(s)+2H2(g) ΔH1=akJ•mol-1②CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2=bkJ•mol-1
CO(g)+H2O(g) ΔH2=bkJ•mol-1③2CO(g)
 CO2(g)+C(s) ΔH3=ckJ•mol-1
CO2(g)+C(s) ΔH3=ckJ•mol-1反应CH4(g)+CO2(g)
 2CO(g)+2H2(g)的ΔH=
2CO(g)+2H2(g)的ΔH=(2)多晶Cu是目前唯一被实验证实能高效催化CO2还原为烃类(如C2H4)的金属。如图1所示,电解装置中分别以多晶Cu和Pt为电极材料,用阴离子交换膜分隔开阴、阳极室,反应前后KHCO3浓度基本保持不变,温度控制在10℃左右。生成C2H4的电极反应式为

(3)CO2的电化学催化还原具有条件温和、对环境友好的优点。Cu对CO2的电还原有一定的催化作用。在0.1mol•L-1CuSO4/H2SO4溶液中,改变沉积时间,进行恒电位沉积制备纳米Cu电极。图2是根据不同沉积时间制备的纳米Cu电极的循环伏安曲线作出的CO2的还原峰电流(峰电流越大,表明纳米Cu电极催化效果越好)与沉积时间的关系图,沉积时间超过50s,进一步延长沉积时间,纳米Cu电极催化效果减弱的原因是

(4)常温下,以NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。用1LNa2CO3溶液将2.33gBaSO4固体全都转化为BaCO3,再过滤,所用的Na2CO3溶液的物质的量浓度至少为
[已知:常温下Ksp(BaSO4)=1×10-11,Ksp(BaCO3)=1×10-10;忽略溶液体积变化]
(5)章根强课题组通过温和的自光刻技术制备出富含氧空位的Co(CO3)0.5(OH)•0.11H2O纳米线(用CoⅡ表示),测试结果表明,该CoⅡ在可见光下具有优异的光催化CO2还原活性。分析表明,该CO2还原催化机理为典型的CoⅡ/CoI反应路径(如图3)。首先,光敏剂([Ru(bpy)3]2+)通过可见光照射被激发到激发态([Ru(bpy)3]2+*),随后([Ru(bpy)3]2+*)被TEOA淬灭得到([Ru(bpy)3]+)还原物种,该还原物种将向CoⅡ供激发电子将CoⅡ还原为CoI,

您最近一年使用:0次
2022-12-08更新
|
457次组卷
|
2卷引用:江苏省扬州中学2023-2024学年高三上学期10月月考化学试题
9 . 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:
(1)已知:①2Cu(s)+1/2O2(g)=Cu2O(s);△H = -169kJ·mol-1
②C(s)+1/2O2(g)=CO(g);△H = -110.5kJ·mol-1
③ Cu(s)+1/2O2(g)=CuO(s);△H = -157kJ·mol-1
则方法a发生的热化学方程式是:_________________
(2)方法c采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示:该电池的阳极反应式为___________ 钛极附近的pH值______ (增大、减小、不变)。

(3)方法d为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为______________ 。
(4)在相同的密闭容器中,用以上方法制得的三种Cu2O分别进行催化分解水的实验: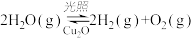 △H>0。水蒸气的浓度随时间t变化如下表所示。
△H>0。水蒸气的浓度随时间t变化如下表所示。
下列叙述正确的是_______ (填字母)。
A.实验的温度:T2<T1
B.实验②比实验①所用的催化剂催化效率高
C.实验①前20 min的平均反应速率 v(H2)=7×10-5 mol·L-1 min-1
| 方法a | 用炭粉在高温条件下还原CuO |
| 方法b | 用葡萄糖还原新制的Cu(OH)2制备Cu2O; |
| 方法c | 电解法,反应为2Cu + H2O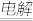 Cu2O + H2↑。 Cu2O + H2↑。 |
| 方法d | 用肼(N2H4)还原新制的Cu(OH)2 |
②C(s)+1/2O2(g)=CO(g);△H = -110.5kJ·mol-1
③ Cu(s)+1/2O2(g)=CuO(s);△H = -157kJ·mol-1
则方法a发生的热化学方程式是:
(2)方法c采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示:该电池的阳极反应式为

(3)方法d为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为
(4)在相同的密闭容器中,用以上方法制得的三种Cu2O分别进行催化分解水的实验:
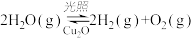 △H>0。水蒸气的浓度随时间t变化如下表所示。
△H>0。水蒸气的浓度随时间t变化如下表所示。| 序号 | 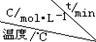 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
A.实验的温度:T2<T1
B.实验②比实验①所用的催化剂催化效率高
C.实验①前20 min的平均反应速率 v(H2)=7×10-5 mol·L-1 min-1
您最近一年使用:0次
10 . 3-丁酮酸乙酯在有机合成中用途极广,广泛用于药物合成,还用作食品的着香剂。其相对分子质量为130,常温下为无色液体,沸点 181℃,受热温度超过95℃摄氏度时就会分解;易溶于水,与乙醇、乙酸乙酯等有机试剂以任意比混溶;实验室可用以乙酸乙酯和金属钠为原料制备。乙酸乙酯 相对分子质量为88,常温下为无色易挥发液体,微溶于水,沸点77℃。
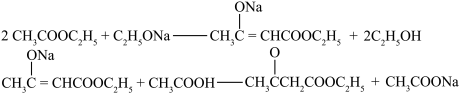
【反应原理】
【实验装置】
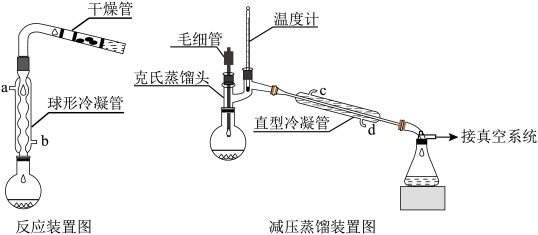
【实验步骤】
1.加热反应:向反应装置中加入32 mL(28.5g,0.32mol)乙酸乙酯、少量无水乙醇、1.6 g(0.07mol)切细的金属钠,微热回流1.5~3小时,直至金属钠消失。
2.产物后处理:冷却至室温,卸下冷凝管,将烧瓶浸在冷水浴中,在摇动下缓慢的加入32 mL 30%醋酸水溶液,使反应液分层。用分液漏斗分离出酯层。酯层用5%碳酸钠溶液洗涤,有机层放入干燥的锥形瓶中,加入无水碳酸钾至液体澄清。
3.蒸出未反应的乙酸乙酯:将反应液在常压下蒸馏至100℃。然后改用减压蒸馏,得到产品2.0g。
回答下列问题:
(1)从反应原理看,无水乙醇的作用是_____________ 。
(2)反应装置中加干燥管是为了__________ 。两个装置中冷凝管的作用__________ (填“相同”或“不相同”),冷却水进水口分别为__________ 和_____________ (填图中的字母)。
(3)产物后处理中,滴加稀醋酸的目的是__________ ,稀醋酸不能加多了,原因是___________ 。用分液漏斗分离出酯层的操作叫____________ 。碳酸钠溶液洗涤的目的是_________________ 。加碳酸钾的目的是______________ 。
(4)采用减压蒸馏的原因是_______________ 。
(5)本实验所得到的3-丁酮酸乙酯产率是_____________ (填正确答案标号)。
【反应原理】

【实验装置】

【实验步骤】
1.加热反应:向反应装置中加入32 mL(28.5g,0.32mol)乙酸乙酯、少量无水乙醇、1.6 g(0.07mol)切细的金属钠,微热回流1.5~3小时,直至金属钠消失。
2.产物后处理:冷却至室温,卸下冷凝管,将烧瓶浸在冷水浴中,在摇动下缓慢的加入32 mL 30%醋酸水溶液,使反应液分层。用分液漏斗分离出酯层。酯层用5%碳酸钠溶液洗涤,有机层放入干燥的锥形瓶中,加入无水碳酸钾至液体澄清。
3.蒸出未反应的乙酸乙酯:将反应液在常压下蒸馏至100℃。然后改用减压蒸馏,得到产品2.0g。
回答下列问题:
(1)从反应原理看,无水乙醇的作用是
(2)反应装置中加干燥管是为了
(3)产物后处理中,滴加稀醋酸的目的是
(4)采用减压蒸馏的原因是
(5)本实验所得到的3-丁酮酸乙酯产率是
| A.10% | B.22% | C.19% | D.40% |
您最近一年使用:0次
2016-12-09更新
|
524次组卷
|
2卷引用:2015届湖北省襄阳市普通高中高三1月调研理综化学试卷



