名校
解题方法
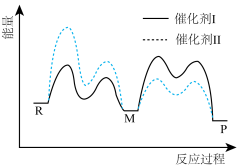
1 . 催化剂Ⅰ和Ⅱ均能催化反应 ,反应历程如图所示,M为中间产物。其他条件相同时,下列说法不正确的是
,反应历程如图所示,M为中间产物。其他条件相同时,下列说法不正确的是
 ,反应历程如图所示,M为中间产物。其他条件相同时,下列说法不正确的是
,反应历程如图所示,M为中间产物。其他条件相同时,下列说法不正确的是
| A.使用Ⅰ和Ⅱ,不影响P的平衡体积百分含量 |
| B.反应达平衡时,升高温度,R的浓度增大 |
| C.使用Ⅰ时,反应体系更快达到平衡 |
| D.使用Ⅱ时,反应过程中M所能达到的最高浓度更大 |
您最近一年使用:0次
2023-11-29更新
|
150次组卷
|
5卷引用:四川省广安市华蓥中学2023-2024学年高二上学期12月月考化学试题
四川省广安市华蓥中学2023-2024学年高二上学期12月月考化学试题北京师范大学附属实验中学2023-2024学年高二上学期期中考试化学试题 北京师范大学附属实验中学2023-2024学年高二上学期期中考试化学试题北京师范大学附属实验中学2023-2024学年高二上学期期中考试化学试题(已下线)寒假作业02 化学反应速率-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)
名校
2 . 2022年3月4日,中国科学院大连化学物理研究所开发的全球首套1000吨/年二氧化碳加氢制汽油中试装置,在山东邹城工业园区开车成功,生产出符合国VI标准的清洁汽油,这有助于我国在2030年前实现碳达峰。回答下列问题:
(1)CO2催化加氢制取汽油时,CO2的转化过程如图1:
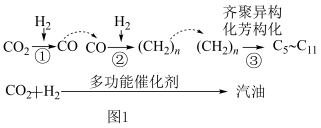
下列对该反应过程的说法正确的是________ (填标号)。
(2)写出反应①的化学方程式_______ 。
(3)如将CO2与H2以1:3的体积比混合。
①适当条件下合成某烃和水,该烃可能是______ (填序号)。
A.烷烃 B.烯烃 C.炔烃 D.苯的同系物
②适当条件下合成燃料甲醇和水。在恒温恒容的密闭容器中,充入2molCO2和6molH2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),下列能说明反应达到平衡状态的是
CH3OH(g)+H2O(g),下列能说明反应达到平衡状态的是______ (填字母)
A.混合气体密度保持不变
B.混合气体的平均相对分子质量不变
C.CO2和H2的体积比保持不变
D.断裂2mol碳氧双键的同时生成3molH-H键
(4)催化剂通过参与反应,改变反应的途径,降低反应活化能,加快化学反应速率,反应的热效应△H______ (填“减小”、“增大”或“不变”)。
(5)已知CO2甲烷化技术的反应原理为CO2(g)+4H2(g) CH4(g)+2H2O(g) △H<0,该技术的核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得CO2转化率和CH4选择性(选择性是指产生这个物质所消耗的反应物的量占总的反应物的量的比例大小)随温度变化的曲线如图2所示。
CH4(g)+2H2O(g) △H<0,该技术的核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得CO2转化率和CH4选择性(选择性是指产生这个物质所消耗的反应物的量占总的反应物的量的比例大小)随温度变化的曲线如图2所示。
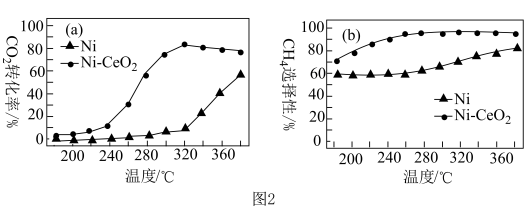
以Ni为催化剂,高于320℃后,单位时间内CO2转化率上升的原因是______ ,工业上应选择的催化剂是______ 。
(1)CO2催化加氢制取汽油时,CO2的转化过程如图1:

下列对该反应过程的说法正确的是
| A.整个反应过程中,有非极性键和极性键的断裂和形成 |
B.CO2的电子式为 ,为非极性分子 ,为非极性分子 |
| C.汽油为纯净物 |
| D.①②反应一定有水生成 |
(2)写出反应①的化学方程式
(3)如将CO2与H2以1:3的体积比混合。
①适当条件下合成某烃和水,该烃可能是
A.烷烃 B.烯烃 C.炔烃 D.苯的同系物
②适当条件下合成燃料甲醇和水。在恒温恒容的密闭容器中,充入2molCO2和6molH2,一定条件下发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),下列能说明反应达到平衡状态的是
CH3OH(g)+H2O(g),下列能说明反应达到平衡状态的是A.混合气体密度保持不变
B.混合气体的平均相对分子质量不变
C.CO2和H2的体积比保持不变
D.断裂2mol碳氧双键的同时生成3molH-H键
(4)催化剂通过参与反应,改变反应的途径,降低反应活化能,加快化学反应速率,反应的热效应△H
(5)已知CO2甲烷化技术的反应原理为CO2(g)+4H2(g)
 CH4(g)+2H2O(g) △H<0,该技术的核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得CO2转化率和CH4选择性(选择性是指产生这个物质所消耗的反应物的量占总的反应物的量的比例大小)随温度变化的曲线如图2所示。
CH4(g)+2H2O(g) △H<0,该技术的核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得CO2转化率和CH4选择性(选择性是指产生这个物质所消耗的反应物的量占总的反应物的量的比例大小)随温度变化的曲线如图2所示。
以Ni为催化剂,高于320℃后,单位时间内CO2转化率上升的原因是
您最近一年使用:0次
名校
解题方法
3 . 下列实验操作、现象和结论均正确的是
| 选项 | 操作 | 现象 | 结论 |
| A | 两支试管均盛有4mL浓度分别为0.1mol·L-1和0.2mol·L-1的酸性KMnO4溶液中,同时各加入2mL0.1 mol·L-1H2C2O4溶液 | 0.2mol·L-1的酸性KMnO4溶液先褪色 | 其他条件相同时,反应物浓度越大,反应速率越快 |
| B | 在盛有2mL0.05mol/LFeCl3溶液的试管中加入2mL0.15mol/LKSCN溶液,溶液呈红色。再加入少量KCl晶体 | 溶液红色变浅 | 其他条件不变,增大生成物浓度,平衡向逆反应方向移动 |
| C | 往烧杯中加入约20g研细的Ba(OH)2·8H2O晶体和10gNH4Cl晶体,并将烧杯放在滴有水的玻璃片上,用玻璃棒迅速搅拌 | 有刺激性气味气体生成,烧杯底部与玻璃片粘在一起 | 吸热反应不一定需要加热才能进行 |
| D | 在盛有2mL5%的过氧化氢溶液的两支试管中分别加入5滴1mol/L的三氯化铁溶液和硫酸铜溶液 | 加入三氯化铁溶液的产生气泡速率更快 | 其他条件相同时,对H2O2分解的Fe3+催化作用强于Cu2+ |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-10-26更新
|
258次组卷
|
3卷引用:四川省广安市华蓥中学2023-2024学年高二上学期11月期中化学试题
名校
4 . 一定条件下,可逆反应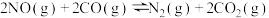
 达到平衡,当单独改变下述条件后,有关叙述错误的是
达到平衡,当单独改变下述条件后,有关叙述错误的是
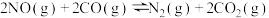
 达到平衡,当单独改变下述条件后,有关叙述错误的是
达到平衡,当单独改变下述条件后,有关叙述错误的是A.降温,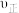 、 、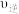 都减小,且 都减小,且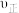 减小的程度小于 减小的程度小于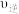 减小的程度 减小的程度 |
B.加压,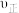 、 、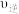 都增大,且 都增大,且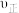 增大的程度大于 增大的程度大于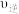 增大的程度 增大的程度 |
C.注入氮气的时刻,压强增大,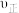 、 、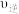 都增大,且 都增大,且 增大程度大于 增大程度大于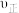 增大程度 增大程度 |
D.加催化剂, 、 、 都发生变化,且变化的程度相等 都发生变化,且变化的程度相等 |
您最近一年使用:0次
2023-08-17更新
|
428次组卷
|
4卷引用:四川省华蓥中学2023-2024学年高二上学期9月月考化学试题
名校
解题方法
5 . Fe氧簇MOF催化 与
与 反应的机理如图所示。下列说法错误的是
反应的机理如图所示。下列说法错误的是
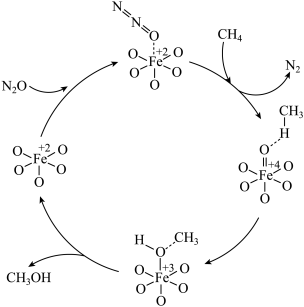
 与
与 反应的机理如图所示。下列说法错误的是
反应的机理如图所示。下列说法错误的是
A.根据 分子的结构推测其电子式为 分子的结构推测其电子式为 |
| B.该反应中存在极性键的断裂和非极性键的形成 |
C. 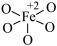 为该反应的催化剂 为该反应的催化剂 |
D.总反应方程式为 |
您最近一年使用:0次
2023-04-10更新
|
898次组卷
|
6卷引用:四川省广安市岳池县第一中学2023-2024学年高二上学期第一次月考化学试题
四川省广安市岳池县第一中学2023-2024学年高二上学期第一次月考化学试题河北省石家庄市部分学校2023届高中毕业年级教学质量检测(二)(一模)化学试题(已下线)专题07 化学反应中的能量变化(已下线)T12-物质的反应和转化四川省成都市石室中学2023届高三下学期高考适应性考试(二)理科综合化学试题(已下线)2023年湖南卷高考真题变式题(选择题11-14)
6 . 氮及其化合物的转化过程如图1所示,其中图2为反应①过程中能量变化的曲线图。
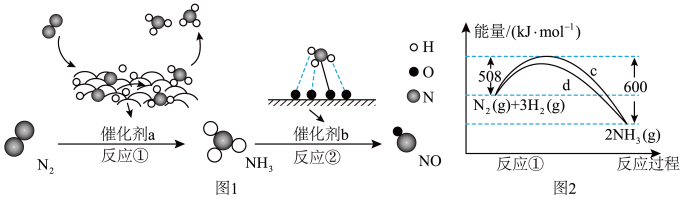
下列分析合理的是

下列分析合理的是
| A.图2中c曲线是加入催化剂a时的能量变化曲线 |
| B.催化剂a、b能提高反应①、②的化学反应速率和平衡转化率 |
| C.在反应②中,若有1.25mol电子发生转移,则参加反应的NH3的体积为5.6L |
D.反应①的热化学方程式为N2(g)+3H2(g) 2NH3(g) △H=-92kJ·mol-1 2NH3(g) △H=-92kJ·mol-1 |
您最近一年使用:0次
2021-10-09更新
|
135次组卷
|
3卷引用:四川省广安市岳池县第一中学2023-2024学年高二上学期第一次月考化学试题
名校
解题方法
7 . 对于反应2NO(g)+2H2(g)→N2(g)+2H2O(g),科学家根据光谱学研究提出如下反应历程:
第一步:2NO⇌N2O2快速平衡
第二步:N2O2+H2→N2O+H2O慢反应
第三步:N2O+H2→N2+H2O快反应
其中可近似认为第二步反应不影响第一步的平衡。下列叙述正确的是
第一步:2NO⇌N2O2快速平衡
第二步:N2O2+H2→N2O+H2O慢反应
第三步:N2O+H2→N2+H2O快反应
其中可近似认为第二步反应不影响第一步的平衡。下列叙述正确的是
| A.若第一步反应△H<0,则升高温度,v正减小,v逆增大 |
| B.第二步反应的活化能大于第三步的活化能 |
| C.第三步反应中N2O与H2的每一次碰撞都是有效碰撞 |
| D.反应的中间产物只有N2O2 |
您最近一年使用:0次
2020-04-21更新
|
885次组卷
|
10卷引用:四川省广安市岳池县第一中学2023-2024学年高二上学期第一次月考化学试题
四川省广安市岳池县第一中学2023-2024学年高二上学期第一次月考化学试题上海市闵行中学2022-2023学年高二下学期期末(等级)考试化学试题第二章 化学反应速率与化学平衡 第一节 化学反应速率 第2课时 影响化学反应速率的因素 活化能重庆市松树桥中学校2023-2024学年高二上学期半期考试(期中)化学试题百校联盟2020届高三4月教育教学质量监测考试(全国Ⅰ卷)理综化学试题江西省新余市第四中学2020-2021学年高二上学期第一次段考化学试题天津市静海区第一中学2021届高三上学期期末考试化学试题第一节 化学反应速率 第2课时 影响化学反应速率的因素 活化能(已下线)第07讲 活化能(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)(已下线)2.3.2 影响化学反应速率因素的微观分析-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修1)



