名校
解题方法
1 . CO2资源化利用对缓解碳减排压力具有重要意义,使用镍氢催化剂可使CO2转化为CH4。反应体系中主要反应的热化学方程式为:
反应Ⅰ:

反应Ⅱ:

(1)将反应后气体通入___________ (填试剂),可证明反应Ⅱ发生。
(2)计算

___________ (用 和
和 表示)。
表示)。
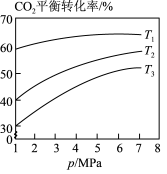
(3)相同投料比时,体系内 的平衡转化率与温度T和压强p的关系如图,温度从高到低的顺序为
的平衡转化率与温度T和压强p的关系如图,温度从高到低的顺序为___________ 。
(4)镍氢催化剂活性会因为甲烷分解产生积碳而降低,同时二氧化碳可与碳发生消碳反应:
积碳反应:
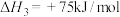
消碳反应:
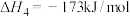
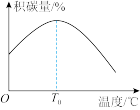
其他条件相同时,催化剂表面积碳量与温度的关系如图所示, ℃之后,温度升高积碳量减小的主要原因是
℃之后,温度升高积碳量减小的主要原因是___________ 。
(5)向 恒容、密闭容器中通入
恒容、密闭容器中通入 和
和 ,测得有关物质的物质的量随温度变化如下图。
,测得有关物质的物质的量随温度变化如下图。
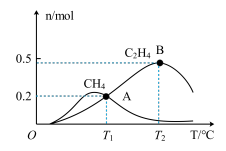
①催化剂在较低温度时主要选择___________ (填“反应Ⅰ”或“反应Ⅱ”)。
② 时
时 的转化率为
的转化率为___________ ,反应Ⅰ的平衡常数
___________ 。
反应Ⅰ:


反应Ⅱ:


(1)将反应后气体通入
(2)计算


 和
和 表示)。
表示)。(3)相同投料比时,体系内
 的平衡转化率与温度T和压强p的关系如图,温度从高到低的顺序为
的平衡转化率与温度T和压强p的关系如图,温度从高到低的顺序为
(4)镍氢催化剂活性会因为甲烷分解产生积碳而降低,同时二氧化碳可与碳发生消碳反应:
积碳反应:

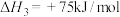
消碳反应:

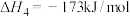
其他条件相同时,催化剂表面积碳量与温度的关系如图所示,
 ℃之后,温度升高积碳量减小的主要原因是
℃之后,温度升高积碳量减小的主要原因是
(5)向
 恒容、密闭容器中通入
恒容、密闭容器中通入 和
和 ,测得有关物质的物质的量随温度变化如下图。
,测得有关物质的物质的量随温度变化如下图。
①催化剂在较低温度时主要选择
②
 时
时 的转化率为
的转化率为
您最近一年使用:0次
解题方法
2 . 某化学小组探究铜和稀硝酸的反应:
资料1 铜与浓度低于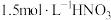 反应很慢,且放热极少。
反应很慢,且放热极少。
(1)实验预测
①铜与稀 反应的离子方程式为
反应的离子方程式为_______ 。
②小组同学预测铜与稀 的反应速率应逐渐减慢,其理论依据是
的反应速率应逐渐减慢,其理论依据是_______ 。
(2)实验实施
实验I:铜丝与 反应。
反应。
实验II:探究Cu与稀 在无氧环境下反应所得溶液显绿色的原因:
在无氧环境下反应所得溶液显绿色的原因:
资料2:
i.上述溶液中均不存在-3价的氮; 为淡黄色沉淀。
为淡黄色沉淀。
ii. 是一种弱酸,
是一种弱酸, ;
;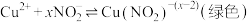
①通过上述实验,证明铜与稀 反应过程中可能有
反应过程中可能有 生成,理由是
生成,理由是_______ 。
②分析阶段B溶液呈绿色的原因_______ 。
③从平衡角度分析实验II中,阶段B溶液中滴加稀硫酸溶液由绿色变蓝的原因_______ 。
④写出铜和稀 反应的生成
反应的生成 的化学方程式
的化学方程式_______ 。
(3)继续探究:
探究铜和稀 反应速率变化的原因:小组同学依据实验I的数据,画出铜和稀硝酸反应的速率时间图像为下图:
反应速率变化的原因:小组同学依据实验I的数据,画出铜和稀硝酸反应的速率时间图像为下图:
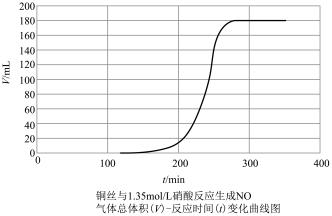
甲同学提出,铜与稀硝酸反应,反应开始较慢(阶段A),后较快(阶段B),可能是因为反应生成的产物 有催化作用,并通过实验证明了自己的猜想:甲同学设计的实验方案为
有催化作用,并通过实验证明了自己的猜想:甲同学设计的实验方案为_______ 。
(4)反思总结:通过上述实验探究过程,铜和 的反应实际过程可能为
的反应实际过程可能为_______ 。
资料1 铜与浓度低于
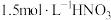 反应很慢,且放热极少。
反应很慢,且放热极少。(1)实验预测
①铜与稀
 反应的离子方程式为
反应的离子方程式为②小组同学预测铜与稀
 的反应速率应逐渐减慢,其理论依据是
的反应速率应逐渐减慢,其理论依据是(2)实验实施
实验I:铜丝与
 反应。
反应。| 实验装置 | 实验操作 | 实验现象 |
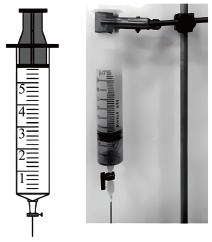 | 在洁净的注射器中装入已活化铜丝2.3g,再用注射器抽取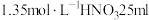 ,同时排尽注射器中的空气,关闭注射器止水开关,以保证铜丝与稀 ,同时排尽注射器中的空气,关闭注射器止水开关,以保证铜丝与稀 反应体系处于无氧环境中。 反应体系处于无氧环境中。 | 反应较慢阶段A:反应前90min几乎没有现象,90min左右才有很少气泡产生(该气体遇空气变成红棕色),溶液为浅蓝色;反应较快阶段B:之后溶液逐渐变为绿色;最后阶段C:在反应结束前15min左右时,体系溶液为深蓝色。 |
 在无氧环境下反应所得溶液显绿色的原因:
在无氧环境下反应所得溶液显绿色的原因:操作及现象 实验序号 | 取不同阶段的溶液进行实验操作 | 实验现象 | ||
| 阶段A溶液 | 阶段B溶液 | 阶段C溶液 | ||
| 1 | 滴加 酸性 酸性 溶液 溶液 | 褪色,滴6滴后溶液不褪色 | 褪色,但滴20滴后溶液仍然褪色 | 褪色,滴10滴后溶液不再褪色 |
| 2 | 滴加3% 溶液 溶液 | 无明显现象 | 少量淡黄色沉淀 | 较多黄色沉淀 |
| 3 | 滴加稀 溶液 溶液 | 无明显现象 | 变蓝色 | 无明显现象 |
i.上述溶液中均不存在-3价的氮;
 为淡黄色沉淀。
为淡黄色沉淀。ii.
 是一种弱酸,
是一种弱酸, ;
;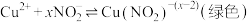
①通过上述实验,证明铜与稀
 反应过程中可能有
反应过程中可能有 生成,理由是
生成,理由是②分析阶段B溶液呈绿色的原因
③从平衡角度分析实验II中,阶段B溶液中滴加稀硫酸溶液由绿色变蓝的原因
④写出铜和稀
 反应的生成
反应的生成 的化学方程式
的化学方程式(3)继续探究:
探究铜和稀
 反应速率变化的原因:小组同学依据实验I的数据,画出铜和稀硝酸反应的速率时间图像为下图:
反应速率变化的原因:小组同学依据实验I的数据,画出铜和稀硝酸反应的速率时间图像为下图:
甲同学提出,铜与稀硝酸反应,反应开始较慢(阶段A),后较快(阶段B),可能是因为反应生成的产物
 有催化作用,并通过实验证明了自己的猜想:甲同学设计的实验方案为
有催化作用,并通过实验证明了自己的猜想:甲同学设计的实验方案为(4)反思总结:通过上述实验探究过程,铜和
 的反应实际过程可能为
的反应实际过程可能为
您最近一年使用:0次
2023-01-09更新
|
767次组卷
|
4卷引用:北京市顺义区2023届高三第一次统练化学试题
名校
3 . 某小组探究含Cr元素的化合物间的转化,进行如下实验。
资料:
i.含Cr元素的常见粒子: (橙色)、
(橙色)、 (黄色)、CrO5(溶于水,蓝紫色,不稳定)、Cr3+(绿色)、Cr(OH)3(蓝灰色,难溶于水,可溶于强酸、强碱)、
(黄色)、CrO5(溶于水,蓝紫色,不稳定)、Cr3+(绿色)、Cr(OH)3(蓝灰色,难溶于水,可溶于强酸、强碱)、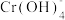 (亮绿色)。
(亮绿色)。
ii.H2O2在碱性环境中比在酸性环境中分解速率快。
iii.在碱性环境中,O2不能氧化+3价铬元素。
实验操作及现象如表:
(1)已知 (橙色)+H2O
(橙色)+H2O 2
2 (黄色)+2H+。请用化学平衡移动原理解释I中滴入稀硫酸后溶液橙色加深的原因:
(黄色)+2H+。请用化学平衡移动原理解释I中滴入稀硫酸后溶液橙色加深的原因:_____ 。
(2)I中,溶液由橙色变为绿色的总反应的离子方程式是_____ 。
(3)Ⅱ中,继续滴入NaOH溶液后,又有气泡生成的原因是_____ 。
(4)Ⅱ中,继续滴入NaOH溶液后,预测有Cr(OH)3沉淀生成,但实验时未观察到。
提出假设:在碱性环境中,+3价铬元素被H2O2氧化。
①甲同学设计实验证明假设成立:
取少量I中的绿色溶液,在滴入NaOH溶液前增加一步操作:______ 。然后滴入NaOH溶液,有蓝灰色沉淀生成,继续滴入NaOH溶液,沉淀溶解,溶液变为______ 色。
②乙同学进一步研究碱性环境对+3价铬元素的还原性或H2O2的氧化性的影响,设计如图实验。
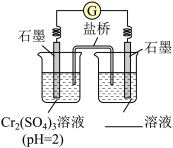
右侧烧杯的溶液中,氧化剂是_____ 。
开始时灵敏电流计指针不偏转,分别继续进行如下实验。
i.向左侧烧杯中滴入NaOH溶液,出现蓝灰色沉淀,继续缓慢滴入NaOH溶液,灵敏电流计指针向右偏转(电子从左向右运动),此时左侧的电极反应式为_____ 。
ii.向右侧烧杯中滴入NaOH溶液,有微小气泡生成,灵敏电流计指针向左偏转,左侧无明显变化。此时原电池中的总反应的化学方程式为_____ 。
(5)由上述实验, 与H2O2、
与H2O2、 与H2O2的氧化性强弱(填“>”或“<”):
与H2O2的氧化性强弱(填“>”或“<”):
酸性条件下,
_____ H2O2;碱性条件下, 
_____ H2O2。
资料:
i.含Cr元素的常见粒子:
 (橙色)、
(橙色)、 (黄色)、CrO5(溶于水,蓝紫色,不稳定)、Cr3+(绿色)、Cr(OH)3(蓝灰色,难溶于水,可溶于强酸、强碱)、
(黄色)、CrO5(溶于水,蓝紫色,不稳定)、Cr3+(绿色)、Cr(OH)3(蓝灰色,难溶于水,可溶于强酸、强碱)、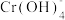 (亮绿色)。
(亮绿色)。ii.H2O2在碱性环境中比在酸性环境中分解速率快。
iii.在碱性环境中,O2不能氧化+3价铬元素。
实验操作及现象如表:
| 装置 | 步骤 | 操作 | 现象 |
 2mL0.0125mol•L-1K2Cr2O7溶液 | I | 先滴入稀硫酸至pH≈2,再滴入5滴5%H2O2溶液,振荡 | 溶液橙色加深。滴入H2O2溶液后迅速变为蓝紫色,有气泡生成。稍后,无明显气泡时,溶液由蓝紫色完全变为绿色 |
| Ⅱ | 继续缓慢滴入10滴2mol•L-1NaOH溶液,边滴,边振荡 | 又有气泡生成,溶液最终变为黄色 |
 (橙色)+H2O
(橙色)+H2O 2
2 (黄色)+2H+。请用化学平衡移动原理解释I中滴入稀硫酸后溶液橙色加深的原因:
(黄色)+2H+。请用化学平衡移动原理解释I中滴入稀硫酸后溶液橙色加深的原因:(2)I中,溶液由橙色变为绿色的总反应的离子方程式是
(3)Ⅱ中,继续滴入NaOH溶液后,又有气泡生成的原因是
(4)Ⅱ中,继续滴入NaOH溶液后,预测有Cr(OH)3沉淀生成,但实验时未观察到。
提出假设:在碱性环境中,+3价铬元素被H2O2氧化。
①甲同学设计实验证明假设成立:
取少量I中的绿色溶液,在滴入NaOH溶液前增加一步操作:
②乙同学进一步研究碱性环境对+3价铬元素的还原性或H2O2的氧化性的影响,设计如图实验。

右侧烧杯的溶液中,氧化剂是
开始时灵敏电流计指针不偏转,分别继续进行如下实验。
i.向左侧烧杯中滴入NaOH溶液,出现蓝灰色沉淀,继续缓慢滴入NaOH溶液,灵敏电流计指针向右偏转(电子从左向右运动),此时左侧的电极反应式为
ii.向右侧烧杯中滴入NaOH溶液,有微小气泡生成,灵敏电流计指针向左偏转,左侧无明显变化。此时原电池中的总反应的化学方程式为
(5)由上述实验,
 与H2O2、
与H2O2、 与H2O2的氧化性强弱(填“>”或“<”):
与H2O2的氧化性强弱(填“>”或“<”):酸性条件下,


您最近一年使用:0次
2023-01-07更新
|
406次组卷
|
4卷引用:北京市顺义牛栏山第一中学2022-2023学年高二下学期3月月考化学试题
名校
4 . 某小组同学对 与
与 的反应进行探究。
的反应进行探究。
【初步探究】室温下进行下表所列实验。
(1)证明实验I中有 生成,加入的试剂为
生成,加入的试剂为_______ 。
(2)写出实验反应的离子方程式:_______ 。
(3)结合上述实验现象可以证明 与
与 发生可逆反应,原因是
发生可逆反应,原因是_______ 。
【深入探究】 后继续观察实验现象:实验I溶液棕黄色变深;实验II溶液红色变浅。
后继续观察实验现象:实验I溶液棕黄色变深;实验II溶液红色变浅。
(4)已知在酸性较强的条件下, 可被空气氧化为
可被空气氧化为 ,故甲同学提出假设:该反应条件下空气将
,故甲同学提出假设:该反应条件下空气将 氧化为
氧化为 ,使实验I中溶液棕黄色变深。甲同学设计实验:
,使实验I中溶液棕黄色变深。甲同学设计实验:_______ , 内溶液不变蓝,证明该假设不成立,导致溶液不变蓝的因素可能是
内溶液不变蓝,证明该假设不成立,导致溶液不变蓝的因素可能是_______ (写出两条)。
(5)乙同学查阅资料可知: 与
与 的反应体系中还存在
的反应体系中还存在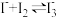 ,
, 呈棕褐色。依据资料从平衡移动原理解释实验II中
呈棕褐色。依据资料从平衡移动原理解释实验II中 后溶液红色变浅的原因:
后溶液红色变浅的原因:_______ 。
 与
与 的反应进行探究。
的反应进行探究。【初步探究】室温下进行下表所列实验。
| 序号 | 操作 | 现象 |
| 实验I | 取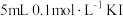 溶液,滴加 溶液,滴加 溶液5~6滴(混合溶液 溶液5~6滴(混合溶液 ) ) | 溶液变为棕黄色 |
| 实验II | 取 实验反应后的溶液,滴加2滴 实验反应后的溶液,滴加2滴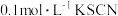 溶液 溶液 | 溶液呈红色 |
 生成,加入的试剂为
生成,加入的试剂为(2)写出实验反应的离子方程式:
(3)结合上述实验现象可以证明
 与
与 发生可逆反应,原因是
发生可逆反应,原因是【深入探究】
 后继续观察实验现象:实验I溶液棕黄色变深;实验II溶液红色变浅。
后继续观察实验现象:实验I溶液棕黄色变深;实验II溶液红色变浅。(4)已知在酸性较强的条件下,
 可被空气氧化为
可被空气氧化为 ,故甲同学提出假设:该反应条件下空气将
,故甲同学提出假设:该反应条件下空气将 氧化为
氧化为 ,使实验I中溶液棕黄色变深。甲同学设计实验:
,使实验I中溶液棕黄色变深。甲同学设计实验: 内溶液不变蓝,证明该假设不成立,导致溶液不变蓝的因素可能是
内溶液不变蓝,证明该假设不成立,导致溶液不变蓝的因素可能是(5)乙同学查阅资料可知:
 与
与 的反应体系中还存在
的反应体系中还存在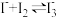 ,
, 呈棕褐色。依据资料从平衡移动原理解释实验II中
呈棕褐色。依据资料从平衡移动原理解释实验II中 后溶液红色变浅的原因:
后溶液红色变浅的原因:
您最近一年使用:0次
名校
5 . 某小组同学对FeCl3与KI的反应进行探究。
【初步探究】室温下进行下表所列实验。
(1)证明实验Ⅰ中有I2生成,加入的试剂为_______ 。
(2)实验Ⅱ可以证明Fe3+与I-发生可逆反应,其操作为_______ 。
(3)写出实验Ⅰ反应的离子方程式:_______ 。
(4)实验Ⅰ中溶液的颜色不变后再进行后续实验,其目的是_______ 。
【深入探究】20min后继续观察实验现象:实验Ⅰ溶液棕黄色变深;实验Ⅱ溶液红色变浅。
(5)已知在酸性较强的条件下,I-可被空气氧化为I2,故甲同学提出假设:该反应条件下空气将I-氧化为I2,使实验Ⅰ中溶液棕黄色变深。甲同学设计实验:_______ ,20 min内溶液不变蓝,证明该假设不成立,导致溶液不变蓝的因素 可能是_______ (写出1条即可)。
(6)乙同学查阅资料可知:FeCl3与KI的反应体系中还存在I-+I2 I
I ,I
,I 呈棕褐色。依据资料从平衡移动原理解释实验Ⅱ中20 min后溶液红色变浅的原因:
呈棕褐色。依据资料从平衡移动原理解释实验Ⅱ中20 min后溶液红色变浅的原因:_______ 。
【初步探究】室温下进行下表所列实验。
| 序号 | 操作 | 现象 |
| 实验Ⅰ | 取5 mL0.1 mol·L-1KI溶液,滴加0.1 mol·L-1FeCl3溶液5~6滴(混合溶液pH=5) | 溶液变为棕黄色 |
| 实验Ⅱ | _______ | 溶液变红 |
(2)实验Ⅱ可以证明Fe3+与I-发生可逆反应,其操作为
(3)写出实验Ⅰ反应的离子方程式:
(4)实验Ⅰ中溶液的颜色不变后再进行后续实验,其目的是
【深入探究】20min后继续观察实验现象:实验Ⅰ溶液棕黄色变深;实验Ⅱ溶液红色变浅。
(5)已知在酸性较强的条件下,I-可被空气氧化为I2,故甲同学提出假设:该反应条件下空气将I-氧化为I2,使实验Ⅰ中溶液棕黄色变深。甲同学设计实验:
(6)乙同学查阅资料可知:FeCl3与KI的反应体系中还存在I-+I2
 I
I ,I
,I 呈棕褐色。依据资料从平衡移动原理解释实验Ⅱ中20 min后溶液红色变浅的原因:
呈棕褐色。依据资料从平衡移动原理解释实验Ⅱ中20 min后溶液红色变浅的原因:
您最近一年使用:0次
2022-10-22更新
|
212次组卷
|
3卷引用:北京市顺义牛栏山第一中学2022-2023学年高二上学期10月月考化学试题
名校
6 . 某实验小组对 溶液与
溶液与 溶液的反应进行探究。
溶液的反应进行探究。
【实验】
(1)配制 溶液时,先将
溶液时,先将 溶于浓盐酸,再稀释至指定浓度。从化学平衡角度说明浓盐酸的作用:
溶于浓盐酸,再稀释至指定浓度。从化学平衡角度说明浓盐酸的作用:_______ 。
(2)探究现象i产生的原因:
甲同学认为发生反应: ,进行实验证实。他取少量红褐色溶液于试管中,用一束光照射,在垂直于光束方向观察到
,进行实验证实。他取少量红褐色溶液于试管中,用一束光照射,在垂直于光束方向观察到_______ ;向试管中继续滴加1mol/L 溶液,发现溶液红褐色变深且产生刺激性气味的气体,该气体是
溶液,发现溶液红褐色变深且产生刺激性气味的气体,该气体是_______ (填化学式)。
(3)探究现象ii产生的原因:
①乙同学认为还发生了氧化还原反应,其离子方程式为_______ ;他取少许红褐色溶液于试管中,加入_______ ,有白色沉淀产生,证明产物中含有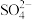 。
。
②丙同学认为乙同学的实验不严谨,因为在上述过程中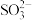 可能被其它物质氧化。为了进一步确认
可能被其它物质氧化。为了进一步确认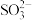 被
被 氧化,丙同学设计的实验方案是
氧化,丙同学设计的实验方案是_______ 。
(4)综合上述结果,请从化学反应速率和化学反应限度角度解释,现象i和ii产生的原因为_______ 。
 溶液与
溶液与 溶液的反应进行探究。
溶液的反应进行探究。【实验】
| 装置 | 实验现象 |
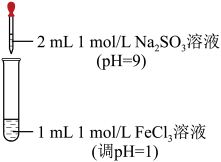 | 现象ⅰ:一开始溶液颜色加深,由棕黄色变为红褐色。 现象ⅱ:一段时间后溶液颜色变浅,变为浅黄色。 |
 溶液时,先将
溶液时,先将 溶于浓盐酸,再稀释至指定浓度。从化学平衡角度说明浓盐酸的作用:
溶于浓盐酸,再稀释至指定浓度。从化学平衡角度说明浓盐酸的作用:(2)探究现象i产生的原因:
甲同学认为发生反应:
 ,进行实验证实。他取少量红褐色溶液于试管中,用一束光照射,在垂直于光束方向观察到
,进行实验证实。他取少量红褐色溶液于试管中,用一束光照射,在垂直于光束方向观察到 溶液,发现溶液红褐色变深且产生刺激性气味的气体,该气体是
溶液,发现溶液红褐色变深且产生刺激性气味的气体,该气体是(3)探究现象ii产生的原因:
①乙同学认为还发生了氧化还原反应,其离子方程式为
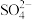 。
。②丙同学认为乙同学的实验不严谨,因为在上述过程中
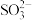 可能被其它物质氧化。为了进一步确认
可能被其它物质氧化。为了进一步确认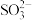 被
被 氧化,丙同学设计的实验方案是
氧化,丙同学设计的实验方案是(4)综合上述结果,请从化学反应速率和化学反应限度角度解释,现象i和ii产生的原因为
您最近一年使用:0次
名校
解题方法
7 . 实验小组探究不同浓度 溶液的电解反应。分别用石墨电极电解
溶液的电解反应。分别用石墨电极电解 溶液和
溶液和 溶液,记录实验现象如下表。
溶液,记录实验现象如下表。
(1)经检验,阳极产生的气体能使湿润的淀粉KI试纸变蓝。①中电解反应的化学方程式为___________ 。
Ⅰ.探究②中产生白色固体的原因。
查阅资料:
i.阴极附近的白色固体为 ;
;
ii. 在水溶液中单独存在时不稳定,容易发生反应:
在水溶液中单独存在时不稳定,容易发生反应: 。
。
结合资料分析CuCl产生的路径有如下两种可能:
(2)路径1:阴极发生电极反应分两步:
i.___________
ⅱ. ,同时伴随反应
,同时伴随反应 ,生成白色沉淀。
,生成白色沉淀。
(3)路径2:阴极发生电极反应 ,而后发生反应a:
,而后发生反应a:___________ (写出离子方程式),生成白色沉淀。同学们通过实验证明反应a可以发生,其实验操作和现象是___________ 。
Ⅱ.探究②中阴极区液体中黑色物质的成分。
进一步查阅资料,提出以下猜想。
猜想1.生成氢氧化铜,进而转化为极细小的氧化铜;
猜想2.生成铜的速率快,形成黑色纳米铜;
猜想3.发生反应 (棕黑色)。
(棕黑色)。
(4)若猜想1成立,则阴极一定还存在的电极反应是___________ 。
取2mL黑色液体于试管中,分别加入不同试剂,记录实验现象如下表。
(5)甲同学根据实验③产生的现象得出结论:黑色液体中一定有纳米铜。乙同学认为甲同学的结论不合理,他做出判断的依据是___________ 。
(6)由上述实验可得到的关于黑色物质成分的结论是___________ 。
 溶液的电解反应。分别用石墨电极电解
溶液的电解反应。分别用石墨电极电解 溶液和
溶液和 溶液,记录实验现象如下表。
溶液,记录实验现象如下表。| 实验装置 | 实验编号及试剂 | 实验现象 |
 | ① 溶液(蓝色) 溶液(蓝色) | 阳极:产生有刺激性气味的气体 阴极:电极上有红色固体析出 |
② 溶液(绿色) 溶液(绿色) | 阳极:产生有刺激性气味的气体 阴极:电极上有少量红色固体和白色固体析出,同时电极附近液体变为黑色 |
Ⅰ.探究②中产生白色固体的原因。
查阅资料:
i.阴极附近的白色固体为
 ;
;ii.
 在水溶液中单独存在时不稳定,容易发生反应:
在水溶液中单独存在时不稳定,容易发生反应: 。
。结合资料分析CuCl产生的路径有如下两种可能:
(2)路径1:阴极发生电极反应分两步:
i.
ⅱ.
 ,同时伴随反应
,同时伴随反应 ,生成白色沉淀。
,生成白色沉淀。(3)路径2:阴极发生电极反应
 ,而后发生反应a:
,而后发生反应a:Ⅱ.探究②中阴极区液体中黑色物质的成分。
进一步查阅资料,提出以下猜想。
猜想1.生成氢氧化铜,进而转化为极细小的氧化铜;
猜想2.生成铜的速率快,形成黑色纳米铜;
猜想3.发生反应
 (棕黑色)。
(棕黑色)。(4)若猜想1成立,则阴极一定还存在的电极反应是
取2mL黑色液体于试管中,分别加入不同试剂,记录实验现象如下表。
| 实验编号 | ③ | ④ | ⑤ |
| 加入试剂 | 4mL浓 | 4mL浓HCl |  |
| 实验现象 | 溶液变澄清,呈绿色,试管口有浅红棕色气体生成 | 黑色液体颜色变深 | 溶液变澄清,呈绿色,同时出现少量白色沉淀 |
(6)由上述实验可得到的关于黑色物质成分的结论是
您最近一年使用:0次
2021-05-10更新
|
739次组卷
|
3卷引用:北京市顺义区第一中学2023届高三下学期2月月考化学试题
名校
8 . 某兴趣小组以重铬酸钾(K2Cr2O7)溶液为研究对象,结合所学反应原理的知识改变条件使其发生“色彩变幻”。
已知:①K2Cr2O7溶液存在平衡:Cr2O +H2O
+H2O 2CrO
2CrO +2H+。
+2H+。
②含铬元素的离子在溶液中的颜色:Cr2O (橙色);CrO
(橙色);CrO (黄色);Cr3+(绿色)。
(黄色);Cr3+(绿色)。
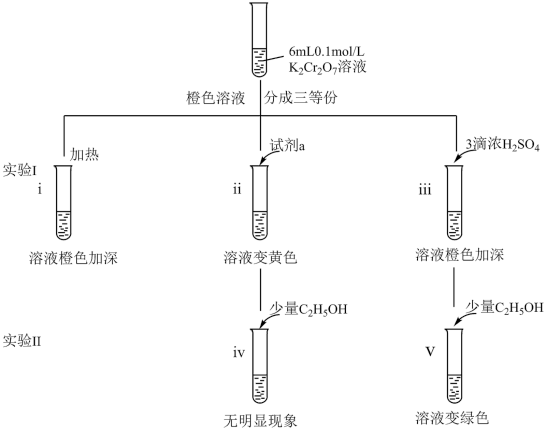
(1)i可证明反应Cr2O +H2O
+H2O 2CrO
2CrO +2H+的正反应是
+2H+的正反应是__________ (填“吸热”或“放热”)。
(2)ii是验证“只降低生成物的浓度,该平衡正向移动”,试剂a是_________ 。
(3)iii的目的是要验证“增大生成物的浓度,该平衡逆向移动”,此实验是否能达到预期目的________ (填“能”或“不能”),理由是____________ 。
(4)根据实验Ⅱ中不同现象,可以得出的结论是__________ 。
(5)继续实验
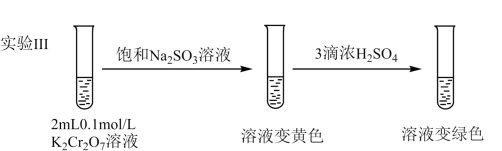
①解释溶液变黄的主要原因是________ 。
②溶液变绿色,该反应的离子方程式是_____________ 。
已知:①K2Cr2O7溶液存在平衡:Cr2O
 +H2O
+H2O 2CrO
2CrO +2H+。
+2H+。②含铬元素的离子在溶液中的颜色:Cr2O
 (橙色);CrO
(橙色);CrO (黄色);Cr3+(绿色)。
(黄色);Cr3+(绿色)。
(1)i可证明反应Cr2O
 +H2O
+H2O 2CrO
2CrO +2H+的正反应是
+2H+的正反应是(2)ii是验证“只降低生成物的浓度,该平衡正向移动”,试剂a是
(3)iii的目的是要验证“增大生成物的浓度,该平衡逆向移动”,此实验是否能达到预期目的
(4)根据实验Ⅱ中不同现象,可以得出的结论是
(5)继续实验

①解释溶液变黄的主要原因是
②溶液变绿色,该反应的离子方程式是
您最近一年使用:0次
2018-03-02更新
|
574次组卷
|
11卷引用:北京市第四中学顺义分校2021-2022学年高二上学期期中考试化学试题
北京市第四中学顺义分校2021-2022学年高二上学期期中考试化学试题北京市东城区2016-2017学年高二下学期期末考试化学试题重庆市南岸区2019-2020学年高二上学期期末学业质量调研抽测化学试题云南省玉溪澄江市第一中学2021-2022学年下学期高二开学考试化学试题天津市静海区第一中学2021-2022学年高三上学期12月调研考试化学试题云南省瑞丽市第一民族中学2021-2022学年高二下学期2月份开学测试化学试题黑龙江省双鸭山市第一中学2022-2023学年高二10月月考化学试题天津市静海区第一中学2020-2021学年高三下学期第三次模拟考试化学试题云南省昌宁县第一中学2022-2023学年高二下学期期末考试化学试题黑龙江省佳木斯市第一中学2023-2024学年高二上学期10月月考化学试题广东省广州市广雅集团2023-2024学年高二上学期11月期中考试化学试题
名校
9 . 一定温度下,在2个容积均为1L的恒容密闭容器中,加入一定量的反应物,发生反应: ,相关数据见下表。
,相关数据见下表。
下列说法不正确的是
 ,相关数据见下表。
,相关数据见下表。| 容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | |
| NO(g) | CO(g) | CO2(g) | ||
| I | T1 | 0.2 | 0.2 | 0.1 |
| Ⅱ | T2 | 0.2 | 0.2 | 0.12 |
| A.T1>T2 |
| B.I中反应达到平衡时,CO的转化率为50% |
| C.达到平衡所需要的时间:Ⅱ>I |
| D.对于I,平衡后向容器中再充入0.2molCO和0.2molCO2,平衡正向移动 |
您最近一年使用:0次
2023-12-04更新
|
212次组卷
|
21卷引用:北京市顺义区杨镇第一中学2023-2024学年高二上学期期中考试化学试题
北京市顺义区杨镇第一中学2023-2024学年高二上学期期中考试化学试题北京市西城区2022届高三一模化学试题(已下线)专项12 化学反应速率与化学平衡-备战2022年高考化学阶段性新题精选专项特训(全国卷)(4月期)(已下线)化学-2022年高考押题预测卷01(北京卷)北京市第二中学2022届高三下学期五月模拟考试化学试题(已下线)化学(辽宁A卷)-学易金卷:2023年高考第一次模拟考试卷北京理工大学附属中学2022-2023学年高三上学期12月月考化学试题北京市第二中学2022-2023学年高三上学期12月考化学试题辽宁省葫芦岛市第一高级中学2022-2023学年高三上学期期末线上教学阶段检测化学试题辽宁省抚顺市第一中学2022-2023学年高三上学期期末线上阶段验收化学试题湖南省衡阳市第一中学2023届高三下学期第四次月考化学试题湖南省宁乡市第一高级中学2023届高三第七次月考化学试题湖南省株洲市第一中学2023届高三第七次月考化学试题辽宁省本溪市高级中学2023届高三下学期第一次摸底考试化学试题北京市第一○一中学2023-2024学年高二上学期统练一化学试题北京汇文中学2023-2024学年高二上学期期中考试化学试题北京市育英学校2023-2024学年高三上学期(12月)统测五化学学科试题北京市第十五中学2023-2024学年高二上学期期中考试化学试题辽宁省沈阳市重点高中联合体2023-2024学年高二上学期期末考试化学试题云南省大理州民族中学2023-2024学年高二下学期见面考化学试题北京市北京师范大学附属中学平谷第一分校2023-2024学年高三上学期期中考试化学试题
名校
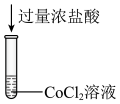
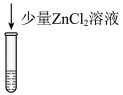
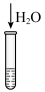
10 . 某小组对 的性质进行探究,实验操作及现象如下,下列说法不正确的是
的性质进行探究,实验操作及现象如下,下列说法不正确的是
资料:
 的性质进行探究,实验操作及现象如下,下列说法不正确的是
的性质进行探究,实验操作及现象如下,下列说法不正确的是资料:
| 物质 |  |  |  |
| 溶液中的颜色 | 粉红色 | 蓝色 | 无色 |
| 操作 |
| 将a中得到的蓝色溶液均分为3份,分别倒入试管 、 、 、 、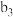 中 中 | ||
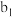 |
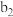 |
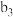 | ||
| 现象 | a中现象:加入浓盐酸后,溶液由粉红色变为蓝色 | 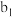 中现象:溶液变为粉红色 中现象:溶液变为粉红色 | 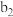 中现象 中现象 | 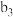 中现象 中现象 |
A.试管a中存在平衡: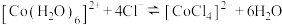 |
B.由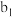 中现象可推测稳定性: 中现象可推测稳定性: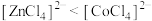 |
C.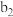 中现象可能为产生白色沉淀 中现象可能为产生白色沉淀 |
D.推测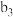 中现象为溶液变为粉红色,因为加入水使各组分离子浓度变化,平衡移动 中现象为溶液变为粉红色,因为加入水使各组分离子浓度变化,平衡移动 |
您最近一年使用:0次
2024-05-31更新
|
174次组卷
|
2卷引用:北京市顺义区第一中学2024届高三下学期三模化学试题