解题方法
1 . 利用下列实验药品,不能达到实验目的的是
| 实验目的 | 实验药品 | |
| A | 比较水和四氯化碳分子的极性 |  、 、 、橡胶棒、毛皮 、橡胶棒、毛皮 |
| B | 验证乙醇的消去产物乙烯 | 乙醇、酸性高锰酸钾溶液、浓硫酸 |
| C | 探究温度对化学平衡的影响 |  溶液、冷水、热水 溶液、冷水、热水 |
| D | 证明牺牲阳极法保护铁 | Fe、Zn、酸化的食盐水、 溶液 溶液 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-03-17更新
|
407次组卷
|
2卷引用:北京市石景山区2022-2023学年高三下学期质量监控(零模)化学试题
2 . 下列实验不能 达到实验目的的是
| A.铁上电镀铜 | B.证明温度对平衡的影响 |
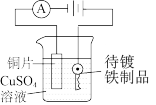 | 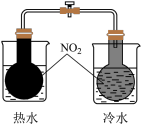 |
| C.研究酸碱性对平衡移动的影响 | D.验证铁发生吸氧腐蚀 |
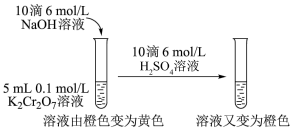 |  |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
3 . 某实验小组从电极反应角度探究银镜反应中物质氧化性和还原性的变化。
资料:ⅰ.[Ag(NH3)2]+⇌ [Ag(NH3)]++NH3K1=10−3.81
[Ag(NH3)]+⇌ Ag++NH3K2=10−3.24
ⅱ.AgOH不稳定,极易分解为黑色Ag2O,Ag2O溶于氨水
(1)实验发现:乙醛和AgNO3溶液水浴加热无明显现象;银氨溶液水浴加热无明显现象;滴加乙醛的银氨溶液水浴加热,试管壁逐渐出现一层光亮的银镜。
①有研究表明:配制银氨溶液时,AgNO3和氨水生成Ag(NH3)2NO3,写出生成Ag(NH3)2NO3的化学方程式_______ 。
②从氧化还原角度分析:发生银镜反应时,氧化性微粒可能是Ag+、_______ 。
(2)甲同学查阅资料:银镜反应时,Ag+被还原成Ag。
①电极反应式:
ⅰ.还原反应:Ag++e−=Ag
ⅱ.氧化反应:_______ 。(碱性条件下)
②从电极反应角度分析物质氧化性和还原性的变化:
ⅰ.随c(Ag+)降低,Ag+氧化性减弱。
ⅱ.随c(OH−)增大,乙醛还原性增强。
③补充实验验证②中的分析。
乙同学认为实验Ⅲ不能证明“随c(Ag+)降低,Ag+氧化性减弱”,理由是_______ 。
(3)设计实验进一步验证。
①乙同学认为通过实验Ⅳ能证明“随c(Ag+)降低,Ag+氧化性减弱”,你认为是否合理并说明原因_______ 。
②分析实验Ⅴ中“立即出现银镜的原因”,提出假设:随c(OH−)增大,可能是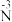 也参与了还原
也参与了还原 。经检验该假设成立,实验方案及现象是
。经检验该假设成立,实验方案及现象是_______ 。
(4)总结:ⅰ.银氨溶液和乙醛发生银镜反应时,氧化剂主要是Ag+,还原剂主要是乙醛;ⅱ.银氨溶液中滴加较浓的NaOH溶液能促进银镜反应的发生,此法不适用于检验醛基,请解释原因_______ 。
资料:ⅰ.[Ag(NH3)2]+⇌ [Ag(NH3)]++NH3K1=10−3.81
[Ag(NH3)]+⇌ Ag++NH3K2=10−3.24
ⅱ.AgOH不稳定,极易分解为黑色Ag2O,Ag2O溶于氨水
(1)实验发现:乙醛和AgNO3溶液水浴加热无明显现象;银氨溶液水浴加热无明显现象;滴加乙醛的银氨溶液水浴加热,试管壁逐渐出现一层光亮的银镜。
①有研究表明:配制银氨溶液时,AgNO3和氨水生成Ag(NH3)2NO3,写出生成Ag(NH3)2NO3的化学方程式
②从氧化还原角度分析:发生银镜反应时,氧化性微粒可能是Ag+、
(2)甲同学查阅资料:银镜反应时,Ag+被还原成Ag。
①电极反应式:
ⅰ.还原反应:Ag++e−=Ag
ⅱ.氧化反应:
②从电极反应角度分析物质氧化性和还原性的变化:
ⅰ.随c(Ag+)降低,Ag+氧化性减弱。
ⅱ.随c(OH−)增大,乙醛还原性增强。
③补充实验验证②中的分析。
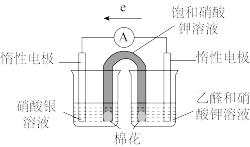
| 实验操作及现象: 实验Ⅰ.插入“饱和KNO3溶液”盐桥,电流表指针偏转; 实验Ⅱ.电流稳定后向右侧烧杯滴加NaOH溶液,指针偏转幅度增大; 实验Ⅲ.电流再次稳定后向左侧烧杯滴加氨水,指针偏转幅度减小 |
(3)设计实验进一步验证。
| 实验 | 实验操作 | 实验现象 |
| Ⅳ | 往盛有银氨溶液的试管中滴加浓氨水,无明显现象,加入3滴乙醛,振荡,水浴加热 | 闻到刺激性气味,溶液略显灰色,试管壁未见银镜 |
| Ⅴ | 往盛有银氨溶液的试管中滴加较浓的NaOH溶液至pH与实验Ⅳ相同,振荡,溶液变浑浊,加入3滴乙醛,振荡,水浴加热 | 试管壁 |
②分析实验Ⅴ中“立即出现银镜的原因”,提出假设:随c(OH−)增大,可能是
 也参与了还原
也参与了还原 。经检验该假设成立,实验方案及现象是
。经检验该假设成立,实验方案及现象是(4)总结:ⅰ.银氨溶液和乙醛发生银镜反应时,氧化剂主要是Ag+,还原剂主要是乙醛;ⅱ.银氨溶液中滴加较浓的NaOH溶液能促进银镜反应的发生,此法不适用于检验醛基,请解释原因
您最近一年使用:0次
2022-04-02更新
|
1048次组卷
|
7卷引用:北京市石景山区2022届高三一模化学试题
4 . 研究+6价铬盐不同条件下微粒存在形式及氧化性,某小组同学进行如下实验:
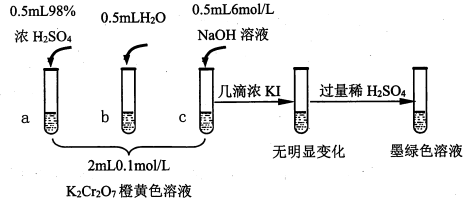
已知:Cr2O (橙色)+H2O
(橙色)+H2O 2CrO
2CrO (黄色)+2H+ △H= +13.8 kJ/mol,+6价铬盐在一定条件下可被还原为Cr3+,Cr3+在水溶液中为绿色。
(黄色)+2H+ △H= +13.8 kJ/mol,+6价铬盐在一定条件下可被还原为Cr3+,Cr3+在水溶液中为绿色。
(1)试管c和b对比,推测试管c的现象是________ 。
(2)试管a和b对比,a中溶液橙色加深。甲认为温度也会影响平衡的移动,橙色加深不一定是c(H+)增大影响的结果;乙认为橙色加深一定是c(H+)增大对平衡的影响。你认为是否需要再设计实验证明?____ (“是”或“否”),理由是_________________________________ 。
(3)对比试管a、b、c的实验现象,得到的结论是________________ 。
(4)试管c继续滴加KI溶液、过量稀H2SO4,分析上图的实验现象,得出的结论是_______ ;写出此过程中氧化还原反应的离子方程式________________ 。
(5)小组同学用电解法处理含Cr2O 废水,探究不同因素对含Cr2O
废水,探究不同因素对含Cr2O 废水处理的影响,结果如下表所示(Cr2O
废水处理的影响,结果如下表所示(Cr2O 的起始浓度,体积、电压、电解时间均相同)。
的起始浓度,体积、电压、电解时间均相同)。
①实验ⅱ中Cr2O 放电的电极反应式是
放电的电极反应式是________________ 。
②实验ⅲ中Fe3+去除Cr2O 的机理如图所示,结合此机理,解释实验iv中Cr2O
的机理如图所示,结合此机理,解释实验iv中Cr2O 去除率提高较多的原因
去除率提高较多的原因_______________ 。


已知:Cr2O
 (橙色)+H2O
(橙色)+H2O 2CrO
2CrO (黄色)+2H+ △H= +13.8 kJ/mol,+6价铬盐在一定条件下可被还原为Cr3+,Cr3+在水溶液中为绿色。
(黄色)+2H+ △H= +13.8 kJ/mol,+6价铬盐在一定条件下可被还原为Cr3+,Cr3+在水溶液中为绿色。(1)试管c和b对比,推测试管c的现象是
(2)试管a和b对比,a中溶液橙色加深。甲认为温度也会影响平衡的移动,橙色加深不一定是c(H+)增大影响的结果;乙认为橙色加深一定是c(H+)增大对平衡的影响。你认为是否需要再设计实验证明?
(3)对比试管a、b、c的实验现象,得到的结论是
(4)试管c继续滴加KI溶液、过量稀H2SO4,分析上图的实验现象,得出的结论是
(5)小组同学用电解法处理含Cr2O
 废水,探究不同因素对含Cr2O
废水,探究不同因素对含Cr2O 废水处理的影响,结果如下表所示(Cr2O
废水处理的影响,结果如下表所示(Cr2O 的起始浓度,体积、电压、电解时间均相同)。
的起始浓度,体积、电压、电解时间均相同)。| 实验 | ⅰ | ⅱ | ⅲ | ⅳ |
| 是否加入Fe2(SO4)3 | 否 | 否 | 加入5g | 否 |
| 是否加入H2SO4 | 否 | 加入1mL | 加入1mL | 加入1mL |
| 电极材料 | 阴、阳极均为石墨 | 阴、阳极均为石墨 | 阴、阳极均为石墨 | 阴极为石墨,阳极为铁 |
Cr2O 的去除率/% 的去除率/% | 0.922 | 12.7 | 20.8 | 57.3 |
 放电的电极反应式是
放电的电极反应式是②实验ⅲ中Fe3+去除Cr2O
 的机理如图所示,结合此机理,解释实验iv中Cr2O
的机理如图所示,结合此机理,解释实验iv中Cr2O 去除率提高较多的原因
去除率提高较多的原因
您最近一年使用:0次
2018-04-01更新
|
644次组卷
|
3卷引用:北京市石景山区2018届高三3月统一测试(一模)理综化学试题
解题方法
5 . 人工合成氨反应:N2(g)+3H2(g) 2NH3(g) ∆H<0,在5L密闭容器中进行此反应,30秒后NH3的物质的量增加了0.3mol。下列说法
2NH3(g) ∆H<0,在5L密闭容器中进行此反应,30秒后NH3的物质的量增加了0.3mol。下列说法不正确 的是
 2NH3(g) ∆H<0,在5L密闭容器中进行此反应,30秒后NH3的物质的量增加了0.3mol。下列说法
2NH3(g) ∆H<0,在5L密闭容器中进行此反应,30秒后NH3的物质的量增加了0.3mol。下列说法| A.30秒内v(N2)=0.001mol·L-1·s-1 |
| B.当容器内气体压强不再变化时,反应达到平衡 |
| C.其他条件不变,升高温度能加快反应速率,但降低N2的平衡转化率 |
| D.其他条件不变,使用催化剂能同时提高反应速率和该反应的平衡常数 |
您最近一年使用:0次
6 . CO2催化加氢制CH4的反应为: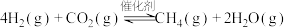 。催化剂上反应过程示意如图1所示。其他条件不变时,CO2的转化率和CH4的选择性(CO2转化为甲烷的量/ CO2转化的总量)随温度变化如图2所示。下列说法不正确的是
。催化剂上反应过程示意如图1所示。其他条件不变时,CO2的转化率和CH4的选择性(CO2转化为甲烷的量/ CO2转化的总量)随温度变化如图2所示。下列说法不正确的是
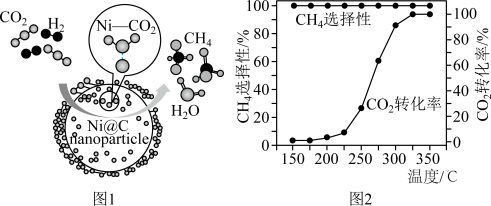
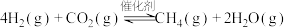 。催化剂上反应过程示意如图1所示。其他条件不变时,CO2的转化率和CH4的选择性(CO2转化为甲烷的量/ CO2转化的总量)随温度变化如图2所示。下列说法不正确的是
。催化剂上反应过程示意如图1所示。其他条件不变时,CO2的转化率和CH4的选择性(CO2转化为甲烷的量/ CO2转化的总量)随温度变化如图2所示。下列说法不正确的是
A.催化剂改变了 中O—C—O键的键角 中O—C—O键的键角 |
| B.150℃到350℃时,基本没有发生副反应 |
C. 催化加氢制 催化加氢制 是一个吸热反应 是一个吸热反应 |
D.结合下列热化学方程式,可以通过盖斯定律计算 加氢制 加氢制 的反应热 的反应热 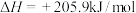 、 、  |
您最近一年使用:0次
2023-03-17更新
|
521次组卷
|
2卷引用:北京市石景山区2022-2023学年高三下学期质量监控(零模)化学试题
名校
7 . 在一定温度下、1L密闭容器中,3种气体起始状态和平衡状态时的物质的量(n)如表所示,下列有关说法正确的是
x | y | w | |
n(起始状态)/mol | 2 | 1 | 0 |
n(平衡状态)/mol | 1 | 0.5 | 1.5 |
A.该温度下,此反应的平衡常数表达式是K=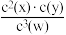 |
| B.升高温度,若w的体积分数减小,则此反应△H>0 |
| C.增大压强,正、逆反应速率均增大,平衡向正反应方向移动 |
| D.该温度下,再向容器中通入3molw,达到平衡时,n(x)=2mol |
您最近一年使用:0次
名校
8 . 已知A(g)+B(g)  2C(g) △H =akJ•mol﹣1,反应平衡常数K与温度的关系如表所示:
2C(g) △H =akJ•mol﹣1,反应平衡常数K与温度的关系如表所示:
900℃时,向2L的密闭容器中充入0.40molA和0.40molB,经10s反应达到平衡状态。下列说法不正确的是
 2C(g) △H =akJ•mol﹣1,反应平衡常数K与温度的关系如表所示:
2C(g) △H =akJ•mol﹣1,反应平衡常数K与温度的关系如表所示:| 温度/℃ | 750 | 900 | 1100 |
| K值 | 5.6 | 4 | 2.8 |
| A.a<0 |
| B.0~10s内,A的反应速率是0.01mol•L﹣1•s﹣1 |
| C.平衡时,C的物质的量浓度为0.1mol•L﹣1 |
| D.若将容器容积缩小为原来的一半,则B的转化率为50% |
您最近一年使用:0次
名校
解题方法
9 . 已知:2SO2(g) + O2(g)⇌2SO3(g) ΔH,不同条件下反应过程能量变化如图所示。下列说法中正确的是


| A.反应的ΔH>0 |
| B.过程b使用了催化剂 |
| C.使用催化剂可以提高SO2的平衡转化率 |
| D.过程b发生两步反应,第一步为放热反应 |
您最近一年使用:0次
2021-02-05更新
|
171次组卷
|
3卷引用:北京市石景山区2020-2021学年高二上学期期末调研化学试题
名校
解题方法
10 . 正戊烷异构化为异戊烷是油品升级的一项重要技术。在合适催化剂和一定压强下,正戊烷的平衡转化率(α)随温度变化如图所示。
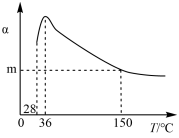
下列说法不正确 的是

名称 | 熔点/℃ | 沸点/℃ | 燃烧热 ∆H /kJ•mol-1 |
正戊烷 | -130 | 36 | –3506.1 |
异戊烷 | -159.4 | 27.8 | –3504.1 |
| A.25 ℃,101 kPa时,正戊烷异构化成异戊烷的热化学反应方程式为:CH3CH2CH2CH2CH3(l) = (CH3)2CHCH2CH3(l) ∆H = –2.0 kJ/mol |
| B.28~36 ℃时,随温度升高,正戊烷的平衡转化率增大,原因是异戊烷气化离开体系,产物浓度降低,平衡正向移动 |
| C.36~150 ℃时,随温度升高,正戊烷异构化反应的平衡常数增大 |
| D.150 ℃时,体系压强从100 kPa升高到500 kPa,正戊烷的平衡转化率基本不变 |
您最近一年使用:0次
2021-04-05更新
|
1188次组卷
|
12卷引用:北京市石景山区2021届高三一模化学试题
北京市石景山区2021届高三一模化学试题(已下线)2021年高考化学押题预测卷(北京卷)(01)湖南省长沙市第一中学2021届高三第一次模拟考试化学试题广东省汕头市金山中学2021届高三下学期第三次模拟考试化学试题重庆市西南大学附属中学2020-2021学年高三下学期第六次月考化学试题(已下线)第22讲 化学平衡常数及转化率的计算(精练)-2022年高考化学一轮复习讲练测天津市宁河区芦台第一中学2022届高三下学期线上模拟(一)化学试题湖北省武汉市第一中学2023届高三上学期第一次月考化学试题北京市朝阳区2023届高三下学期三模化学试题(已下线)考点2 化学平衡 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)安徽省芜湖市第十二中学2023-2024学年高二上学期10月月考化学试题辽宁省沈阳市东北育才双语学校2023-2024学年高二上学期自主测评化学试题



