名校
1 . 某同学研究浓度对化学平衡的影响,下列说法不正确的是
已知: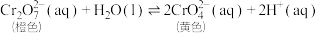  | |
| 实验步骤 | 实验现象 |
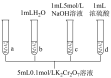 | ⅰ.待试管b中颜色不变后与试管a比较,试管b中橙色比试管a中的浅; ⅱ.待试管c中颜色不变后与试管b比较,试管c中的颜色比试管b中的浅; ⅲ.滴加浓硫酸,试管d温度略有升高,溶液颜色与试管b中的相比,变深 |
| A.试管b中的现象说明加水后平衡正向移动 |
| B.该实验能证明减小生成物浓度,平衡正向移动 |
| C.“待试管c中溶液颜色不变”的目的是使反应达到平衡状态 |
D.试管d中的现象能说明影响平衡的主要因素是 增大 增大 |
您最近一年使用:0次
解题方法
2 . 室温下,1体积的水能溶解约2体积的Cl2.用试管收集Cl2后进行如图所示实验,下列对实验现象的分析或预测正确的是
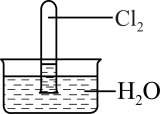
| A.试管内液面上升,证明Cl2与水发生了反应 |
| B.取出试管中的溶液,加入少量CaCO3粉末,溶液漂白能力减弱 |
C.取出试管中的溶液,光照一段时间后pH下降,与反应2HClO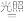 2HCl+O2↑有关 2HCl+O2↑有关 |
| D.取出试管中的溶液,滴加紫色石蕊溶液,溶液先变红后褪色,加热后颜色又变为红色 |
您最近一年使用:0次
名校
3 . 根据下列实验操作和现象所得到的结论正确的是
| A | B |
 |   |
将 球浸泡在冷水和热水中 球浸泡在冷水和热水中  ,气体在热水中比在冷水中颜色浅 ,气体在热水中比在冷水中颜色浅 | 平衡体系加压后颜色先变深后变浅 |
| C | D |
 | 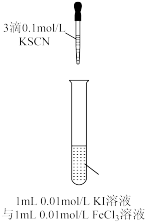 |
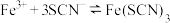 ,研究浓度对化学平衡的影响 ,研究浓度对化学平衡的影响 | 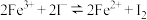 ,证明化学反应存在一定的限度 ,证明化学反应存在一定的限度 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
4 . 已知:[FeCl4(H2O)2]-为黄色,下列实验所得结论不正确的是
注:加热为微热,忽略体积变化。
| ① | ② | ③ | ④ |
0.1mol/L Fe2(SO4)3溶液 |
酸化的0.1mol/L Fe2(SO4)3溶液 |
酸化的0.1mol/L Fe2(SO4)3溶液 |
0.1mol/L FeCl3溶液 |
| 加热前溶液为浅黄色,加热后颜色变深 | 加热前溶液接近无色,加热后溶液颜色无明显变化 | 加入NaCl后,溶液立即变为黄色,加热后溶液颜色变深 | 加热前溶液为黄色,加热后溶液颜色变深 |
| A.实验①中,Fe2(SO4)3溶液显浅黄色原因是Fe3+水解产生了少量Fe(OH)3 |
| B.实验②中,酸化对Fe3+水解的影响程度大于温度的影响 |
C.实验③中,存在可逆反应: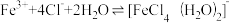 |
| D.实验④,可证明升高温度,Fe3+水解平衡正向移动 |
您最近一年使用:0次
名校
5 . 某小组探究含Cr元素的化合物间的转化,进行如下实验。
资料:
i.含Cr元素的常见粒子: (橙色)、
(橙色)、 (黄色)、CrO5(溶于水,蓝紫色,不稳定)、Cr3+(绿色)、Cr(OH)3(蓝灰色,难溶于水,可溶于强酸、强碱)、
(黄色)、CrO5(溶于水,蓝紫色,不稳定)、Cr3+(绿色)、Cr(OH)3(蓝灰色,难溶于水,可溶于强酸、强碱)、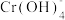 (亮绿色)。
(亮绿色)。
ii.H2O2在碱性环境中比在酸性环境中分解速率快。
iii.在碱性环境中,O2不能氧化+3价铬元素。
实验操作及现象如表:
(1)已知 (橙色)+H2O
(橙色)+H2O 2
2 (黄色)+2H+。请用化学平衡移动原理解释I中滴入稀硫酸后溶液橙色加深的原因:
(黄色)+2H+。请用化学平衡移动原理解释I中滴入稀硫酸后溶液橙色加深的原因:_____ 。
(2)I中,溶液由橙色变为绿色的总反应的离子方程式是_____ 。
(3)Ⅱ中,继续滴入NaOH溶液后,又有气泡生成的原因是_____ 。
(4)Ⅱ中,继续滴入NaOH溶液后,预测有Cr(OH)3沉淀生成,但实验时未观察到。
提出假设:在碱性环境中,+3价铬元素被H2O2氧化。
①甲同学设计实验证明假设成立:
取少量I中的绿色溶液,在滴入NaOH溶液前增加一步操作:______ 。然后滴入NaOH溶液,有蓝灰色沉淀生成,继续滴入NaOH溶液,沉淀溶解,溶液变为______ 色。
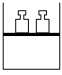
②乙同学进一步研究碱性环境对+3价铬元素的还原性或H2O2的氧化性的影响,设计如图实验。
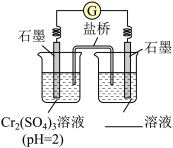
右侧烧杯的溶液中,氧化剂是_____ 。
开始时灵敏电流计指针不偏转,分别继续进行如下实验。
i.向左侧烧杯中滴入NaOH溶液,出现蓝灰色沉淀,继续缓慢滴入NaOH溶液,灵敏电流计指针向右偏转(电子从左向右运动),此时左侧的电极反应式为_____ 。
ii.向右侧烧杯中滴入NaOH溶液,有微小气泡生成,灵敏电流计指针向左偏转,左侧无明显变化。此时原电池中的总反应的化学方程式为_____ 。
(5)由上述实验, 与H2O2、
与H2O2、 与H2O2的氧化性强弱(填“>”或“<”):
与H2O2的氧化性强弱(填“>”或“<”):
酸性条件下,
_____ H2O2;碱性条件下, 
_____ H2O2。
资料:
i.含Cr元素的常见粒子:
 (橙色)、
(橙色)、 (黄色)、CrO5(溶于水,蓝紫色,不稳定)、Cr3+(绿色)、Cr(OH)3(蓝灰色,难溶于水,可溶于强酸、强碱)、
(黄色)、CrO5(溶于水,蓝紫色,不稳定)、Cr3+(绿色)、Cr(OH)3(蓝灰色,难溶于水,可溶于强酸、强碱)、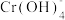 (亮绿色)。
(亮绿色)。ii.H2O2在碱性环境中比在酸性环境中分解速率快。
iii.在碱性环境中,O2不能氧化+3价铬元素。
实验操作及现象如表:
| 装置 | 步骤 | 操作 | 现象 |
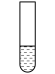 2mL0.0125mol•L-1K2Cr2O7溶液 | I | 先滴入稀硫酸至pH≈2,再滴入5滴5%H2O2溶液,振荡 | 溶液橙色加深。滴入H2O2溶液后迅速变为蓝紫色,有气泡生成。稍后,无明显气泡时,溶液由蓝紫色完全变为绿色 |
| Ⅱ | 继续缓慢滴入10滴2mol•L-1NaOH溶液,边滴,边振荡 | 又有气泡生成,溶液最终变为黄色 |
 (橙色)+H2O
(橙色)+H2O 2
2 (黄色)+2H+。请用化学平衡移动原理解释I中滴入稀硫酸后溶液橙色加深的原因:
(黄色)+2H+。请用化学平衡移动原理解释I中滴入稀硫酸后溶液橙色加深的原因:(2)I中,溶液由橙色变为绿色的总反应的离子方程式是
(3)Ⅱ中,继续滴入NaOH溶液后,又有气泡生成的原因是
(4)Ⅱ中,继续滴入NaOH溶液后,预测有Cr(OH)3沉淀生成,但实验时未观察到。
提出假设:在碱性环境中,+3价铬元素被H2O2氧化。
①甲同学设计实验证明假设成立:
取少量I中的绿色溶液,在滴入NaOH溶液前增加一步操作:
②乙同学进一步研究碱性环境对+3价铬元素的还原性或H2O2的氧化性的影响,设计如图实验。

右侧烧杯的溶液中,氧化剂是
开始时灵敏电流计指针不偏转,分别继续进行如下实验。
i.向左侧烧杯中滴入NaOH溶液,出现蓝灰色沉淀,继续缓慢滴入NaOH溶液,灵敏电流计指针向右偏转(电子从左向右运动),此时左侧的电极反应式为
ii.向右侧烧杯中滴入NaOH溶液,有微小气泡生成,灵敏电流计指针向左偏转,左侧无明显变化。此时原电池中的总反应的化学方程式为
(5)由上述实验,
 与H2O2、
与H2O2、 与H2O2的氧化性强弱(填“>”或“<”):
与H2O2的氧化性强弱(填“>”或“<”):酸性条件下,


您最近一年使用:0次
2023-01-07更新
|
406次组卷
|
4卷引用:北京市西城区2022-2023学年高二上学期1月期末考试化学试题
名校
解题方法
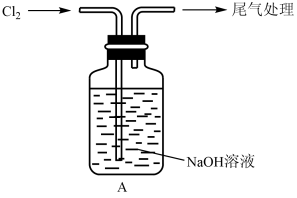
6 . 某小组利用氯气与NaOH制取NaClO并探究其性质。
资料:①Ag2SO4是白色固体,微溶于水。
②在Fe3+的水溶液中存在平衡:[Fe(H2O)4(OH)2]+(黄色)+2H+ [Fe(H2O)6]3+(淡紫色或无色)
[Fe(H2O)6]3+(淡紫色或无色)
I.制备
(1)A中反应的离子方程式是____ 。一段时间后,测得A中溶液pH=10。
II.探究性质
取I所得A中溶液5mL于试管中,向其中加入稍过量的0.1mol/LFeSO4溶液和适量H2SO4溶液,观察到无沉淀产生,溶液变为黄色。
(2)甲同学对溶液变黄色可能发生的反应提出下列三种猜想:.
猜想1:2Fe2++ClO-+2H+=2Fe3++C1-+H2O
猜想2:2Fe2++2ClO-+4H+=2Fe3++Cl2↑+2H2O
猜想3:Cl-+ClO-+2H+=Cl2↑+H2O
乙同学认为猜想2和3不合理,用离子方程式表示原因____ 。
经证实,猜想1正确。
III.进一步探究
取II中黄色溶液,分为4份,进行下列操作。
(3)实验i的现象是____ 。
(4)实验ii加入AgNO3出现白色沉淀,不能说明溶液中存在Cl-,原因是____ 。
(5)资料表明,氧化性:ClO->Br2>Fe3+>I2。甲同学认为由实验iii的现象证明溶液中仍存在ClO-。乙同学认为甲同学的推断不严谨,设计了能确证溶液中是否存在ClO-的实验方案:____ 。
(6)实验iv中黄色溶液变浅至几乎无色,用化学平衡移动原理解释原因____ 。
资料:①Ag2SO4是白色固体,微溶于水。
②在Fe3+的水溶液中存在平衡:[Fe(H2O)4(OH)2]+(黄色)+2H+
 [Fe(H2O)6]3+(淡紫色或无色)
[Fe(H2O)6]3+(淡紫色或无色)I.制备
(1)A中反应的离子方程式是

II.探究性质
取I所得A中溶液5mL于试管中,向其中加入稍过量的0.1mol/LFeSO4溶液和适量H2SO4溶液,观察到无沉淀产生,溶液变为黄色。
(2)甲同学对溶液变黄色可能发生的反应提出下列三种猜想:.
猜想1:2Fe2++ClO-+2H+=2Fe3++C1-+H2O
猜想2:2Fe2++2ClO-+4H+=2Fe3++Cl2↑+2H2O
猜想3:Cl-+ClO-+2H+=Cl2↑+H2O
乙同学认为猜想2和3不合理,用离子方程式表示原因
经证实,猜想1正确。
III.进一步探究
取II中黄色溶液,分为4份,进行下列操作。
| 序号 | 操作 | 现象 |
| i | 加入NaOH溶液 | |
| ii | 加入AgNO3溶液 | 白色沉淀 |
| iii | 加入NaI溶液,再加入一定量CCl4,振荡 | 下层呈紫红色 |
| iv | 加入一定量H2SO4溶液 | 黄色变浅几乎无色 |
(4)实验ii加入AgNO3出现白色沉淀,不能说明溶液中存在Cl-,原因是
(5)资料表明,氧化性:ClO->Br2>Fe3+>I2。甲同学认为由实验iii的现象证明溶液中仍存在ClO-。乙同学认为甲同学的推断不严谨,设计了能确证溶液中是否存在ClO-的实验方案:
(6)实验iv中黄色溶液变浅至几乎无色,用化学平衡移动原理解释原因
您最近一年使用:0次
名校
7 . 盐类的水解在生产生活中应用广泛
(1) 具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比
具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比 高效,且腐蚀性小。
高效,且腐蚀性小。 在溶液中分三步水解,请回答下列问题:
在溶液中分三步水解,请回答下列问题:






①以上水解反应的平衡常数 、
、 、
、 由大到小的顺序是
由大到小的顺序是_______ 。
②通过控制条件,以上水解产物聚合,生成聚合氯化铁,离子方程式为xFe3++yH2O⇌Fe (OH)
(OH) 。欲使平衡正向移动可采用的方法是
。欲使平衡正向移动可采用的方法是_______ (填标号)。
a.降温 b.加水稀释 c.加入 d.加入
d.加入
③室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是_______ 。
(2)现有常温下的0.1mol/L纯碱溶液。
①你认为该溶液呈碱性的原因是(用离子方程式表示)_______ 。为证明你的上述观点 ,请设计实验,简述实验操作,现象和结论:_______ 。
②同学甲认为该溶液中 的水解是微弱的,发生水解的
的水解是微弱的,发生水解的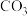 不超过其总量的10%,请你设计实验证明该同学的观点是否正确(忽略
不超过其总量的10%,请你设计实验证明该同学的观点是否正确(忽略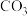 的第二步水解):
的第二步水解):_______ 。
(1)
 具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比
具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比 高效,且腐蚀性小。
高效,且腐蚀性小。 在溶液中分三步水解,请回答下列问题:
在溶液中分三步水解,请回答下列问题:





①以上水解反应的平衡常数
 、
、 、
、 由大到小的顺序是
由大到小的顺序是②通过控制条件,以上水解产物聚合,生成聚合氯化铁,离子方程式为xFe3++yH2O⇌Fe
 (OH)
(OH) 。欲使平衡正向移动可采用的方法是
。欲使平衡正向移动可采用的方法是a.降温 b.加水稀释 c.加入
 d.加入
d.加入
③室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是
(2)现有常温下的0.1mol/L纯碱溶液。
①你认为该溶液呈碱性的原因是(用离子方程式表示)
②同学甲认为该溶液中
 的水解是微弱的,发生水解的
的水解是微弱的,发生水解的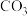 不超过其总量的10%,请你设计实验证明该同学的观点是否正确(忽略
不超过其总量的10%,请你设计实验证明该同学的观点是否正确(忽略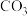 的第二步水解):
的第二步水解):
您最近一年使用:0次
2022-11-06更新
|
128次组卷
|
2卷引用:北京十四中2022-2023学年高二上学期期中检测化学试题
名校
解题方法
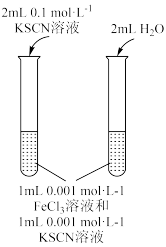
8 . 实验小组同学为探究Fe2+性质,进行如下实验。
【实验Ⅰ】向2mL 溶液滴中几滴
溶液滴中几滴 KSCN溶液,无明显现象,再滴加几滴3%
KSCN溶液,无明显现象,再滴加几滴3% 溶液(用
溶液(用 酸化至
酸化至 ),溶液颜色变红。
),溶液颜色变红。
(1)甲同学通过上述实验分析 具有
具有_______ (填“氧化”或“还原”)性。
乙同学查阅资料发现 与
与 可发生反应,生成无色的配合物。为证实该性质,利用进行如下实验。
可发生反应,生成无色的配合物。为证实该性质,利用进行如下实验。
(2) 的制备:用过量
的制备:用过量 溶液与
溶液与 溶液反应得到
溶液反应得到 ,离子方程式为
,离子方程式为_______ 。
【实验Ⅱ】验证 与
与 发生反应
发生反应_______ 。
(4)从沉淀溶解平衡角度解释实验a和b最终溶液颜色不同的原因是_______ 。
丙同学设计实验进一步证明 可与
可与 反应。
反应。
【实验Ⅲ】
①X为_______ 。
②实验能够证实 可与
可与 反应,则应观察到的现象是
反应,则应观察到的现象是_______ 。
(6)实验Ⅲ中若未加适量水稀释,则无法通过现象得出结论。推测加水稀释的目的可能有:使后续实验颜色变化易于观察;降低 ,
,_______ 。
【实验Ⅰ】向2mL
 溶液滴中几滴
溶液滴中几滴 KSCN溶液,无明显现象,再滴加几滴3%
KSCN溶液,无明显现象,再滴加几滴3% 溶液(用
溶液(用 酸化至
酸化至 ),溶液颜色变红。
),溶液颜色变红。(1)甲同学通过上述实验分析
 具有
具有乙同学查阅资料发现
 与
与 可发生反应,生成无色的配合物。为证实该性质,利用进行如下实验。
可发生反应,生成无色的配合物。为证实该性质,利用进行如下实验。(2)
 的制备:用过量
的制备:用过量 溶液与
溶液与 溶液反应得到
溶液反应得到 ,离子方程式为
,离子方程式为【实验Ⅱ】验证
 与
与 发生反应
发生反应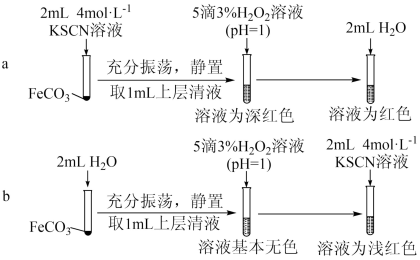
(4)从沉淀溶解平衡角度解释实验a和b最终溶液颜色不同的原因是
丙同学设计实验进一步证明
 可与
可与 反应。
反应。【实验Ⅲ】
①X为
②实验能够证实
 可与
可与 反应,则应观察到的现象是
反应,则应观察到的现象是(6)实验Ⅲ中若未加适量水稀释,则无法通过现象得出结论。推测加水稀释的目的可能有:使后续实验颜色变化易于观察;降低
 ,
,
您最近一年使用:0次
2022-05-30更新
|
1314次组卷
|
11卷引用:北京市育才学校2022届高三下学期三模化学试题
北京市育才学校2022届高三下学期三模化学试题北京市东城区2022届高三综合练习(二模)化学试题北京市一零一中学2022届高三三模化学试题(已下线)考点14 铁及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点53 化学实验方案设计与评价-备战2023年高考化学一轮复习考点帮(全国通用)北京市北京一零一中学2022-2023学年高三上学期统练7化学试题北京市第八十中学2022-2023学年高三上学期期末测试化学试题(已下线)考点14 铁及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)实验探究题北京师范大学附属中学预科部2023-2024学年高三上学期12月月考化学试题北京大学附属中学预科部2023-2024学年高三上学期12月阶段练习化学试题
9 . 下图所示的实验,不能 达到实验目的的是
| A | B | C | D |
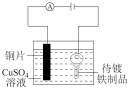 | 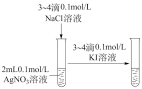 | 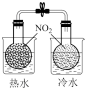 | 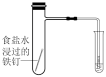 |
| 电镀铜 | 验证AgCl溶解度大于AgI | 证明温度对平衡的影响 | 验证铁发生吸氧腐蚀 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-01-14更新
|
229次组卷
|
4卷引用:北京市第三十五中学2022-2023学年高三上学期 10月月考化学试题
北京市第三十五中学2022-2023学年高三上学期 10月月考化学试题北京市丰台区2021-2022学年高三上学期期末考试化学试题(已下线)化学(上海C卷)-学易金卷:2023年高考第一次模拟考试卷北京市第一七一中学2021-2022学年高三下学期开学考试化学试卷
名校
10 . 根据如图实验操作和现象所得到的结论正确的是
| A | B | C | D |
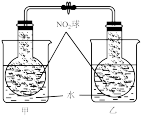 将  球浸泡在冷水和热水中 球浸泡在冷水和热水中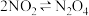  | 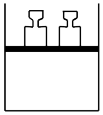  |   | 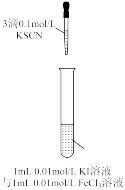 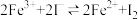 |
| 气体在热水中比在冷水中颜色浅 | 平衡体系加压后颜色先变深后变浅 | 研究浓度对化学平衡的影响 | 证明化学反应存在一定的限度 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次







