名校
1 . 小组同学探究盐溶液对反应 (血红色)的影响。将
(血红色)的影响。将
 的
的 溶液与
溶液与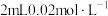 的
的 溶液混合,分别加入等量的试剂①~④,测得平衡后体系的透光率如下图所示。
溶液混合,分别加入等量的试剂①~④,测得平衡后体系的透光率如下图所示。
ii. (黄色)
(黄色)
iii.已知 对实验无影响
对实验无影响
下列说法不正确的是
 (血红色)的影响。将
(血红色)的影响。将
 的
的 溶液与
溶液与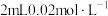 的
的 溶液混合,分别加入等量的试剂①~④,测得平衡后体系的透光率如下图所示。
溶液混合,分别加入等量的试剂①~④,测得平衡后体系的透光率如下图所示。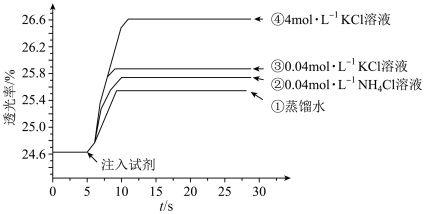
ii.
 (黄色)
(黄色)iii.已知
 对实验无影响
对实验无影响下列说法不正确的是
A.注入试剂①后溶液透光率增大,证明 逆向移动 逆向移动 |
B.透光率③比②高,可能是阳离子种类或溶液 不同导致的 不同导致的 |
C.透光率④比③高,可能发生了反应 |
D.若要证明试剂③中 对平衡体系有影响,还应使用 对平衡体系有影响,还应使用 的 的 溶液进行对照实验 溶液进行对照实验 |
您最近一年使用:0次
2023-11-21更新
|
362次组卷
|
7卷引用:北京市密云二中2023-2024学年高二上学期10月月考化学试卷
名校
2 . 某小组同学设计如下实验能证实反应2Fe3++2I-=2Fe2++I2为可逆反应。已知 是一种无色的稳定的络离子。
是一种无色的稳定的络离子。
下列说法不正确的是
 是一种无色的稳定的络离子。
是一种无色的稳定的络离子。| 实验装置 | 实验序号 | 实验操作和现象 |
 注:a、b均为石墨电极 | ① | ⅰ.闭合K,指针向右偏转 ⅱ.待指针归零,向U形管左管中加入1mol/LKI溶液,∙∙∙∙∙∙ |
| ② | ⅰ.闭合K,指针向右偏转 ⅱ.待指针归零,向U形管左管中滴加0.01mol/LAgNO3溶液,指针向左偏转。 |
| A.电流表指针归零,说明上述可逆反应达到了化学平衡状态 |
| B.①中加入KI溶液后,上述平衡向正反应方向移动,电流表指针向右偏转 |
| C.②中加入AgNO3溶液后,导致氧化性:Fe3+ >I2,上述平衡向逆反应方向移动 |
| D.②中电流表指针再次归零时,向U型管右管滴加饱和NH4F溶液,电流表指针向左偏转 |
您最近一年使用:0次
名校
解题方法
3 . 我国“十四五”规划提出要制定2030年前碳达峰行动方案,努力争取2060年前实现碳中和。为此,研发CO2转化利用技术成为重要科技目标。
Ⅰ.CH4还原CO2是实现“双碳”经济的有效途径之一,相关的主要反应有:
反应A:CH4(g)+CO2(g) 2CO(g) + 2H2(g) △H= +247kJmol
2CO(g) + 2H2(g) △H= +247kJmol
反应B:CO2(g)+ H2(g) CO(g) + H2O(g) △H= +41kJ/mol
CO(g) + H2O(g) △H= +41kJ/mol
(1)反应CH4(g)+ 3CO2(g) 4CO(g) + 2H2O(g)的△H=
4CO(g) + 2H2O(g)的△H=___________ kJ/mol。
(2)恒压、750℃时,CH4和CO2按物质的量之比1:3投料,反应经如下流程(主要产物已标出)可实现CO2高效转化为CO。假设各步均转化完全,下列说法正确的是___________ 。 (填字母序号)
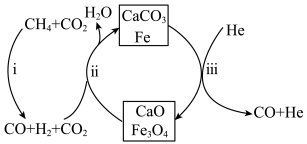
a.过程i和过程ii中均未发生氧化还原反应
b.过程ii中使用的催化剂为Fe和CaCO3
c.过程ⅱ,CaO吸收CO2可促使Fe3O4氧化CO反应的平衡正向移动
d.相比于反应A,该流程的总反应还原1molCO2需要吸收的能量更少
Ⅱ.用CO2制备甲醇可实现CO2的能源化利用,反应如下:
CO2(g) + 3H2(g) CH3OH(g)+ H2O(g) △H
CH3OH(g)+ H2O(g) △H
CO2(g) + H2(g) CO(g) + H2O(g) △H> 0
CO(g) + H2O(g) △H> 0
将反应气按进料比n(CO2):n(H2)=1:3通入反应装置,选择合适的催化剂,发生反应。
(3)不同温度和压强下,CH3OH平衡产率和CO2平衡转化率分别如图1、图2所示。
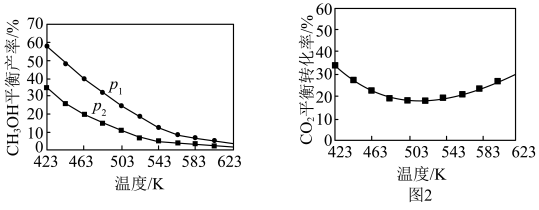
①图1中,压强p1___________ p2(填“>”、“="或“<”), 理由___________ 。
②图2中,压强为p2,温度高于503K后,CO2平衡转化率随温度升高而增大的原因是______ 。
(4)实际生产中,测得压强为p3时,相同时间内不同温度下的CH3OH产率如图3所示。523 K时,CH3OH产率最大,可能的原因是___________ (填序号)。
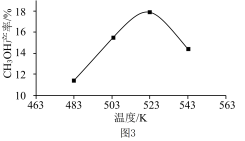
a.此条件下主反应限度最大 b.此条件下主反应速率最快 c.523 K时催化剂的活性最强
Ⅲ.以CO2为原料加氢还可以合成甲烷。
(5)在T℃时,将CO2和H2加入容积不变的密闭容器中,发生反应:CO2(g)+4H2(g) CH4(g)+2H2O(g)。能判断该反应达到平衡状态的是___________。
CH4(g)+2H2O(g)。能判断该反应达到平衡状态的是___________。
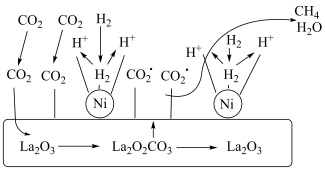
(6)CO2加氢制备CH4的一种催化机理如图,下列说法中正确的是___________。
Ⅰ.CH4还原CO2是实现“双碳”经济的有效途径之一,相关的主要反应有:
反应A:CH4(g)+CO2(g)
 2CO(g) + 2H2(g) △H= +247kJmol
2CO(g) + 2H2(g) △H= +247kJmol反应B:CO2(g)+ H2(g)
 CO(g) + H2O(g) △H= +41kJ/mol
CO(g) + H2O(g) △H= +41kJ/mol(1)反应CH4(g)+ 3CO2(g)
 4CO(g) + 2H2O(g)的△H=
4CO(g) + 2H2O(g)的△H=(2)恒压、750℃时,CH4和CO2按物质的量之比1:3投料,反应经如下流程(主要产物已标出)可实现CO2高效转化为CO。假设各步均转化完全,下列说法正确的是

a.过程i和过程ii中均未发生氧化还原反应
b.过程ii中使用的催化剂为Fe和CaCO3
c.过程ⅱ,CaO吸收CO2可促使Fe3O4氧化CO反应的平衡正向移动
d.相比于反应A,该流程的总反应还原1molCO2需要吸收的能量更少
Ⅱ.用CO2制备甲醇可实现CO2的能源化利用,反应如下:
CO2(g) + 3H2(g)
 CH3OH(g)+ H2O(g) △H
CH3OH(g)+ H2O(g) △HCO2(g) + H2(g)
 CO(g) + H2O(g) △H> 0
CO(g) + H2O(g) △H> 0将反应气按进料比n(CO2):n(H2)=1:3通入反应装置,选择合适的催化剂,发生反应。
(3)不同温度和压强下,CH3OH平衡产率和CO2平衡转化率分别如图1、图2所示。

①图1中,压强p1
②图2中,压强为p2,温度高于503K后,CO2平衡转化率随温度升高而增大的原因是
(4)实际生产中,测得压强为p3时,相同时间内不同温度下的CH3OH产率如图3所示。523 K时,CH3OH产率最大,可能的原因是

a.此条件下主反应限度最大 b.此条件下主反应速率最快 c.523 K时催化剂的活性最强
Ⅲ.以CO2为原料加氢还可以合成甲烷。
(5)在T℃时,将CO2和H2加入容积不变的密闭容器中,发生反应:CO2(g)+4H2(g)
 CH4(g)+2H2O(g)。能判断该反应达到平衡状态的是___________。
CH4(g)+2H2O(g)。能判断该反应达到平衡状态的是___________。| A.容器内气体压强不再发生变化 | B.CO2的消耗速率和CH4的生成速率相等 |
| C.混合气体的密度不再发生变化 | D.混合气体的平均相对分子质量不再发生变化 |
(6)CO2加氢制备CH4的一种催化机理如图,下列说法中正确的是___________。

| A.催化过程使用的催化剂为La2O3和La2O2CO3 |
| B.La2O2CO3可以释放出CO2* (活化分孔) |
| C.H2经过Ni活性中心断键裂解产生活化态H*的过程为放热过程 |
| D.CO2加氢制备CH4的过程需要La2O3和Ni共同完成 |
您最近一年使用:0次
名校
解题方法
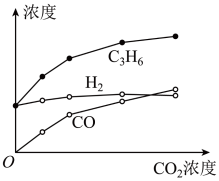
4 . 丙烷经催化脱氢可制丙烯:C3H8 C3H6+H2。600℃,将一定浓度的CO2与固定浓度的C3H8通过含催化剂的恒容反应器,经相同时间,流出的C3H6、CO和H2浓度随初始CO2浓度的变化关系如图。
C3H6+H2。600℃,将一定浓度的CO2与固定浓度的C3H8通过含催化剂的恒容反应器,经相同时间,流出的C3H6、CO和H2浓度随初始CO2浓度的变化关系如图。
已知:①C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) △H=-2202 kJ/mol
②C3H6(g)+ O2(g)=3CO2(g)+3H2O(l) △H= -2058 kJ/mol
O2(g)=3CO2(g)+3H2O(l) △H= -2058 kJ/mol
③H2(g)+ O2(g)=H2O(1) △H=-286 kJ/mol
O2(g)=H2O(1) △H=-286 kJ/mol
下列说法不正确的是
 C3H6+H2。600℃,将一定浓度的CO2与固定浓度的C3H8通过含催化剂的恒容反应器,经相同时间,流出的C3H6、CO和H2浓度随初始CO2浓度的变化关系如图。
C3H6+H2。600℃,将一定浓度的CO2与固定浓度的C3H8通过含催化剂的恒容反应器,经相同时间,流出的C3H6、CO和H2浓度随初始CO2浓度的变化关系如图。
已知:①C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) △H=-2202 kJ/mol
②C3H6(g)+
 O2(g)=3CO2(g)+3H2O(l) △H= -2058 kJ/mol
O2(g)=3CO2(g)+3H2O(l) △H= -2058 kJ/mol③H2(g)+
 O2(g)=H2O(1) △H=-286 kJ/mol
O2(g)=H2O(1) △H=-286 kJ/mol下列说法不正确的是
| A.C3H8(g)=C3H6(g)+H2(g) △H=+124 kJ/mol |
B.c(H2)和c(C3H6)变化差异的原因:CO2+H2 CO+H2O CO+H2O |
C.其他条件不变,投料比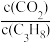 越大,C3H8转化率越大 越大,C3H8转化率越大 |
| D.若体系只有C3H6、CO、H2和H2O生成,则初始物质浓度c0与流出物质浓度c之间一定存在: 3c0(C3H8)+c0(CO2)=c(CO)+c(CO2)+3c(C3H6) |
您最近一年使用:0次
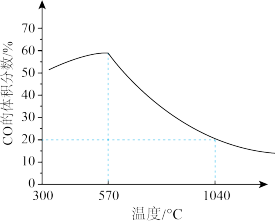
5 .  (s)与CO(g)主要发生如下反应。
(s)与CO(g)主要发生如下反应。
①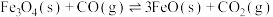
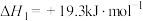
②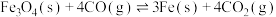

反应的还原产物与温度密切相关。其他条件一定, (s)和CO(g)反应达平衡时,CO(g)的体积分数随温度的变化关系如图所示。下列说法不正确的是
(s)和CO(g)反应达平衡时,CO(g)的体积分数随温度的变化关系如图所示。下列说法不正确的是
 (s)与CO(g)主要发生如下反应。
(s)与CO(g)主要发生如下反应。①
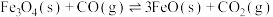
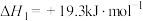
②
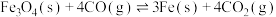

反应的还原产物与温度密切相关。其他条件一定,
 (s)和CO(g)反应达平衡时,CO(g)的体积分数随温度的变化关系如图所示。下列说法不正确的是
(s)和CO(g)反应达平衡时,CO(g)的体积分数随温度的变化关系如图所示。下列说法不正确的是
A.反应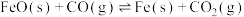 的焓变为 的焓变为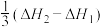 |
B.根据图象推测, 应当小于0 应当小于0 |
C.反应温度越高, 主要还原产物中铁元素的价态越低 主要还原产物中铁元素的价态越低 |
D.温度高于1040℃时, (s)和CO(g)发生的主要反应的化学平衡常数 (s)和CO(g)发生的主要反应的化学平衡常数 |
您最近一年使用:0次
2022-09-01更新
|
965次组卷
|
11卷引用:北京市密云二中2023-2024学年高二上学期10月月考化学试卷
北京市密云二中2023-2024学年高二上学期10月月考化学试卷 北京市海淀区2021-2022学年高三上学期期末考试化学试题四川省成都市第七中学2023届高三上学期零诊模拟考试化学试题河南省豫北名校2022-2023学年高二上学期10月教学质量检测化学试题北京市第二十中学2022-2023学年高二上学期期末考试化学试题广东省华南师范大学附属中学2022届高三下学期押题预测(一)化学试题安徽省六安第一中学2023-2024学年高二上学期期中考试化学试题北京市顺义牛栏山第一中学2023-2024学年高二上学期期中考试化学试题北京市第八十中学2024届高三上学期10月月考化学试题北京市育才学校2023-2024学年高三上学期11月期中考试化学试题北京市广渠门中学2023-2024学年高二上学期期中考试化学试题
名校
6 . 某MOFs多孔材料孔径大小和形状恰好将N2O4“固定”,能高选择性吸附NO2.废气中的NO2被吸附后,经处理能全部转化为HNO3.原理示意图如下。
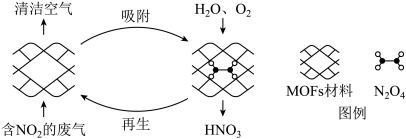
已知:N2O4(g) 2NO2(g)△H>0
2NO2(g)△H>0
下列说法不正确的是

已知:N2O4(g)
 2NO2(g)△H>0
2NO2(g)△H>0下列说法不正确的是
| A.温度升高时利于NO2吸附 |
B.多孔材料“固定”N2O4,促进2NO2(g) N2O4(g)平衡正向移动 N2O4(g)平衡正向移动 |
| C.转化为HNO3的反应是2N2O4+O2+2H2O=4HNO3 |
| D.每获得0.lmol HNO3时,转移电子的数目为6.02×1022 |
您最近一年使用:0次
名校
7 . 在恒容密闭容器中,放入镍粉并充入一定量的 气体,一定条件下发生反应:
气体,一定条件下发生反应: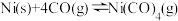 ,已知该反应平衡常数与温度的关系如表:
,已知该反应平衡常数与温度的关系如表:
下列说法不正确的是
 气体,一定条件下发生反应:
气体,一定条件下发生反应: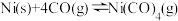 ,已知该反应平衡常数与温度的关系如表:
,已知该反应平衡常数与温度的关系如表:温度/ | 25 | 80 | 230 |
平衡常数/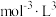 | 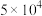 | 2 | 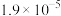 |
A.上述生成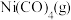 的反应为放热反应 的反应为放热反应 |
B.升高温度, 的平衡转化率减小 的平衡转化率减小 |
C. 时,反应 时,反应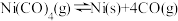 的平衡常数为 的平衡常数为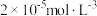 |
D. 时,测得 时,测得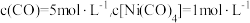 ,则反应达到平衡状态 ,则反应达到平衡状态 |
您最近一年使用:0次
2022-11-07更新
|
116次组卷
|
3卷引用:北京市密云二中2023-2024学年高二上学期10月月考化学试卷
名校
8 . 实验测得 溶液的
溶液的 、温度随时间变化的曲线如图所示,下列说法
、温度随时间变化的曲线如图所示,下列说法不正确 的是

 溶液的
溶液的 、温度随时间变化的曲线如图所示,下列说法
、温度随时间变化的曲线如图所示,下列说法
A.随温度升高,纯水中 |
B.随温度升高, 溶液的 溶液的 减小 减小 |
C.  溶液存在水解平衡: 溶液存在水解平衡: |
D.随温度升高, 溶液的 溶液的 变化是 变化是 改变与水解平衡移动共同作用的结果 改变与水解平衡移动共同作用的结果 |
您最近一年使用:0次
2022-11-04更新
|
327次组卷
|
6卷引用:北京市密云区第二中学2023-2024学年高二上学期期中(选考)化学试卷
北京市密云区第二中学2023-2024学年高二上学期期中(选考)化学试卷 北京市通州区2022-2023学年高二上学期期中考试化学试题 中国人民大学附属中学2022-2023学年高二上学期限时练习 2(12月考题)化学试题(已下线)第13讲 盐类的水解-【暑假自学课】2023年新高二化学暑假精品课(人教版2019选择性必修1)(已下线)T12-电解质溶液(已下线)选择题11-14
解题方法
9 . CO2是地球上取之不尽用之不竭的碳源,将CO2应用于生产中实现其综合利用是目前的研究热点。
(1)由CO2转化为羧酸是CO2资源化利用的重要方法。
I.在催化作用下由CO2和CH4转化为CH3COOH的反应历程示意图如图。
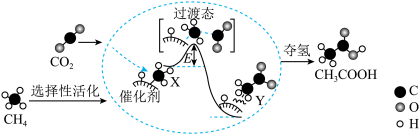
①在合成CH3COOH的反应历程中,下列有关说法正确的是_____ 。(填字母)
a.该催化剂使反应的平衡常数增大
b.CH4→CH3COOH过程中,有C—H键发生断裂
c.由X→Y过程中放出能量并形成了C—C键
②该条件下由CO2和CH4合成CH3COOH的化学方程式为_____ 。
II.电解法转化CO2制HCOOH的原理如图。
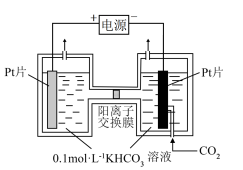
①写出阴极CO2还原为HCOO-的电极反应式:_____ 。
②电解一段时间后,阳极区的KHCO3溶液浓度降低,其原因是_____ 。
(2)由CO2合成甲醇是CO2资源化利用的重要方法。研究表明在催化剂作用下CO2和H2可发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH
CH3OH(g)+H2O(g) ΔH
①有利于提高合成CH3OH反应中CO2的平衡转化率的措施有_____ 。(填字母)
a.使用催化剂 b.加压 c.增大初始投料比
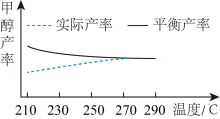
②研究温度对于甲醇产率的影响。在210℃~290℃保持原料气中CO2和H2的投料比不变,得到甲醇的实际产率、平衡产率与温度的关系如图所示。ΔH____ 0(填“>”或“<”),其依据是____ 。
(1)由CO2转化为羧酸是CO2资源化利用的重要方法。
I.在催化作用下由CO2和CH4转化为CH3COOH的反应历程示意图如图。

①在合成CH3COOH的反应历程中,下列有关说法正确的是
a.该催化剂使反应的平衡常数增大
b.CH4→CH3COOH过程中,有C—H键发生断裂
c.由X→Y过程中放出能量并形成了C—C键
②该条件下由CO2和CH4合成CH3COOH的化学方程式为
II.电解法转化CO2制HCOOH的原理如图。

①写出阴极CO2还原为HCOO-的电极反应式:
②电解一段时间后,阳极区的KHCO3溶液浓度降低,其原因是
(2)由CO2合成甲醇是CO2资源化利用的重要方法。研究表明在催化剂作用下CO2和H2可发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH
CH3OH(g)+H2O(g) ΔH①有利于提高合成CH3OH反应中CO2的平衡转化率的措施有
a.使用催化剂 b.加压 c.增大初始投料比

②研究温度对于甲醇产率的影响。在210℃~290℃保持原料气中CO2和H2的投料比不变,得到甲醇的实际产率、平衡产率与温度的关系如图所示。ΔH

您最近一年使用:0次
名校
10 . 我国科研人员提出了以Ni / Al2O3为催化剂,由CO2和H2转化为产品CH4的反应历程,其示意图如下:

下列说法不正确 的是

下列说法
A.总反应方程式为:CO2+4H2 CH4+2H2O CH4+2H2O |
| B.催化剂可有效提高反应物的平衡转化率 |
| C.在反应历程中,H―H键与C=O键断裂吸收能量 |
| D.反应过程中,催化剂参与反应,改变反应路径,降低反应的活化能 |
您最近一年使用:0次
2019-06-17更新
|
813次组卷
|
9卷引用:北京市密云二中2023-2024学年高二上学期10月月考化学试卷



