名校
1 . 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
CH3CH===CH2+CO+H2 CH3CH2CH2CHO
CH3CH2CH2CHO 1-丁醇
1-丁醇
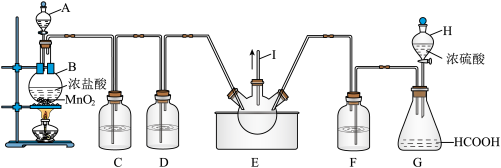
CO的制备原理:HCOOH CO↑+H2O,并设计出原料气的制备装置(如图)。
CO↑+H2O,并设计出原料气的制备装置(如图)。

请填写下列空白:
(1)1-丁醇的结构简式:______ ,HCOOH的名称______ ,浓硫酸在制备CO中体现的性质有____ (填“脱水性”、“吸水性”、“强氧化性”或“酸性”);
(2)若用图装置制备干燥纯净的CO,装置中a和b的作用分别是______ ,______ ;温度计的作用是_____________ ,分液漏斗、c和d中盛装的试剂分别是____ ,____ ,____ 。若用图装置制备H2,在虚线框内画出收集干燥H2的装置图______ ;
(3)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂(试剂足量)检验这四种气体,混合气体通过试剂的顺序是____________ (填序号);
①饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水 ④无水CuSO4 ⑤品红溶液
(4)合成正丁醛的反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是____________ ;
a.低温、高压、催化剂 b.适当的温度、高压、催化剂
c.常温、常压、催化剂 d.适当的温度、常压、催化剂
(5)正丁醛经催化加氢得到含少量正丁醛的1丁醇粗品。为纯化1丁醇,该小组查阅文献得知。①R—CHO+NaHSO3(饱和)→RCH(OH)SO3Na↓;②沸点:乙醚34 ℃,1丁醇118 ℃,并设计出如下提纯路线:



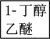


操作1为_______________ ,操作2______________ ,若利用图1装置中已有的仪器实现操作3,还必须增加的实验仪器有______________ 。
CH3CH===CH2+CO+H2
 CH3CH2CH2CHO
CH3CH2CH2CHO 1-丁醇
1-丁醇CO的制备原理:HCOOH
 CO↑+H2O,并设计出原料气的制备装置(如图)。
CO↑+H2O,并设计出原料气的制备装置(如图)。
请填写下列空白:
(1)1-丁醇的结构简式:
(2)若用图装置制备干燥纯净的CO,装置中a和b的作用分别是
(3)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂(试剂足量)检验这四种气体,混合气体通过试剂的顺序是
①饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水 ④无水CuSO4 ⑤品红溶液
(4)合成正丁醛的反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是
a.低温、高压、催化剂 b.适当的温度、高压、催化剂
c.常温、常压、催化剂 d.适当的温度、常压、催化剂
(5)正丁醛经催化加氢得到含少量正丁醛的1丁醇粗品。为纯化1丁醇,该小组查阅文献得知。①R—CHO+NaHSO3(饱和)→RCH(OH)SO3Na↓;②沸点:乙醚34 ℃,1丁醇118 ℃,并设计出如下提纯路线:


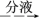

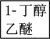


操作1为
您最近一年使用:0次
解题方法
2 . 以煤为原料,经由甲醇可制取甲醚,也可以制取烯烃并可以此取代传统的以石油为原料制取烯烃的路线。
(1)已知:在25℃和101kPa条件下,甲醇的燃烧热为-726.5 ,乙烯的燃烧热为-1411
,乙烯的燃烧热为-1411  ,
,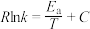 (
( 为活化能,R、C为常数,k为平衡常数)。则:
为活化能,R、C为常数,k为平衡常数)。则:
① 脱水生成
脱水生成 的热化学方程式是
的热化学方程式是___________ ,该反应自发进行的条件是___________ (填“较低”、“较高”或“任意”)温度。
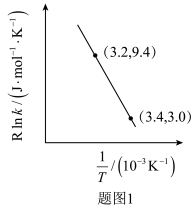
②甲醇脱水生成乙烯的温度与平衡常数的实验数据图如图1所示,该反应的正反应的活化能为___________  。
。
(2)以煤为原料气化产生的原料气可以用来合成 和
和 ,合成气平衡转化率随氢碳比 (
,合成气平衡转化率随氢碳比 (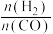 )的变化如图2所示:甲醇制取烃的过程中,会发生多种反应,可以生成
)的变化如图2所示:甲醇制取烃的过程中,会发生多种反应,可以生成 、
、 、
、 等,一定条件下,测得各烃的质量分数、
等,一定条件下,测得各烃的质量分数、 转化率随温度变化情况如图3所示。
转化率随温度变化情况如图3所示。
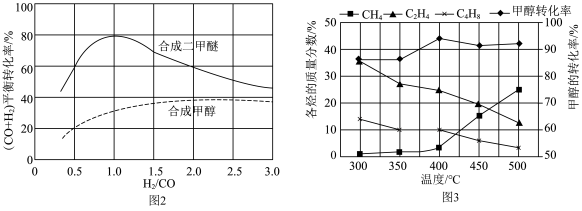
①下列叙述不正确 的是___________ 。
A.合成 的最佳氢碳比为1.0
的最佳氢碳比为1.0
B.甲醇制取烃的过程中,相同条件下,温度越高越有利于 的生成
的生成
C.甲醇制取乙烯的过程中,一般控制在350℃~400℃比较合适
D.甲醇制取烃的过程中, 的平衡转化率随温度升高先增大后减少
的平衡转化率随温度升高先增大后减少
②原料气合成 、
、 过程有如下反应发生:
过程有如下反应发生:
反应Ⅰ
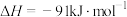
反应Ⅱ

反应Ⅲ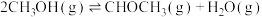

图2中原料气合成 的转化率高于
的转化率高于 的原因
的原因___________ 。
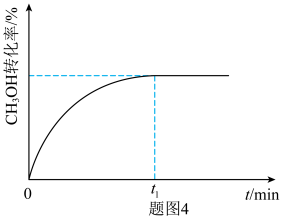
③在350℃,1MPa下,甲醇制取乙烯的转化率随时间的变化曲线如图4所示( 为该条件下的平衡时刻)。画出在相同条件下,向容器中添加氮气作稀释剂时甲醇的转化率随时间的变化曲线。
为该条件下的平衡时刻)。画出在相同条件下,向容器中添加氮气作稀释剂时甲醇的转化率随时间的变化曲线。_________
(1)已知:在25℃和101kPa条件下,甲醇的燃烧热为-726.5
 ,乙烯的燃烧热为-1411
,乙烯的燃烧热为-1411  ,
,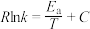 (
( 为活化能,R、C为常数,k为平衡常数)。则:
为活化能,R、C为常数,k为平衡常数)。则:①
 脱水生成
脱水生成 的热化学方程式是
的热化学方程式是②甲醇脱水生成乙烯的温度与平衡常数的实验数据图如图1所示,该反应的正反应的活化能为
 。
。
(2)以煤为原料气化产生的原料气可以用来合成
 和
和 ,合成气平衡转化率随氢碳比 (
,合成气平衡转化率随氢碳比 (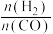 )的变化如图2所示:甲醇制取烃的过程中,会发生多种反应,可以生成
)的变化如图2所示:甲醇制取烃的过程中,会发生多种反应,可以生成 、
、 、
、 等,一定条件下,测得各烃的质量分数、
等,一定条件下,测得各烃的质量分数、 转化率随温度变化情况如图3所示。
转化率随温度变化情况如图3所示。
①下列叙述
A.合成
 的最佳氢碳比为1.0
的最佳氢碳比为1.0B.甲醇制取烃的过程中,相同条件下,温度越高越有利于
 的生成
的生成C.甲醇制取乙烯的过程中,一般控制在350℃~400℃比较合适
D.甲醇制取烃的过程中,
 的平衡转化率随温度升高先增大后减少
的平衡转化率随温度升高先增大后减少②原料气合成
 、
、 过程有如下反应发生:
过程有如下反应发生:反应Ⅰ

反应Ⅱ


反应Ⅲ
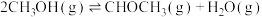

图2中原料气合成
 的转化率高于
的转化率高于 的原因
的原因③在350℃,1MPa下,甲醇制取乙烯的转化率随时间的变化曲线如图4所示(
 为该条件下的平衡时刻)。画出在相同条件下,向容器中添加氮气作稀释剂时甲醇的转化率随时间的变化曲线。
为该条件下的平衡时刻)。画出在相同条件下,向容器中添加氮气作稀释剂时甲醇的转化率随时间的变化曲线。
您最近一年使用:0次
名校
3 . 碳达峰是指我国承诺2030年前,二氧化碳的排放不再增长。因此,诸多科学家都在大力研合理利用 和CO以减少碳的排放。
和CO以减少碳的排放。
(1) 可通过以下4种方式转化成有机物,从而有效实现碳循环。
可通过以下4种方式转化成有机物,从而有效实现碳循环。
a.
b.
c.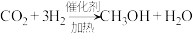
已知: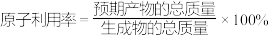
以上反应中,最环保节能的是_______ ,原子利用率最高的是_______ 。(填编号)
(2)我国科学家设计出一条仅11步的工业合成路线,实现了 到淀粉的合成。其第一步是把
到淀粉的合成。其第一步是把 还原为甲醇(
还原为甲醇( ),该方法的化学方程式是:
),该方法的化学方程式是:
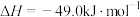 。回答下列问题:
。回答下列问题:
①能说明该反应已达平衡状态的是_______ (填字母)。
A.单位时间内生成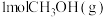 的同时消耗了
的同时消耗了
B.在恒温恒容的容器中,混合气体的平均摩尔质量保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒压的容器中,混合气体的密度不再变化
②该反应正逆反应的活化能大小为:Ea(正)_______ Ea(逆)(填“>”、“=”或“<”)
(3)利用CO高温时与磷石膏(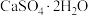 )反应,可减少CO的排放,又可以实现硫酸盐资源的再利用。已知该反应的产物与温度有关。
)反应,可减少CO的排放,又可以实现硫酸盐资源的再利用。已知该反应的产物与温度有关。
①在700℃时,主要的还原产物是一种硫的最低价盐,该物质为_______ (填化学式)。
②在1150℃时,向盛有足量 的真空恒容密闭容器中充入一定量CO,反应体系起始压强为
的真空恒容密闭容器中充入一定量CO,反应体系起始压强为 ,主要发生反应:
,主要发生反应: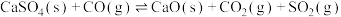 。该反应达到平衡时,
。该反应达到平衡时,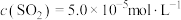 ,CO的转化率为50%,则初始时
,CO的转化率为50%,则初始时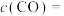
_______ mol/L,该反应的压强平衡常数
_______ MPa(忽略副反应;气体分压=总压×气体物质的量分数)。
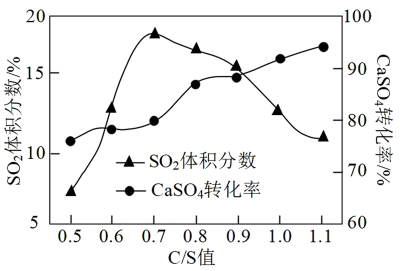
(4)工业上也可用炭粉还原磷石膏,该反应的产物与C/S值(炭粉与 的物质的量之比)有关。向密闭容器中加入几组不同C/S值的炭粉与磷石膏的混合物,1100℃煅烧至无气体产生,结果如图所示。当C/S值为0.5时,反应产物主要为CaO、
的物质的量之比)有关。向密闭容器中加入几组不同C/S值的炭粉与磷石膏的混合物,1100℃煅烧至无气体产生,结果如图所示。当C/S值为0.5时,反应产物主要为CaO、 和
和 ;当C/S值大于0.7时,反应所得气体中
;当C/S值大于0.7时,反应所得气体中 的体积分数下降,可能的原因是
的体积分数下降,可能的原因是_______ 。
 和CO以减少碳的排放。
和CO以减少碳的排放。(1)
 可通过以下4种方式转化成有机物,从而有效实现碳循环。
可通过以下4种方式转化成有机物,从而有效实现碳循环。a.

b.

c.
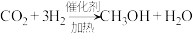
已知:
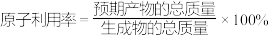
以上反应中,最环保节能的是
(2)我国科学家设计出一条仅11步的工业合成路线,实现了
 到淀粉的合成。其第一步是把
到淀粉的合成。其第一步是把 还原为甲醇(
还原为甲醇( ),该方法的化学方程式是:
),该方法的化学方程式是:
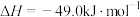 。回答下列问题:
。回答下列问题:①能说明该反应已达平衡状态的是
A.单位时间内生成
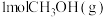 的同时消耗了
的同时消耗了
B.在恒温恒容的容器中,混合气体的平均摩尔质量保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒压的容器中,混合气体的密度不再变化
②该反应正逆反应的活化能大小为:Ea(正)
(3)利用CO高温时与磷石膏(
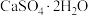 )反应,可减少CO的排放,又可以实现硫酸盐资源的再利用。已知该反应的产物与温度有关。
)反应,可减少CO的排放,又可以实现硫酸盐资源的再利用。已知该反应的产物与温度有关。①在700℃时,主要的还原产物是一种硫的最低价盐,该物质为
②在1150℃时,向盛有足量
 的真空恒容密闭容器中充入一定量CO,反应体系起始压强为
的真空恒容密闭容器中充入一定量CO,反应体系起始压强为 ,主要发生反应:
,主要发生反应: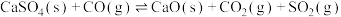 。该反应达到平衡时,
。该反应达到平衡时,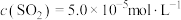 ,CO的转化率为50%,则初始时
,CO的转化率为50%,则初始时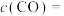

(4)工业上也可用炭粉还原磷石膏,该反应的产物与C/S值(炭粉与
 的物质的量之比)有关。向密闭容器中加入几组不同C/S值的炭粉与磷石膏的混合物,1100℃煅烧至无气体产生,结果如图所示。当C/S值为0.5时,反应产物主要为CaO、
的物质的量之比)有关。向密闭容器中加入几组不同C/S值的炭粉与磷石膏的混合物,1100℃煅烧至无气体产生,结果如图所示。当C/S值为0.5时,反应产物主要为CaO、 和
和 ;当C/S值大于0.7时,反应所得气体中
;当C/S值大于0.7时,反应所得气体中 的体积分数下降,可能的原因是
的体积分数下降,可能的原因是
您最近一年使用:0次
2022-09-21更新
|
142次组卷
|
2卷引用:四川省蓬溪中学校2023-2024学年高二上学期开学考试化学试题
名校
4 . 我国力争于2030年前做到碳达峰、2060年前实现碳中和,体现了中国对解决气候问题的担当。 是目前大气中含量最高的一种温室气体。减弱温室效应的方法之一是将
是目前大气中含量最高的一种温室气体。减弱温室效应的方法之一是将 回收利用,科学家研究利用回收的
回收利用,科学家研究利用回收的 制取甲醛
制取甲醛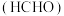 。请回答下列问题:
。请回答下列问题:
(1)已知:①

②
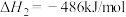
写出 和
和 合成甲醛和水蒸气的热化学方程式
合成甲醛和水蒸气的热化学方程式_______ 。
(2)一定条件下,将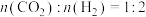 的混合气体充入恒温恒容的密闭容器中,发生反应
的混合气体充入恒温恒容的密闭容器中,发生反应 。下列说明反应已经达到平衡状态的是
。下列说明反应已经达到平衡状态的是_______ (填字母)。
a.混合气体的平均相对分子质量不变 b.该反应的平衡常数保持不变
c. 的体积分数保持不变 d.容器内气体密度保持不变
的体积分数保持不变 d.容器内气体密度保持不变
(3)在一定条件下,在容积恒定为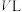 的密闭容器中充入
的密闭容器中充入 与
与 在催化剂作用下合成甲醇:
在催化剂作用下合成甲醇: 。
。 转化率与温度、压强的关系如图所示:
转化率与温度、压强的关系如图所示:

①
_______ (填“<”“>”或“=”) 。该反应是
。该反应是_______ (填“吸”或“放”)热反应。
②图中b、c、d三点的化学平衡常数为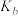 、
、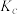 、
、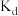 ,从大到小的顺序为
,从大到小的顺序为_______ 。
③电解法制氢气。科研小组设计如图所示电解池,利用 和
和 在碱性电解液中制备水煤气(
在碱性电解液中制备水煤气( 、
、 ),产物中
),产物中 和
和 物质的量之比为
物质的量之比为 。电极B是
。电极B是_______ 极

 是目前大气中含量最高的一种温室气体。减弱温室效应的方法之一是将
是目前大气中含量最高的一种温室气体。减弱温室效应的方法之一是将 回收利用,科学家研究利用回收的
回收利用,科学家研究利用回收的 制取甲醛
制取甲醛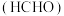 。请回答下列问题:
。请回答下列问题:(1)已知:①


②

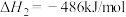
写出
 和
和 合成甲醛和水蒸气的热化学方程式
合成甲醛和水蒸气的热化学方程式(2)一定条件下,将
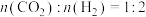 的混合气体充入恒温恒容的密闭容器中,发生反应
的混合气体充入恒温恒容的密闭容器中,发生反应 。下列说明反应已经达到平衡状态的是
。下列说明反应已经达到平衡状态的是a.混合气体的平均相对分子质量不变 b.该反应的平衡常数保持不变
c.
 的体积分数保持不变 d.容器内气体密度保持不变
的体积分数保持不变 d.容器内气体密度保持不变(3)在一定条件下,在容积恒定为
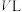 的密闭容器中充入
的密闭容器中充入 与
与 在催化剂作用下合成甲醇:
在催化剂作用下合成甲醇: 。
。 转化率与温度、压强的关系如图所示:
转化率与温度、压强的关系如图所示:
①

 。该反应是
。该反应是②图中b、c、d三点的化学平衡常数为
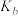 、
、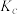 、
、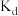 ,从大到小的顺序为
,从大到小的顺序为③电解法制氢气。科研小组设计如图所示电解池,利用
 和
和 在碱性电解液中制备水煤气(
在碱性电解液中制备水煤气( 、
、 ),产物中
),产物中 和
和 物质的量之比为
物质的量之比为 。电极B是
。电极B是
您最近一年使用:0次
名校
解题方法
5 . 工业上大规模制氢气会产生大量的CO,为探索将碳固定在化工产品中而不是作为燃料直接使用的方案,某同学在实验室里利用 和CO合成光气(
和CO合成光气( ,一种重要的有机合成中间体)并进行相关检测。(已知:
,一种重要的有机合成中间体)并进行相关检测。(已知: 的熔点为-118℃,沸点为8.2℃,遇水极易反应产生HCl及
的熔点为-118℃,沸点为8.2℃,遇水极易反应产生HCl及 。)
。)
实验室制备光气的装置如图所示:
(1)仪器A在使用前需要进行的操作是______ 。
(2)饱和NaCl溶液可除去 中的杂质气体HCl。应将饱和NaCl溶液盛放于洗气瓶
中的杂质气体HCl。应将饱和NaCl溶液盛放于洗气瓶______ (填“C”或“D”)中。
(3)E处加热装置需要维持在210℃左右,则应使用______ (填“水浴”或“沙浴”)对三颈烧瓶进行加热。
(4)如何快速简便地分离Ⅰ处逸出的混合气体中的 ?
?____________ 。
(5)G处发生甲酸分解反应: 。在实验过程中,只需在实验开始时将H中的部分浓硫酸快速滴加到G中,并不需要额外的加热装置,请解释原因
。在实验过程中,只需在实验开始时将H中的部分浓硫酸快速滴加到G中,并不需要额外的加热装置,请解释原因______________ 。
(6)轻轻摇动G装置,发现F中产生气泡的速率有所加快,请解释原因_______________ 。
(7)某同学用以下仪器设计了一个实验装置,实现CO与CuO的反应并检验气体产物,用字母表示其合理的连接顺序______ 。

 和CO合成光气(
和CO合成光气( ,一种重要的有机合成中间体)并进行相关检测。(已知:
,一种重要的有机合成中间体)并进行相关检测。(已知: 的熔点为-118℃,沸点为8.2℃,遇水极易反应产生HCl及
的熔点为-118℃,沸点为8.2℃,遇水极易反应产生HCl及 。)
。)实验室制备光气的装置如图所示:

(1)仪器A在使用前需要进行的操作是
(2)饱和NaCl溶液可除去
 中的杂质气体HCl。应将饱和NaCl溶液盛放于洗气瓶
中的杂质气体HCl。应将饱和NaCl溶液盛放于洗气瓶(3)E处加热装置需要维持在210℃左右,则应使用
(4)如何快速简便地分离Ⅰ处逸出的混合气体中的
 ?
?(5)G处发生甲酸分解反应:
 。在实验过程中,只需在实验开始时将H中的部分浓硫酸快速滴加到G中,并不需要额外的加热装置,请解释原因
。在实验过程中,只需在实验开始时将H中的部分浓硫酸快速滴加到G中,并不需要额外的加热装置,请解释原因(6)轻轻摇动G装置,发现F中产生气泡的速率有所加快,请解释原因
(7)某同学用以下仪器设计了一个实验装置,实现CO与CuO的反应并检验气体产物,用字母表示其合理的连接顺序

您最近一年使用:0次
2023-04-04更新
|
309次组卷
|
2卷引用:山东省青岛第二中学等两校2022-2023学年高一上学期自主招生化学试题
名校
6 . 以CO2为原料合成甲醇可以减少CO2的排放,实现碳的循环利用。一种Cu/ZnO 催化剂对该反应有良好的催化效果。
I.催化剂的合成
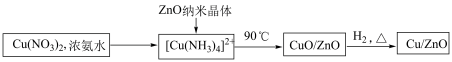
(1)氨水与Cu(NO3)2的反应___________ (填“属于”或“不属于”)氧化还原反应。
(2)补全上述过程中生成CuO 的离子方程式:___________
[Cu(NH3)4]2++H2O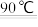 CuO↓+
CuO↓+
Ⅱ.催化剂的性能测试
一定条件下使 CO₂、H₂混合气体通过反应器,检测反应器出口气体的成分及其含量,计算CO2的转化率和CH₃OH的选择性以评价催化剂的性能。
已知:i. 反应器内发生的反应有:
ii. CH₃OH选择性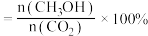
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.5kJ/mol
CH3OH(g)+H2O(g) ΔH=-49.5kJ/mol
CO2(g)+H2(g) CO(g)+H2O(g) ΔH=+41.2kJ/mol
CO(g)+H2O(g) ΔH=+41.2kJ/mol
(3)220℃时,测得反应器出口气体中全部含碳物质的物质的量之比n(CH3OH):n(CO2):n(CO)=1:7.20:0.11,则该温度下CO2转化率=___________ ×100%(列出计算式)。
(4)其他条件相同时,反应温度对CO2的转化率和 CH3OH的选择性的影响如下图所示:

①由图1可知实验中反应均未达到化学平衡状态的依据是___________
②温度高于260℃时,CO2平衡转化率变化的原因是___________
③温度相同时,CH3OH选择性的实验值略高于其平衡值(见图2),从化学反应速率的角度解释原因:___________ 。
I.催化剂的合成

(1)氨水与Cu(NO3)2的反应
(2)补全上述过程中生成CuO 的离子方程式:
[Cu(NH3)4]2++H2O
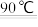 CuO↓+
CuO↓+Ⅱ.催化剂的性能测试
一定条件下使 CO₂、H₂混合气体通过反应器,检测反应器出口气体的成分及其含量,计算CO2的转化率和CH₃OH的选择性以评价催化剂的性能。
已知:i. 反应器内发生的反应有:
ii. CH₃OH选择性
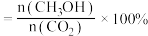
CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH=-49.5kJ/mol
CH3OH(g)+H2O(g) ΔH=-49.5kJ/molCO2(g)+H2(g)
 CO(g)+H2O(g) ΔH=+41.2kJ/mol
CO(g)+H2O(g) ΔH=+41.2kJ/mol(3)220℃时,测得反应器出口气体中全部含碳物质的物质的量之比n(CH3OH):n(CO2):n(CO)=1:7.20:0.11,则该温度下CO2转化率=
(4)其他条件相同时,反应温度对CO2的转化率和 CH3OH的选择性的影响如下图所示:

①由图1可知实验中反应均未达到化学平衡状态的依据是
②温度高于260℃时,CO2平衡转化率变化的原因是
③温度相同时,CH3OH选择性的实验值略高于其平衡值(见图2),从化学反应速率的角度解释原因:
您最近一年使用:0次
2023-10-24更新
|
240次组卷
|
2卷引用:北京市通州区潞河中学2021-2022学年高三下学期开学考试化学试卷
解题方法
7 .  是合成荧光粉、光导体等的重要原料,
是合成荧光粉、光导体等的重要原料, 的开发与利用是科学界研究的热点。回答下列问题:
的开发与利用是科学界研究的热点。回答下列问题:
(1)已知: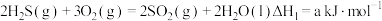 ,
,  ,则空气氧化脱除
,则空气氧化脱除 反应
反应 的
的
___________  。
。
(2)工业上可通过羰基硫(COS)与水蒸气在一定条件下反应制备 ,反应的原理为
,反应的原理为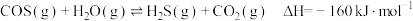 。
。
①T℃时,采用适当的催化剂在密闭容器中将等物质的量的 和
和 混合发生反应,已知该条件下该反应的平衡常数
混合发生反应,已知该条件下该反应的平衡常数 ,则平衡时体系中
,则平衡时体系中 的物质的量分数可能为
的物质的量分数可能为___________ (填字母)
A.0.52 B.0.40 C.0.30 D.0.20
②图甲表示在两个相同的密闭容器中,反应物起始浓度相同,在相同质量不同型号的催化剂催化下,反应相同时间段时 的转化率与温度的关系,则
的转化率与温度的关系,则 的平衡转化率
的平衡转化率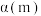
___________ 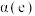 (填“
(填“ ”“
”“ ”或“
”或“ ”);q点时,
”);q点时, 转化率出现突变的原因可能是
转化率出现突变的原因可能是___________ 。

③一定条件下进行该反应,测得 的平衡转化率与起始投料比
的平衡转化率与起始投料比 的关系如图所示,图中各点对应的反应温度可能相同,也可能不相同,图中c点时反应的平衡常数
的关系如图所示,图中各点对应的反应温度可能相同,也可能不相同,图中c点时反应的平衡常数
___________ ,图中与c点的反应温度相同的点有___________ (填字母),若图中a、e两点对应的反应温度分别为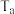 和
和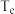 ,则
,则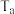
___________ 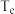 (填“
(填“ ”“
”“ ”或“
”或“ ”)。
”)。

(3)如图所示,质子固体电解质膜 燃料电池可对
燃料电池可对 废气进行资源化利用。
废气进行资源化利用。

电极a的电极反应式为___________ 。
 是合成荧光粉、光导体等的重要原料,
是合成荧光粉、光导体等的重要原料, 的开发与利用是科学界研究的热点。回答下列问题:
的开发与利用是科学界研究的热点。回答下列问题:(1)已知:
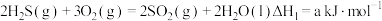 ,
,  ,则空气氧化脱除
,则空气氧化脱除 反应
反应 的
的
 。
。(2)工业上可通过羰基硫(COS)与水蒸气在一定条件下反应制备
 ,反应的原理为
,反应的原理为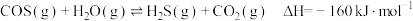 。
。①T℃时,采用适当的催化剂在密闭容器中将等物质的量的
 和
和 混合发生反应,已知该条件下该反应的平衡常数
混合发生反应,已知该条件下该反应的平衡常数 ,则平衡时体系中
,则平衡时体系中 的物质的量分数可能为
的物质的量分数可能为A.0.52 B.0.40 C.0.30 D.0.20
②图甲表示在两个相同的密闭容器中,反应物起始浓度相同,在相同质量不同型号的催化剂催化下,反应相同时间段时
 的转化率与温度的关系,则
的转化率与温度的关系,则 的平衡转化率
的平衡转化率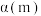
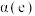 (填“
(填“ ”“
”“ ”或“
”或“ ”);q点时,
”);q点时, 转化率出现突变的原因可能是
转化率出现突变的原因可能是
③一定条件下进行该反应,测得
 的平衡转化率与起始投料比
的平衡转化率与起始投料比 的关系如图所示,图中各点对应的反应温度可能相同,也可能不相同,图中c点时反应的平衡常数
的关系如图所示,图中各点对应的反应温度可能相同,也可能不相同,图中c点时反应的平衡常数
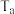 和
和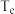 ,则
,则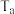
 (填“
(填“ ”“
”“ ”或“
”或“ ”)。
”)。
(3)如图所示,质子固体电解质膜
 燃料电池可对
燃料电池可对 废气进行资源化利用。
废气进行资源化利用。
电极a的电极反应式为
您最近一年使用:0次
8 . CO一直是化学家研究的热点载体,也是一种重要的化工产品。回答下列问题:
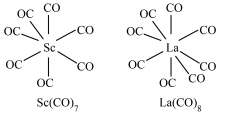
(1)我国科学家发现七配位金属羰基化合物 和八配位金属羰基化合物
和八配位金属羰基化合物 (TM=Y、La),为设计具有独特性质的化合物提供了新思路。它们的结构如图所示,CO作配体,配位原子为C,而不是O,其原因是
(TM=Y、La),为设计具有独特性质的化合物提供了新思路。它们的结构如图所示,CO作配体,配位原子为C,而不是O,其原因是___________ , 含
含___________  键。
键。
(2)工业上用CO合成 :
:
 。
。
①该反应在较低温度下能自发进行,推测该反应是___________ (填标号)
A.熵增、焓减反应 C.熵减、焓增反应
B.熵增、焓增反应 D.熵减、焓减反应
②一定温度下,向一恒容密闭容器中充入1molCO和 ,下列情况表明净反应速率(净反应速率等于正、逆反应速率之差)一定等于0的是
,下列情况表明净反应速率(净反应速率等于正、逆反应速率之差)一定等于0的是___________ (填标号)。
A.混合气体密度不随时间变化
B.混合气体中CO的体积分数不随时间变化
C.混合气体总压强不随时间变化
D. 的正反应速率等于
的正反应速率等于 的逆反应速率的3倍
的逆反应速率的3倍
(3)工业上常用天然气制备CO,原理如下:
①

②

则

___________ 。(用含 、
、 的代数式表示)
的代数式表示)
(4)光气 (COCl2)是一种有机中间体,常用于合成杀虫剂、黏合剂。CO合成光气的原理是
 。在甲、乙起始体积均为2L的密闭容器中均分别投入2molCO和
。在甲、乙起始体积均为2L的密闭容器中均分别投入2molCO和 ,在不同条件下发生上述反应,测得
,在不同条件下发生上述反应,测得 与时间关系如图所示。
与时间关系如图所示。
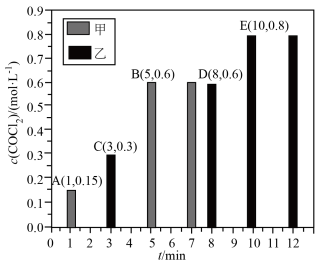
①相对甲,乙仅改变一个条件,可能是___________ (填标号)。
a.减小压强 b.加催化剂 c.降低温度
②若在恒容条件下反应,前10min内乙容器中CO的平均反应速率为___________  。甲容器中CO的平衡转化率为
。甲容器中CO的平衡转化率为___________ 。乙容器中平衡常数K为___________  。
。
(1)我国科学家发现七配位金属羰基化合物
 和八配位金属羰基化合物
和八配位金属羰基化合物 (TM=Y、La),为设计具有独特性质的化合物提供了新思路。它们的结构如图所示,CO作配体,配位原子为C,而不是O,其原因是
(TM=Y、La),为设计具有独特性质的化合物提供了新思路。它们的结构如图所示,CO作配体,配位原子为C,而不是O,其原因是 含
含 键。
键。
(2)工业上用CO合成
 :
:
 。
。①该反应在较低温度下能自发进行,推测该反应是
A.熵增、焓减反应 C.熵减、焓增反应
B.熵增、焓增反应 D.熵减、焓减反应
②一定温度下,向一恒容密闭容器中充入1molCO和
 ,下列情况表明净反应速率(净反应速率等于正、逆反应速率之差)一定等于0的是
,下列情况表明净反应速率(净反应速率等于正、逆反应速率之差)一定等于0的是A.混合气体密度不随时间变化
B.混合气体中CO的体积分数不随时间变化
C.混合气体总压强不随时间变化
D.
 的正反应速率等于
的正反应速率等于 的逆反应速率的3倍
的逆反应速率的3倍(3)工业上常用天然气制备CO,原理如下:
①


②


则


 、
、 的代数式表示)
的代数式表示)(4)光气 (COCl2)是一种有机中间体,常用于合成杀虫剂、黏合剂。CO合成光气的原理是

 。在甲、乙起始体积均为2L的密闭容器中均分别投入2molCO和
。在甲、乙起始体积均为2L的密闭容器中均分别投入2molCO和 ,在不同条件下发生上述反应,测得
,在不同条件下发生上述反应,测得 与时间关系如图所示。
与时间关系如图所示。
①相对甲,乙仅改变一个条件,可能是
a.减小压强 b.加催化剂 c.降低温度
②若在恒容条件下反应,前10min内乙容器中CO的平均反应速率为
 。甲容器中CO的平衡转化率为
。甲容器中CO的平衡转化率为 。
。
您最近一年使用:0次
名校
9 . 正丁烷除可直接用作燃料外,还可用作亚临界生物技术提取溶剂、制冷剂和有机合成原料。已知:
反应1:
反应2:
反应3:
回答下列问题:
(1)①
______  ,反应2正反应的活化能
,反应2正反应的活化能______ (填“大于”“等于”或“小于”,下同)逆反应的活化能;稳定性:顺-2-丁烯(g)______ 反-2-丁烯(g)。
②随着温度的升高,反应1的平衡常数 与反应2的平衡常数
与反应2的平衡常数 的比值
的比值
______ (填“增大”或“减小”)。[反应 的物质的量分数平衡常数
的物质的量分数平衡常数 ,其中x(D)、x(E)、x(G)、x(H)为各组分的物质的量分数]
,其中x(D)、x(E)、x(G)、x(H)为各组分的物质的量分数]
(2)恒温恒压下,向某反应容器中加入一定量顺-2-丁烯(g)、反-2-丁烯(g)和2molH2,同时发生反应1和反应2,顺-2-丁烯(g)的物质的量分数x(A)和反-2-丁烯(g)的物质的量分数x(B)随反应时间的变化如图。______ (填“m”或“n”)。
②设反应体系中气体总压强为pkPa,反应tmin后达到平衡,此时,体系中顺-2-丁烯(g)的物质的量为______ mol;0~tmin内,H2的分压平均变化率为______  ;该条件下,反应3的平衡常数
;该条件下,反应3的平衡常数
______ 。
③恒温恒压下,再向该容器中充入一定量惰性气体He,反应1的化学平衡将______ (填“正向移动”“逆向移动”或“不移动”)。
反应1:

反应2:

反应3:

回答下列问题:
(1)①

 ,反应2正反应的活化能
,反应2正反应的活化能②随着温度的升高,反应1的平衡常数
 与反应2的平衡常数
与反应2的平衡常数 的比值
的比值
 的物质的量分数平衡常数
的物质的量分数平衡常数 ,其中x(D)、x(E)、x(G)、x(H)为各组分的物质的量分数]
,其中x(D)、x(E)、x(G)、x(H)为各组分的物质的量分数](2)恒温恒压下,向某反应容器中加入一定量顺-2-丁烯(g)、反-2-丁烯(g)和2molH2,同时发生反应1和反应2,顺-2-丁烯(g)的物质的量分数x(A)和反-2-丁烯(g)的物质的量分数x(B)随反应时间的变化如图。

②设反应体系中气体总压强为pkPa,反应tmin后达到平衡,此时,体系中顺-2-丁烯(g)的物质的量为
 ;该条件下,反应3的平衡常数
;该条件下,反应3的平衡常数
③恒温恒压下,再向该容器中充入一定量惰性气体He,反应1的化学平衡将
您最近一年使用:0次
2024-02-23更新
|
67次组卷
|
2卷引用:内蒙古自治区赤峰第四中学2023-2024学年高三下学期开学考试理综试题-高中化学
10 . 中国科学家研发出铜基催化剂(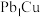 ),实现了
),实现了 高活性、高选择性还原制备甲酸盐,有助于实现碳中和。回答下列问题:
高活性、高选择性还原制备甲酸盐,有助于实现碳中和。回答下列问题:
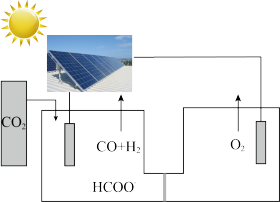
(1)某科研小组设计如图所示电解池,可利用 和
和 制备甲酸盐和水煤气,生成甲酸盐的电极反应式为
制备甲酸盐和水煤气,生成甲酸盐的电极反应式为________ ,当生成1mol甲酸根时,有4mol离子通过交换膜,两极共生成气体________ L(标况下)。
(2)已知25℃、101kPa下,在合成塔中,可通过二氧化碳和氢气合成甲醇,后续可制备甲酸。某反应体系中发生反应如下:
Ⅰ.

Ⅱ.
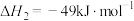
Ⅲ.
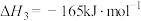
①几种化学键的键能如图表所示,则a=________ 。
②反应Ⅰ的速率方程为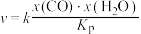 ,其中x表示相应气体的物质的量分数,
,其中x表示相应气体的物质的量分数, 为平衡常数(用平衡分压代替平衡浓度计算),k为反应的速率常数。已知平衡后
为平衡常数(用平衡分压代替平衡浓度计算),k为反应的速率常数。已知平衡后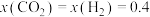 ,此时反应Ⅱ的速率v=
,此时反应Ⅱ的速率v=________  (用含k的代数式表示)。
(用含k的代数式表示)。
(3)向体积均为1L的刚性密闭容器中通入 、
、 ,发生反应Ⅰ和反应Ⅱ,温度对CO和
,发生反应Ⅰ和反应Ⅱ,温度对CO和 的物质的量分数影响如图所示。
的物质的量分数影响如图所示。
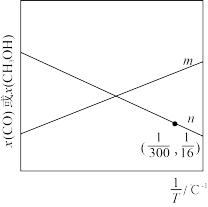
图中表示 物质的量分数的为
物质的量分数的为________ (填“m”或“n”);已知起始压强为pkPa,在300℃时 平衡转化率为60%,则此时反应Ⅰ的
平衡转化率为60%,则此时反应Ⅰ的
________ 。为提高 的选择性,可采取的措施有
的选择性,可采取的措施有________ (写出1条即可)。
 ),实现了
),实现了 高活性、高选择性还原制备甲酸盐,有助于实现碳中和。回答下列问题:
高活性、高选择性还原制备甲酸盐,有助于实现碳中和。回答下列问题:(1)某科研小组设计如图所示电解池,可利用
 和
和 制备甲酸盐和水煤气,生成甲酸盐的电极反应式为
制备甲酸盐和水煤气,生成甲酸盐的电极反应式为
(2)已知25℃、101kPa下,在合成塔中,可通过二氧化碳和氢气合成甲醇,后续可制备甲酸。某反应体系中发生反应如下:
Ⅰ.


Ⅱ.

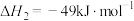
Ⅲ.

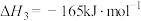
①几种化学键的键能如图表所示,则a=
化学键 | C-H | H-H | H-O | C=O |
键能 | 413 | 436 | 463 | a |
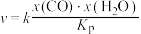 ,其中x表示相应气体的物质的量分数,
,其中x表示相应气体的物质的量分数, 为平衡常数(用平衡分压代替平衡浓度计算),k为反应的速率常数。已知平衡后
为平衡常数(用平衡分压代替平衡浓度计算),k为反应的速率常数。已知平衡后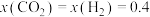 ,此时反应Ⅱ的速率v=
,此时反应Ⅱ的速率v= (用含k的代数式表示)。
(用含k的代数式表示)。(3)向体积均为1L的刚性密闭容器中通入
 、
、 ,发生反应Ⅰ和反应Ⅱ,温度对CO和
,发生反应Ⅰ和反应Ⅱ,温度对CO和 的物质的量分数影响如图所示。
的物质的量分数影响如图所示。
图中表示
 物质的量分数的为
物质的量分数的为 平衡转化率为60%,则此时反应Ⅰ的
平衡转化率为60%,则此时反应Ⅰ的
 的选择性,可采取的措施有
的选择性,可采取的措施有
您最近一年使用:0次




