名校
1 . 二氧化氯(ClO2)具有强氧化性,是优良的饮用水消毒剂。ClO2常温下为黄绿色气体,熔点-59℃,沸点11℃,极易溶于水且不与水反应,浓的ClO2受热时易爆炸。我国广泛使用的方法是用干燥的Cl2与NaClO2固体反应制取ClO2,实验室模拟制备ClO2装置如图所示:
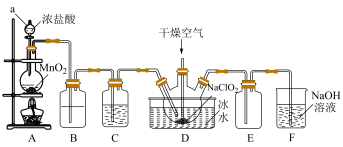
(1)仪器a的名称是:___________ ,装置A中反应的离子方程式为:___________ 。
(2)装置B中盛装的试剂是___________ ,装置C中试剂的作用是:___________ 。
(3)为防止ClO2制备装置发生爆炸,实验中采取的措施:①将装置置于冰水浴中降温,②___________ 。
(4)装置E为ClO2的收集装置,应将其置于___________ 水浴中(填“热”或“冰”)。
(5)装置F为氯气的尾气吸收装置,小组同学用胶头滴管将新制的饱和氯水慢慢滴入含有酚酞的NaOH溶液中,当滴到一定量时,红色突然褪去,小组同学对褪色原因提出假设:
假设1:___________ 。
假设2:可能是氯水中存在HClO具有强氧化性,漂白褪色。
该小组同学设计实验证明假设1是否成立。实验方案为:取少许褪色后的溶液于试管中,滴加足量的NaOH溶液,若___________ (填“实验现象”),则假设1成立。

(1)仪器a的名称是:
(2)装置B中盛装的试剂是
(3)为防止ClO2制备装置发生爆炸,实验中采取的措施:①将装置置于冰水浴中降温,②
(4)装置E为ClO2的收集装置,应将其置于
(5)装置F为氯气的尾气吸收装置,小组同学用胶头滴管将新制的饱和氯水慢慢滴入含有酚酞的NaOH溶液中,当滴到一定量时,红色突然褪去,小组同学对褪色原因提出假设:
假设1:
假设2:可能是氯水中存在HClO具有强氧化性,漂白褪色。
该小组同学设计实验证明假设1是否成立。实验方案为:取少许褪色后的溶液于试管中,滴加足量的NaOH溶液,若
您最近一年使用:0次
2023-11-06更新
|
632次组卷
|
2卷引用:宁夏银川市第二中学2023-2024学年高一上学期期中考试化学试题
2023·全国·模拟预测
解题方法
2 . 工业上利用一种废旧三元锂电池正极材料(主要成分为 ,还含有铝箔、炭黑、有机黏合剂等)回收钴、锰、镍、锂的工艺流程如图所示:
,还含有铝箔、炭黑、有机黏合剂等)回收钴、锰、镍、锂的工艺流程如图所示:
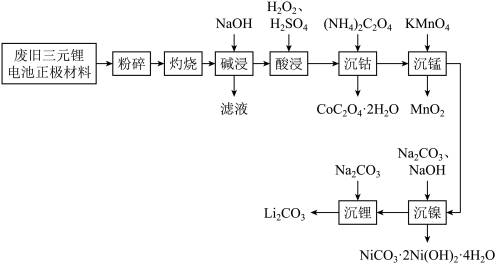
已知:ⅰ.“碱浸”后的滤渣中主要含有 、CoO、MnO、
、CoO、MnO、 和NiO;
和NiO;
ⅱ. ,
, ,
, 。
。
回答下列问题:
(1)“灼烧”的目的是___________ 。
(2)“碱浸”时发生反应的离子方程式为___________ 。
(3)“酸浸”时加入 的目的是
的目的是___________ 。
(4)若“酸浸”后溶液中 、
、 、
、 的浓度均为
的浓度均为 ,欲使
,欲使 完全沉淀(离子浓度小于等于
完全沉淀(离子浓度小于等于 )而不使
)而不使 、
、 沉淀,需调节
沉淀,需调节 的范围为
的范围为___________ 。
(5)“沉锰”时需控制溶液pH=5,发生反应的离子方程式是___________ 。
(6)“沉镍”时,若只加入较高浓度 溶液即可得到
溶液即可得到 ,但最终选择加入NaOH溶液和较低浓度
,但最终选择加入NaOH溶液和较低浓度 溶液的原因为
溶液的原因为___________ 。
 ,还含有铝箔、炭黑、有机黏合剂等)回收钴、锰、镍、锂的工艺流程如图所示:
,还含有铝箔、炭黑、有机黏合剂等)回收钴、锰、镍、锂的工艺流程如图所示:
已知:ⅰ.“碱浸”后的滤渣中主要含有
 、CoO、MnO、
、CoO、MnO、 和NiO;
和NiO;ⅱ.
 ,
, ,
, 。
。回答下列问题:
(1)“灼烧”的目的是
(2)“碱浸”时发生反应的离子方程式为
(3)“酸浸”时加入
 的目的是
的目的是(4)若“酸浸”后溶液中
 、
、 、
、 的浓度均为
的浓度均为 ,欲使
,欲使 完全沉淀(离子浓度小于等于
完全沉淀(离子浓度小于等于 )而不使
)而不使 、
、 沉淀,需调节
沉淀,需调节 的范围为
的范围为(5)“沉锰”时需控制溶液pH=5,发生反应的离子方程式是
(6)“沉镍”时,若只加入较高浓度
 溶液即可得到
溶液即可得到 ,但最终选择加入NaOH溶液和较低浓度
,但最终选择加入NaOH溶液和较低浓度 溶液的原因为
溶液的原因为
您最近一年使用:0次
解题方法
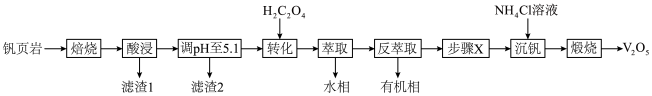
3 . V有“工业味精”之称。工业上提取钒的工艺有多种,一种从钒页岩(一种主要含Si、Fe、Al、V元素的矿石)中提取V的工艺流程如下:
①“酸浸”时有VO 生成;
生成;
② 在有机溶剂中的溶解度大于水,“萃取”时离子的萃取顺序为
在有机溶剂中的溶解度大于水,“萃取”时离子的萃取顺序为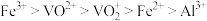 ;
;
③VO 和
和 可以相互转化。
可以相互转化。
回答下列问题:
(1)“焙烧”时可添加适量“盐对”NaCl- 与钒页岩形成混合物,这样做的目的是
与钒页岩形成混合物,这样做的目的是____________________ 。
(2)“滤渣1”除掉的主要杂质元素是_______ (填元素符号)。
(3) 作用是将VO
作用是将VO 转化为
转化为 ,转化的目的是
,转化的目的是_____________ ,发生的离子反应方程式为_____________________ 。
(4)①“沉钒”时,生成 沉淀,“步骤X”应该加入
沉淀,“步骤X”应该加入________ (填“氧化剂”或“还原剂”),写出“沉钒”时的离子反应方程式_______________________ 。
②以“沉钒率”( 沉淀中V的质量和钒页岩中钒的质量之比)表示钒的回收率如图所示,温度高于80℃时沉钒率下降的原因是
沉淀中V的质量和钒页岩中钒的质量之比)表示钒的回收率如图所示,温度高于80℃时沉钒率下降的原因是_______________ 。 可以溶解在NaOH溶液中,得到
可以溶解在NaOH溶液中,得到 ,
, 在不同的pH下可以得到不同聚合度的多钒酸盐,其阴离子呈如图所示的无限链状结构,其中一种酸式钒酸根离子可以表示为
在不同的pH下可以得到不同聚合度的多钒酸盐,其阴离子呈如图所示的无限链状结构,其中一种酸式钒酸根离子可以表示为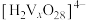 ,其中
,其中
________ 。 的立方晶胞如图所示,则在晶胞中,黑球代表的是
的立方晶胞如图所示,则在晶胞中,黑球代表的是_____ 原子。
①“酸浸”时有VO
 生成;
生成;②
 在有机溶剂中的溶解度大于水,“萃取”时离子的萃取顺序为
在有机溶剂中的溶解度大于水,“萃取”时离子的萃取顺序为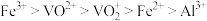 ;
;③VO
 和
和 可以相互转化。
可以相互转化。回答下列问题:
(1)“焙烧”时可添加适量“盐对”NaCl-
 与钒页岩形成混合物,这样做的目的是
与钒页岩形成混合物,这样做的目的是(2)“滤渣1”除掉的主要杂质元素是
(3)
 作用是将VO
作用是将VO 转化为
转化为 ,转化的目的是
,转化的目的是(4)①“沉钒”时,生成
 沉淀,“步骤X”应该加入
沉淀,“步骤X”应该加入②以“沉钒率”(
 沉淀中V的质量和钒页岩中钒的质量之比)表示钒的回收率如图所示,温度高于80℃时沉钒率下降的原因是
沉淀中V的质量和钒页岩中钒的质量之比)表示钒的回收率如图所示,温度高于80℃时沉钒率下降的原因是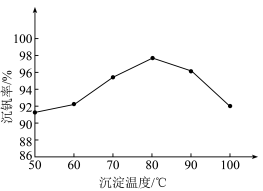
 可以溶解在NaOH溶液中,得到
可以溶解在NaOH溶液中,得到 ,
, 在不同的pH下可以得到不同聚合度的多钒酸盐,其阴离子呈如图所示的无限链状结构,其中一种酸式钒酸根离子可以表示为
在不同的pH下可以得到不同聚合度的多钒酸盐,其阴离子呈如图所示的无限链状结构,其中一种酸式钒酸根离子可以表示为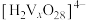 ,其中
,其中
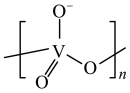
 的立方晶胞如图所示,则在晶胞中,黑球代表的是
的立方晶胞如图所示,则在晶胞中,黑球代表的是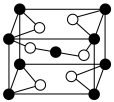
您最近一年使用:0次
2024-05-03更新
|
516次组卷
|
2卷引用:广东省大湾区普通高中2024届高三下学期毕业年级联合模拟考试(二)化学试卷
名校
4 . 合成氨工业中采用循环操作(如图),主要是为了
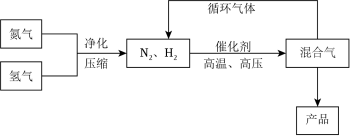
| A.降低氨的沸点 | B.提高氮气和氢气的利用率 |
| C.提高平衡混合物中氨的含量 | D.增大化学反应速率 |
您最近一年使用:0次
2023-05-19更新
|
535次组卷
|
8卷引用:广东省华南师范大学附属中学2022-2023学年高二上学期期中考试化学试题
名校
解题方法
5 . 含NO烟气需要处理后才能排放。
(1)氢气催化还原含NO烟气。
主反应:2NO(g)+2H2(g) N2(g)+2H2O(g) ΔH1=akJ•mol-1
N2(g)+2H2O(g) ΔH1=akJ•mol-1
副反应:2NO(g)+H2(g) N2O(g)+H2O(g) ΔH2=bkJ•mol-1
N2O(g)+H2O(g) ΔH2=bkJ•mol-1
①2NO(g)+N2(g) 2N2O(g) ΔH=
2N2O(g) ΔH=_____ kJ•mol-1
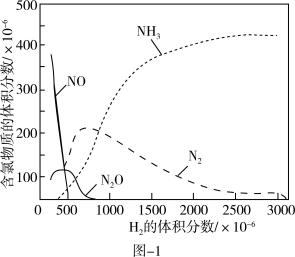
②某温度下H2的体积分数对H2还原NO反应的影响如图1所示。当H2的体积分数大于600×10-6时,N2的体积分数呈下降趋势,原因是_____ 。
(2)煤焦吸附还原含NO烟气。
将原煤经热解、冷却得到煤焦,NO的脱除主要含吸附和化学还原(ΔH<0)两个过程,煤焦表面存在的官能团有利于NO的吸附,其数量与煤焦中氢碳质量比的值密切相关。热解温度为500℃、900℃得到的煤焦分别用S—500、S—900表示,相关信息如表:
将NO浓度恒定的烟气以固定流速通过装有煤焦的反应器。不同温度下,测得NO的脱除率与温度的关系如图2所示。

①相同温度下,S—900对NO的脱除率比S—500的低,可能的原因是_____ 。
②350℃后,随着温度升高,NO的脱除率增大的原因是_____ 。
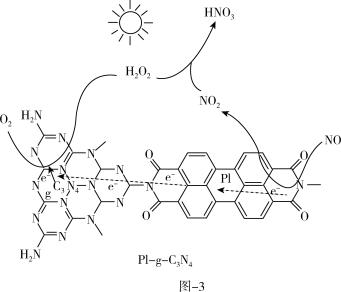
(3)P1—g—C3N4光催化氧化含NO烟气。
用P1—g—C3N4光催化氧化法脱除NO的过程如图3所示。在酸性水溶液中,光催化脱除原理和电化学反应原理类似,P1—g—C3N4光催化的P1和g—C3N4两端类似于两极,该反应过程可描述为_____ 。
(1)氢气催化还原含NO烟气。
主反应:2NO(g)+2H2(g)
 N2(g)+2H2O(g) ΔH1=akJ•mol-1
N2(g)+2H2O(g) ΔH1=akJ•mol-1副反应:2NO(g)+H2(g)
 N2O(g)+H2O(g) ΔH2=bkJ•mol-1
N2O(g)+H2O(g) ΔH2=bkJ•mol-1①2NO(g)+N2(g)
 2N2O(g) ΔH=
2N2O(g) ΔH=②某温度下H2的体积分数对H2还原NO反应的影响如图1所示。当H2的体积分数大于600×10-6时,N2的体积分数呈下降趋势,原因是

(2)煤焦吸附还原含NO烟气。
将原煤经热解、冷却得到煤焦,NO的脱除主要含吸附和化学还原(ΔH<0)两个过程,煤焦表面存在的官能团有利于NO的吸附,其数量与煤焦中氢碳质量比的值密切相关。热解温度为500℃、900℃得到的煤焦分别用S—500、S—900表示,相关信息如表:
| 煤焦 | 元素分析(%) | 比表面积(cm2∙g-1) | |
| C | H | ||
| S—500 | 80.79 | 2.76 | 105.69 |
| S—900 | 84.26 | 0.82 | 8.98 |

①相同温度下,S—900对NO的脱除率比S—500的低,可能的原因是
②350℃后,随着温度升高,NO的脱除率增大的原因是
(3)P1—g—C3N4光催化氧化含NO烟气。
用P1—g—C3N4光催化氧化法脱除NO的过程如图3所示。在酸性水溶液中,光催化脱除原理和电化学反应原理类似,P1—g—C3N4光催化的P1和g—C3N4两端类似于两极,该反应过程可描述为

您最近一年使用:0次
2022-01-20更新
|
678次组卷
|
4卷引用:江苏省无锡市普通高中2021-2022学年上学期高三期末调研考试化学试题
江苏省无锡市普通高中2021-2022学年上学期高三期末调研考试化学试题江苏省南京师范大学附属中学2021-2022学年高三下学期开学考试化学试题 (已下线)2022年江苏卷高考真题变式题14-17(已下线)江苏省2022年普通高中学业水平选择性考试变式题(原理综合题)
6 . 焦炉煤气(主要成分:CH4、CO2、H2、CO)在炭催化下,使CH4与CO2重整生成H2和CO。其主要反应为
反应I:

反应II:

反应III:

反应IV:

在1×105Pa、将焦炉煤气以一定流速通过装有炭催化剂的反应管,CH4、CO、H2的相对体积和CO2的转化率随温度变化的曲线如图所示。 、
、
相对体积
下列说法不正确的是
反应I:


反应II:


反应III:


反应IV:


在1×105Pa、将焦炉煤气以一定流速通过装有炭催化剂的反应管,CH4、CO、H2的相对体积和CO2的转化率随温度变化的曲线如图所示。

 、
、相对体积

下列说法不正确的是
| A.温度低于900℃,反应I基本不发生 |
| B.850℃~900℃时,主要发生反应Ⅳ |
| C.增大焦炉煤气流速一定能提高CO的相对体积 |
| D.工业生产上需要研发低温下CH4转化率高的催化剂 |
您最近一年使用:0次
解题方法
7 . 铈(Ce)是一种典型的稀土元素,属于国家战略资源。以玻璃粉末(主要含CeO2,还含少量SiO2 Fe2O3、Al2O3及微量MnO)为原料可制备无水氯化铈(CeCl3),主要步骤如下:
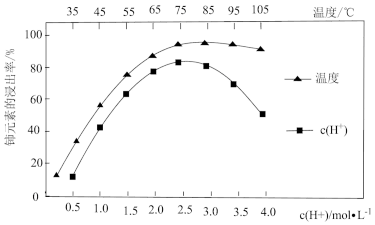
(1)酸浸:用稀硫酸和双氧水的混合溶液浸取玻璃粉末,浸取液中含有Ce3+、Fe3+、Al3+、Mn2+等金属阳离子。CeO2不溶于水,写出其发生反应的离子方程式:_______ 。Ce的浸出率与c(H+)、温度的关系如图所示。生产中应选择的适宜条件为_______ 。
(2)除杂:向浸出液中加入NaOH调节pH除去Fe3+、Al3+。注:当pH>12时,Al(OH)3沉淀开始溶解。有关沉淀数据如下表(“完全沉定”时金属离子浓度≤1.0×10-5mol/L)。
若浸取液中c(Ce3+)=0.01mol/L,则须调节溶液pH的范围是_______ (加入NaOH溶液,忽略体积变化)。
(3)萃取与反萃取:向除杂后的溶液中,加入有机物HT,发生反应:Ce3+(水层)+3HT(有机层) CeT3(有机层)+3H+(水层)。向分离所得有机层中加入
CeT3(有机层)+3H+(水层)。向分离所得有机层中加入_______ 能获得较纯的CeCl3溶液。
结晶析出:将CeCl3溶液蒸发浓缩、冷却结晶,过滤,得到CeCl3·7H2O晶体。
(4)加热脱水:将NH4Cl固体和CeCl3·7H2O混合,在真空中加热可得无水CeCl3。加入NH4Cl固体的作用是_______ 。
(1)酸浸:用稀硫酸和双氧水的混合溶液浸取玻璃粉末,浸取液中含有Ce3+、Fe3+、Al3+、Mn2+等金属阳离子。CeO2不溶于水,写出其发生反应的离子方程式:

(2)除杂:向浸出液中加入NaOH调节pH除去Fe3+、Al3+。注:当pH>12时,Al(OH)3沉淀开始溶解。有关沉淀数据如下表(“完全沉定”时金属离子浓度≤1.0×10-5mol/L)。
| 沉淀 | Al(OH)3 | Fe(OH)3 | Ce(OH)3 | Mn(OH)2 |
| 恰好完全沉淀时pH | 5.2 | 2.8 | 9 | 10.1 |
若浸取液中c(Ce3+)=0.01mol/L,则须调节溶液pH的范围是
(3)萃取与反萃取:向除杂后的溶液中,加入有机物HT,发生反应:Ce3+(水层)+3HT(有机层)
 CeT3(有机层)+3H+(水层)。向分离所得有机层中加入
CeT3(有机层)+3H+(水层)。向分离所得有机层中加入结晶析出:将CeCl3溶液蒸发浓缩、冷却结晶,过滤,得到CeCl3·7H2O晶体。
(4)加热脱水:将NH4Cl固体和CeCl3·7H2O混合,在真空中加热可得无水CeCl3。加入NH4Cl固体的作用是
您最近一年使用:0次
2022-01-23更新
|
620次组卷
|
2卷引用:江苏省海安市2021-2022学年高二上学期学业质量检测化学试题
8 . 工业合成甲醇的反应为
 。反应相同时间,实验测得甲醇的产率与压强,温度的关系分别如图1,图2所示。下列叙述正确的是
。反应相同时间,实验测得甲醇的产率与压强,温度的关系分别如图1,图2所示。下列叙述正确的是


 。反应相同时间,实验测得甲醇的产率与压强,温度的关系分别如图1,图2所示。下列叙述正确的是
。反应相同时间,实验测得甲醇的产率与压强,温度的关系分别如图1,图2所示。下列叙述正确的是
| A.合成甲醇时压强越大越好 | B.增大压强,正反应速率增大,逆反应速率减小 |
| C.合成甲醇的最佳温度为520K | D.520K之前升高温度单位时间内甲醇的产率减小 |
您最近一年使用:0次
2023-12-16更新
|
519次组卷
|
3卷引用:海南省2023-2024学年高三上学期高考全真模拟卷(四)化学试题
海南省2023-2024学年高三上学期高考全真模拟卷(四)化学试题(已下线)题型18 化学反应原理综合-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)海南省琼中黎族苗族自治县琼中中学 屯昌县屯昌中学2023-2024学年高三上学期12月联考化学试题
22-23高一·全国·课后作业
名校
9 . 下列有关合成氨条件的选择和解释不合理的是
| A.使用催化剂,可加快N2和H2合成氨的速率 |
| B.高压比常压条件更有利于合成氨 |
| C.采用500℃左右主要考虑反应速率问题 |
| D.采用高温高压合成氨有利于提高反应速率和平衡产率 |
您最近一年使用:0次
2023-01-31更新
|
547次组卷
|
4卷引用:6.2.2 化学反应限度和化学反应条件控制——同步学习必备知识
(已下线)6.2.2 化学反应限度和化学反应条件控制——同步学习必备知识 河南大学附属中学2022-2023学年高一下学期期中考试 化学试题【精品卷】2.4 化学反应的调控课堂例题-人教版2023-2024学年选择性必修1山东省临沂市平邑县第一中学西校区2023-2024学年高二上学期第一次月考化学试题
名校
10 . 工业合成氨是人类科学技术的一项重大突破。 下的合成氨反应:
下的合成氨反应:

下列关于工业合成氨条件选择的说法,正确的是
 下的合成氨反应:
下的合成氨反应:
下列关于工业合成氨条件选择的说法,正确的是
A. 下该反应的 下该反应的 ,必须降低温度以保证合成氨顺利进行 ,必须降低温度以保证合成氨顺利进行 |
| B.增压有利于合成氨平衡正向移动,因此实际工业中反应压强越大越好 |
C.通过液化分离的方式不断移除产品 ,有利于增大反应平衡常数,促进反应正向进行 ,有利于增大反应平衡常数,促进反应正向进行 |
| D.原料气进入合成塔之前,须经过干燥净化,以防止催化剂中毒 |
您最近一年使用:0次
2023-10-10更新
|
504次组卷
|
3卷引用:四川省成都市第七中学2023-2024学年高二上学期10月月考化学试题



