解题方法
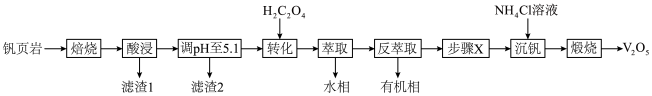
1 . V有“工业味精”之称。工业上提取钒的工艺有多种,一种从钒页岩(一种主要含Si、Fe、Al、V元素的矿石)中提取V的工艺流程如下:
①“酸浸”时有VO 生成;
生成;
② 在有机溶剂中的溶解度大于水,“萃取”时离子的萃取顺序为
在有机溶剂中的溶解度大于水,“萃取”时离子的萃取顺序为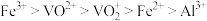 ;
;
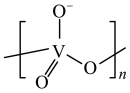
③VO 和
和 可以相互转化。
可以相互转化。
回答下列问题:
(1)“焙烧”时可添加适量“盐对”NaCl- 与钒页岩形成混合物,这样做的目的是
与钒页岩形成混合物,这样做的目的是____________________ 。
(2)“滤渣1”除掉的主要杂质元素是_______ (填元素符号)。
(3) 作用是将VO
作用是将VO 转化为
转化为 ,转化的目的是
,转化的目的是_____________ ,发生的离子反应方程式为_____________________ 。
(4)①“沉钒”时,生成 沉淀,“步骤X”应该加入
沉淀,“步骤X”应该加入________ (填“氧化剂”或“还原剂”),写出“沉钒”时的离子反应方程式_______________________ 。
②以“沉钒率”( 沉淀中V的质量和钒页岩中钒的质量之比)表示钒的回收率如图所示,温度高于80℃时沉钒率下降的原因是
沉淀中V的质量和钒页岩中钒的质量之比)表示钒的回收率如图所示,温度高于80℃时沉钒率下降的原因是_______________ 。 可以溶解在NaOH溶液中,得到
可以溶解在NaOH溶液中,得到 ,
, 在不同的pH下可以得到不同聚合度的多钒酸盐,其阴离子呈如图所示的无限链状结构,其中一种酸式钒酸根离子可以表示为
在不同的pH下可以得到不同聚合度的多钒酸盐,其阴离子呈如图所示的无限链状结构,其中一种酸式钒酸根离子可以表示为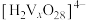 ,其中
,其中
________ 。 的立方晶胞如图所示,则在晶胞中,黑球代表的是
的立方晶胞如图所示,则在晶胞中,黑球代表的是_____ 原子。
①“酸浸”时有VO
 生成;
生成;②
 在有机溶剂中的溶解度大于水,“萃取”时离子的萃取顺序为
在有机溶剂中的溶解度大于水,“萃取”时离子的萃取顺序为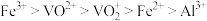 ;
;③VO
 和
和 可以相互转化。
可以相互转化。回答下列问题:
(1)“焙烧”时可添加适量“盐对”NaCl-
 与钒页岩形成混合物,这样做的目的是
与钒页岩形成混合物,这样做的目的是(2)“滤渣1”除掉的主要杂质元素是
(3)
 作用是将VO
作用是将VO 转化为
转化为 ,转化的目的是
,转化的目的是(4)①“沉钒”时,生成
 沉淀,“步骤X”应该加入
沉淀,“步骤X”应该加入②以“沉钒率”(
 沉淀中V的质量和钒页岩中钒的质量之比)表示钒的回收率如图所示,温度高于80℃时沉钒率下降的原因是
沉淀中V的质量和钒页岩中钒的质量之比)表示钒的回收率如图所示,温度高于80℃时沉钒率下降的原因是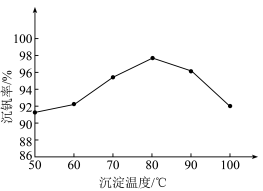
 可以溶解在NaOH溶液中,得到
可以溶解在NaOH溶液中,得到 ,
, 在不同的pH下可以得到不同聚合度的多钒酸盐,其阴离子呈如图所示的无限链状结构,其中一种酸式钒酸根离子可以表示为
在不同的pH下可以得到不同聚合度的多钒酸盐,其阴离子呈如图所示的无限链状结构,其中一种酸式钒酸根离子可以表示为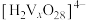 ,其中
,其中
 的立方晶胞如图所示,则在晶胞中,黑球代表的是
的立方晶胞如图所示,则在晶胞中,黑球代表的是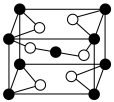
您最近一年使用:0次
2024-05-03更新
|
511次组卷
|
2卷引用:广东省大湾区普通高中2024届高三下学期毕业年级联合模拟考试(二)化学试卷
解题方法
2 . 一定条件下,1-苯基丙炔(Ph-C=C-CH3)可与HCl发生催化加成,反应如下:不正确 的是
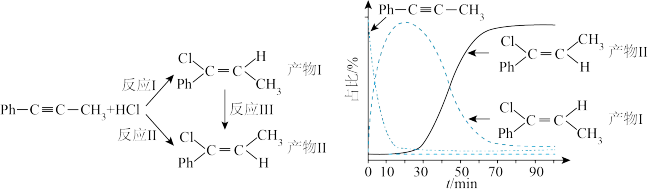
| A.反应活化能:反应I<反应Ⅱ |
| B.反应焓变:反应I<反应Ⅱ |
| C.增加HCl浓度不会改变平衡时产物Ⅱ和产物I的比例 |
| D.选择相对较短的反应时间,及时分离可获得高产率的产物Ⅰ |
您最近一年使用:0次
名校
解题方法
3 . 下列陈述Ⅰ与陈述Ⅱ均正确,且具有因果关系的是
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | 氨气的水溶液能导电 | 氨气是电解质 |
| B | H—F键能比H—Cl键能大 | HF的沸点比HCl高 |
| C | 工业合成氨需在高温、高压下才能进行 | 该反应是吸热反应 |
| D | 浓硫酸具有吸水性 | 可用于 、 、 等气体干燥 等气体干燥 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-03-21更新
|
427次组卷
|
2卷引用:广东省湛江市2024届高三一模化学试题
名校
解题方法
4 . 次氯酸盐是常用的水处理剂。
已知:①有效氯含量(COAC)指与含氯消毒剂氧化能力相当的氯气量,单位为 。
。
②物质氧化性越强,氧化还原电位(ORP)越高。
③相同条件下,次氯酸的氧化性大于次氯酸盐
(1)配制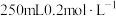 的
的 溶液
溶液
i、量取冰醋酸时应选用仪器___________ 。(填标号)
ii、冬季低温环境冰醋酸凝固时如何取出___________ 。
(2)温度及pH对 溶液有效氯含量(COAC)及氧化还原电位的影响:
溶液有效氯含量(COAC)及氧化还原电位的影响:
在不同温度下,用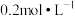 的乙酸溶液调节pH得到
的乙酸溶液调节pH得到 溶液COCA、ORP的关系如图1、图2所示。
溶液COCA、ORP的关系如图1、图2所示。
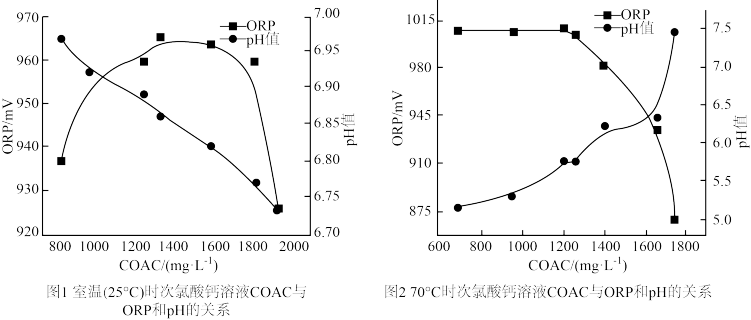
i.由图1可知,随着少量乙酸的滴入, 溶液的pH在
溶液的pH在___________ (填“增大”或“减小”。)
ii. 溶液氧化性在
溶液氧化性在 最大的原因是
最大的原因是___________ 。
iii. 溶液用于消毒时适宜的条件是:温度
溶液用于消毒时适宜的条件是:温度___________ 、pH___________ (填标号)。
A.25℃ B.70℃ C.5.75 D.6.85
(3)某小组探究70℃时,pH值及稳定剂对NaClO溶液有效氯含量的影响。甲同学设计实验方案如下
i.设计实验1和2的目的是___________ 。
ii.实验5中的a___________ 0.935(填“大于”、“小于”或“等于”)。
iii.根据实验3-5,可得出的结论是___________ 。
iv。下列物质中最适宜做为NaClO溶液稳定剂的是___________ 。
A. B.NaCl C.
B.NaCl C. D.
D.
已知:①有效氯含量(COAC)指与含氯消毒剂氧化能力相当的氯气量,单位为
 。
。②物质氧化性越强,氧化还原电位(ORP)越高。
③相同条件下,次氯酸的氧化性大于次氯酸盐
(1)配制
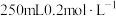 的
的 溶液
溶液i、量取冰醋酸时应选用仪器

ii、冬季低温环境冰醋酸凝固时如何取出
(2)温度及pH对
 溶液有效氯含量(COAC)及氧化还原电位的影响:
溶液有效氯含量(COAC)及氧化还原电位的影响:在不同温度下,用
 的乙酸溶液调节pH得到
的乙酸溶液调节pH得到 溶液COCA、ORP的关系如图1、图2所示。
溶液COCA、ORP的关系如图1、图2所示。
i.由图1可知,随着少量乙酸的滴入,
 溶液的pH在
溶液的pH在ii.
 溶液氧化性在
溶液氧化性在 最大的原因是
最大的原因是iii.
 溶液用于消毒时适宜的条件是:温度
溶液用于消毒时适宜的条件是:温度A.25℃ B.70℃ C.5.75 D.6.85
(3)某小组探究70℃时,pH值及稳定剂对NaClO溶液有效氯含量的影响。甲同学设计实验方案如下
| 序号 | 硅酸钠的质量分数 | 碳酸钠的质量分数 | 初始COAC | pH值 | 12h后COAC | 12h后COAC/初始COAC |
| 1 | 0 | 0 | 1794 | 8.53 | 1218 | 0.679 |
| 2 | 0 | 0 | 1794 | 8.63 | 1288 | 0.718 |
| 3 | 0.9% | 0.6% | 1794 | 13.44 | 1676 | 0.935 |
| 4 | 1.5% | 0 | 1834 | 13.76 | 1597 | 0.871 |
| 5 | 0 | 1.5% | 1834 | 13.66 | - | a |
ii.实验5中的a
iii.根据实验3-5,可得出的结论是
iv。下列物质中最适宜做为NaClO溶液稳定剂的是
A.
 B.NaCl C.
B.NaCl C. D.
D.
您最近一年使用:0次
解题方法
5 . 氮化镓(GaN)在5G基站及工业互联网系统建设等方面用途广泛。从砷化镓废料(主要成分为GaAs,含Fe2O3、 SiO2和CaCO3等杂质)中回收砷,制备GaN的工艺流程如图:
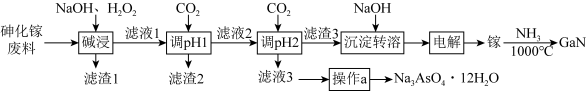
已知:①Ga与Al同主族,化学性质相似;
②离子完全沉淀的pH值: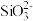 为8,
为8, 为5.5。
为5.5。
回答下列问题:
(1)为了提高“碱浸”效率应采用的措施是_______ (写 出一种措施)。
(2)“滤液1”中含有NaGaO2等溶质, “碱浸”时反应的离子方程式为_______ 。“滤渣1”的成分为_______ (填化学式)。
(3)通CO2两次调pH的原因是_______ 。
(4)“操作a”为_______ 、过滤、洗涤、干燥。
(5)“电解”时阴极的电极反应为_______ 。
(6)制备GaN时,参与反应的氧化剂与还原剂的物质的量之比为_______ 。
(7)取m克GaN样品溶于足量的热NaOH溶液(GaN+OH- +H2O = +NH3↑)中,用H3BO3溶液将产生的NH3完全吸收,用c mol·L-1的盐酸滴定,消耗盐酸V mL,则样品的纯度是
+NH3↑)中,用H3BO3溶液将产生的NH3完全吸收,用c mol·L-1的盐酸滴定,消耗盐酸V mL,则样品的纯度是_______ 。(已知: NH3+H3BO3 =NH3·H3BO3;NH3·H3BO3 +HCl=NH4Cl+H3BO3 )

已知:①Ga与Al同主族,化学性质相似;
②离子完全沉淀的pH值:
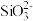 为8,
为8, 为5.5。
为5.5。回答下列问题:
(1)为了提高“碱浸”效率应采用的措施是
(2)“滤液1”中含有NaGaO2等溶质, “碱浸”时反应的离子方程式为
(3)通CO2两次调pH的原因是
(4)“操作a”为
(5)“电解”时阴极的电极反应为
(6)制备GaN时,参与反应的氧化剂与还原剂的物质的量之比为
(7)取m克GaN样品溶于足量的热NaOH溶液(GaN+OH- +H2O =
 +NH3↑)中,用H3BO3溶液将产生的NH3完全吸收,用c mol·L-1的盐酸滴定,消耗盐酸V mL,则样品的纯度是
+NH3↑)中,用H3BO3溶液将产生的NH3完全吸收,用c mol·L-1的盐酸滴定,消耗盐酸V mL,则样品的纯度是
您最近一年使用:0次
6 . 废旧锌锰电池通过拆分煅烧后,可得棕色锰粉(主要成分为MnO、Mn2O3、Mn3O4、MnO2、ZnO和ZnMn2O4),从棕色锰粉中获得γ-MnO2和超细ZnO粉体的工艺流程如下图所示,结合流程回答以下问题:
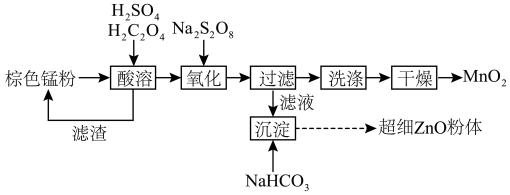
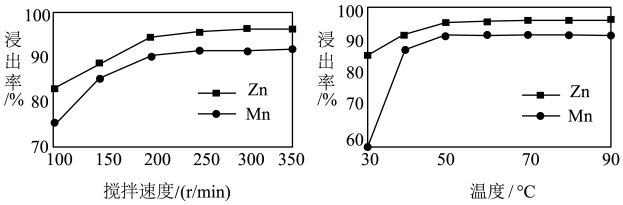
(1)某课题组研究酸溶过程中相关条件对锌、锰浸出率的影响,以获得酸溶反应的最佳条件。由下图可知,酸溶反应的最佳条件为:搅拌速度_______ r·min-1,温度_______ ℃。
(2)在上述确定的最佳条件下进行酸溶反应。酸溶的目的是将锌、锰元素转化为Zn2+、Mn2+,则酸溶过程,H2C2O4的主要作用是作_______ ,判断酸溶反应结束的现象是_______ ,酸溶过程不用H2O2代替H2C2O4的理由是:_______ 。
(3)Na2S2O8被还原为 ,请写出“氧化”步骤的离子方程式:
,请写出“氧化”步骤的离子方程式:_______ 。
(4)洗涤步骤中,判断洗涤干净的操作是_______ 。
(5)可用0.2500mol/L的EDTA测定ZnO纯度(已知EDTA与Zn2+按物质的量1:1反应,杂质不参与反应),取1.800g制得的超细ZnO溶于适量硫酸,将溶液稀释至100mL,取25.00mL用EDTA滴定,消耗20.00mLEDTA,则制得的ZnO纯度为_______ 。

(1)某课题组研究酸溶过程中相关条件对锌、锰浸出率的影响,以获得酸溶反应的最佳条件。由下图可知,酸溶反应的最佳条件为:搅拌速度

(2)在上述确定的最佳条件下进行酸溶反应。酸溶的目的是将锌、锰元素转化为Zn2+、Mn2+,则酸溶过程,H2C2O4的主要作用是作
(3)Na2S2O8被还原为
 ,请写出“氧化”步骤的离子方程式:
,请写出“氧化”步骤的离子方程式:(4)洗涤步骤中,判断洗涤干净的操作是
(5)可用0.2500mol/L的EDTA测定ZnO纯度(已知EDTA与Zn2+按物质的量1:1反应,杂质不参与反应),取1.800g制得的超细ZnO溶于适量硫酸,将溶液稀释至100mL,取25.00mL用EDTA滴定,消耗20.00mLEDTA,则制得的ZnO纯度为
您最近一年使用:0次
解题方法
7 . 化学与生活息息相关,下列生产活动与化学知识对应且正确的是
| 选项 | 生产活动 | 化学知识 |
| A | 用粮食酿酒 | 淀粉水解得到乙醇 |
| B | 以油脂为原料制肥皂 | 油脂在碱性条件下几乎完全水解 |
| C | 合成氨使用500℃左右的高温和10个大气压 | 此条件合成氨反应平衡转化率最高 |
| D | 用光导纤维传输信号 | Si是良好的半导体 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-05-14更新
|
356次组卷
|
2卷引用:广东省新高考普通高中2022届高三联合质量测评冲刺模拟考试化学试题
名校
解题方法
8 . 氨的合成是最重要的化工生产之一、以下是合成氨的方法与应用,请根据题意,回答相应问题:
氨的合成(N2(g)+3H2(g)⇌2NH3(g) △H=-46.2kJ‧mol-1)
(1)工业上可利用“甲烷蒸气转化法生产氢气”,反应为:CH4(g)+H2O(g)⇌CO(g)+3H2(g),已知有关反应的能量变化如下图:
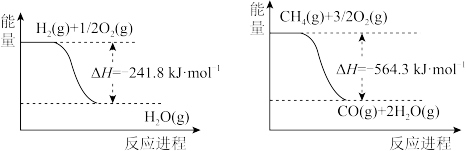
则该反应的焓变△H=___________ ;
(2)丙烷脱氢制丙烯反应[C3H8(g)⇌C3H6(g)+H2(g)],产生的H2也可用于合成氨。若一定温度下,向恒容密闭容器中充入1molC3H8,开始压强为pkPa,发生脱氢反应。
①下列情况能说明丙烷脱氢制丙烯反应达到平衡状态的是(填字母)___________ 。
A.该反应的焓变(△H)保持不变 B.气体平均摩尔质量保持不变
C.气体密度保持不变 D.C3H8分解速率与C3H6消耗速率相等
②丙烷脱氢制丙烯反应过程中,C3H8的气体体积分数与反应时间的关系如图所示。此温度下该反应的平衡常数Kp=___________ kPa(用含字母p的代数式表示,Kp是用反应体系中气体物质的分压表示的平衡常数,平衡分压=总压×物质的量分数)。
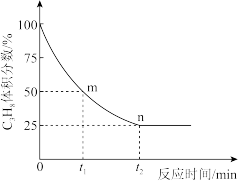
③已知上述反应中,v正=k正·p(C3H8),v逆=k逆·p(C3H6)·p(H2),其中k正、k逆为速率常数,只与温度有关,则图中m点处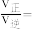
___________ 。
(3)实际生产中,常用工艺条件,Fe作催化剂,控制温度773K,压强3.0×105Pa,原料中N2和H2物质的量之比为1:2.8。
①分析说明原料气中N2过量的理由___________ 。
②关于合成氨工艺的下列理解,正确的是___________ 。
A.合成氨反应在不同温度下的△H都小于零
B.控制温度(773K)远高于室温,是为了保证尽可能的平衡转化率和快的反应速率
C.当温度、压强一定时,在原料气(N2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率
D.基于NH3有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行
氨的合成(N2(g)+3H2(g)⇌2NH3(g) △H=-46.2kJ‧mol-1)
(1)工业上可利用“甲烷蒸气转化法生产氢气”,反应为:CH4(g)+H2O(g)⇌CO(g)+3H2(g),已知有关反应的能量变化如下图:
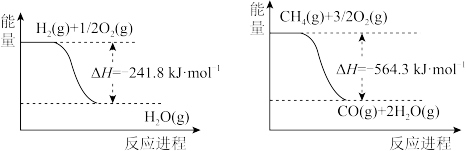
则该反应的焓变△H=
(2)丙烷脱氢制丙烯反应[C3H8(g)⇌C3H6(g)+H2(g)],产生的H2也可用于合成氨。若一定温度下,向恒容密闭容器中充入1molC3H8,开始压强为pkPa,发生脱氢反应。
①下列情况能说明丙烷脱氢制丙烯反应达到平衡状态的是(填字母)
A.该反应的焓变(△H)保持不变 B.气体平均摩尔质量保持不变
C.气体密度保持不变 D.C3H8分解速率与C3H6消耗速率相等
②丙烷脱氢制丙烯反应过程中,C3H8的气体体积分数与反应时间的关系如图所示。此温度下该反应的平衡常数Kp=

③已知上述反应中,v正=k正·p(C3H8),v逆=k逆·p(C3H6)·p(H2),其中k正、k逆为速率常数,只与温度有关,则图中m点处
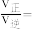
(3)实际生产中,常用工艺条件,Fe作催化剂,控制温度773K,压强3.0×105Pa,原料中N2和H2物质的量之比为1:2.8。
①分析说明原料气中N2过量的理由
②关于合成氨工艺的下列理解,正确的是
A.合成氨反应在不同温度下的△H都小于零
B.控制温度(773K)远高于室温,是为了保证尽可能的平衡转化率和快的反应速率
C.当温度、压强一定时,在原料气(N2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率
D.基于NH3有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行
您最近一年使用:0次
2022-02-23更新
|
889次组卷
|
2卷引用:广东省梅州市五华县2019-2020学年高三下学期第一次质检化学试题
名校
解题方法
9 . 钌( )为稀有元素,广泛应用于电子、航空航天、化工等领域。某含钌的废渣主要成分为
)为稀有元素,广泛应用于电子、航空航天、化工等领域。某含钌的废渣主要成分为 、
、 、
、 、
、 ,一种从中回收
,一种从中回收 制
制 的工艺流程如下:
的工艺流程如下:
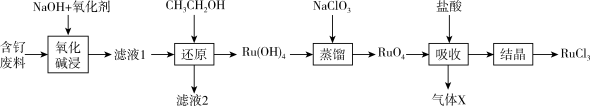
(1)“氧化碱浸”时,两种氧化剂在不同温度对钌浸出率和渣率分别如图1、图2所示,则适宜选择的氧化剂为_______ ;最佳反应温度为_______ 。
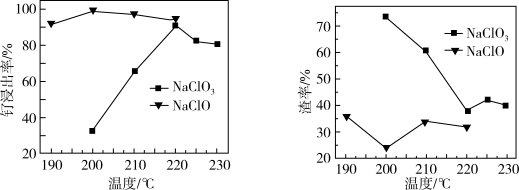
图1 图2
(2)滤液1中溶质主要成分为 、
、 、
、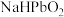 和
和_______ ;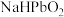 中
中 的化合价为
的化合价为_______ ; 转化为
转化为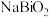 的化学方程式为
的化学方程式为_______ 。
(3)“还原”过程生成 和乙醛,且
和乙醛,且 明显增大,则该过程的离子反应方程式为
明显增大,则该过程的离子反应方程式为_______ 。
(4)“吸收”过程产生的气体X经Y溶液吸收后,经进一步处理可以循环利用,则X和Y的化学式分别为_______ 、_______ 。
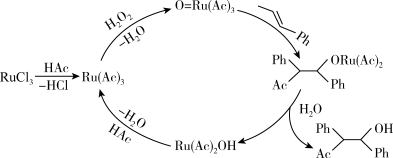
(5) 在有机合成中有重要应用,其参与某有机物合成的路线如下图3所示(
在有机合成中有重要应用,其参与某有机物合成的路线如下图3所示( 代表乙酸,
代表乙酸, 代表苯基),则下列说法正确的是_______。
代表苯基),则下列说法正确的是_______。
 )为稀有元素,广泛应用于电子、航空航天、化工等领域。某含钌的废渣主要成分为
)为稀有元素,广泛应用于电子、航空航天、化工等领域。某含钌的废渣主要成分为 、
、 、
、 、
、 ,一种从中回收
,一种从中回收 制
制 的工艺流程如下:
的工艺流程如下:
(1)“氧化碱浸”时,两种氧化剂在不同温度对钌浸出率和渣率分别如图1、图2所示,则适宜选择的氧化剂为

图1 图2
(2)滤液1中溶质主要成分为
 、
、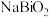 、
、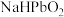 和
和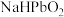 中
中 的化合价为
的化合价为 转化为
转化为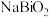 的化学方程式为
的化学方程式为(3)“还原”过程生成
 和乙醛,且
和乙醛,且 明显增大,则该过程的离子反应方程式为
明显增大,则该过程的离子反应方程式为(4)“吸收”过程产生的气体X经Y溶液吸收后,经进一步处理可以循环利用,则X和Y的化学式分别为
(5)
 在有机合成中有重要应用,其参与某有机物合成的路线如下图3所示(
在有机合成中有重要应用,其参与某有机物合成的路线如下图3所示( 代表乙酸,
代表乙酸, 代表苯基),则下列说法正确的是_______。
代表苯基),则下列说法正确的是_______。
A. 为催化剂 为催化剂 | B. 作还原剂 作还原剂 | C. 为中间产物 为中间产物 | D.主要生成物为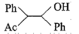 |
您最近一年使用:0次
2022-01-22更新
|
984次组卷
|
3卷引用:广东省茂名市2022届高三第一次综合测试(一模)化学试题
广东省茂名市2022届高三第一次综合测试(一模)化学试题(已下线)押广东卷化学第18题 化学工艺流程题-备战2022年高考化学临考题号押题(广东卷)福建省厦门第一中学2021-2022学年高一下学期5月月考化学试题
名校
10 . 多个专家研究组经过通力合作,设计了双单原子协同催化剂,该催化剂在协同作用下不仅可以最大程度上提高原子利用率,而且可以提高催化剂的选择性。4—硝基苯乙烯选择性加氢反应制备乙烯苯胺的反应如图,下列说法中错误的是
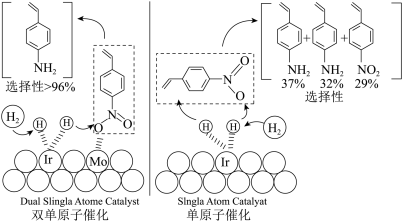
| A.Ir单原子位点促进氢气的活化,Mo和Ir的协同作用改变催化剂选择性 |
| B.从图示的催化过程可以发现,Mo单原子位点对4—硝基苯乙烯有较好的吸附效果 |
| C.在双单原子催化剂作用下,可以提高4—硝基苯乙烯的平衡转化率 |
| D.使用双单原子催化剂时,可以大大减少副反应的发生,提高乙烯苯胺的产率 |
您最近一年使用:0次
2021-12-23更新
|
1017次组卷
|
13卷引用:广东省六校2023届高三第一次联考化学试题
广东省六校2023届高三第一次联考化学试题广东省广州市六校2023届高三上学期8月第一次联考化学试题山东省实验中学2022届高三打靶化学试题广东省深圳市新安中学2022-2023学年高三上学期周末测试(2022.9.25)化学试题安徽省芜湖十二中2023届高三下学期二模化学试卷河南省部分重点高中2021-2022学年高三上学期12月调研考试化学试题(已下线)解密09 化学反应速率与化学平衡(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)黑龙江省大庆市2021-2022学年高三上学期第二次教学质量检测理科综合化学试题(已下线)回归教材重难点07 图像数据和结果的分析-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)回归教材重难点07 图像数据和结果的分析-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)河南省驻马店市2021-2022学年高二下学期期末考试化学试题河南省周口市太康县2022-2023学年高二上学期11月期中考试化学试题江西省南昌市第十九中学2022-2023学年高三上学期(10月)第三次月考化学试卷



