1 . CO、CH4和N2H4都可以作为燃料。回答下列问题:
(1)工业制氢气原理如下:CH4(g)+H2O(g)⇌CO(g)+3H2(g) △H=+206.4kJ·mol-1。该反应能自发进行的条件为_______ 。(选填“任何条件”、“低温”、“高温”、“任何条件均不能自发”)
(2)对于上述反应一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是_______ 。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
(3)恒温恒容条件下,以下能说明该反应达到平衡状态的是_______ 。
a.v消耗(CO)=v生成(H2O) b.c(H2O)=c(CO)
c.混合气体的总物质的量不再改变 d.混合气体的密度不再改变
e.混合气体平均相对分子质量不再改变 f.氢气的质量分数不再改变
(4)肼(N2H4)和NO2是一种双组分火箭推进剂。两种物质混合发生反应生成N2和H2O(g),已知8g气体肼在上述反应中放出142kJ热量,其热化学方程式为_______ 。
(1)工业制氢气原理如下:CH4(g)+H2O(g)⇌CO(g)+3H2(g) △H=+206.4kJ·mol-1。该反应能自发进行的条件为
(2)对于上述反应一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
(3)恒温恒容条件下,以下能说明该反应达到平衡状态的是
a.v消耗(CO)=v生成(H2O) b.c(H2O)=c(CO)
c.混合气体的总物质的量不再改变 d.混合气体的密度不再改变
e.混合气体平均相对分子质量不再改变 f.氢气的质量分数不再改变
(4)肼(N2H4)和NO2是一种双组分火箭推进剂。两种物质混合发生反应生成N2和H2O(g),已知8g气体肼在上述反应中放出142kJ热量,其热化学方程式为
您最近一年使用:0次
2 . CH4、CH3OH、CO等都是重要的能源,也是重要的化工原料。
(1)已知25℃、101kPa时,1g甲烷完全燃烧生成CO和液态水时放出38kJ热量,则该条件下反应的热化学反应方程式___________ 。
(2)为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量,有效地开发利用CO2,工业上可以用CO2来生产甲醇燃料。在体积为2L的密闭容器中,充入lmolCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。经测得CH3OH和CO2的物质的量随时间变化如图所示。
CH3OH(g)+H2O(g)。经测得CH3OH和CO2的物质的量随时间变化如图所示。
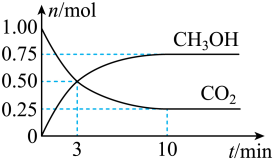
①从反应开始到平衡,CO2的平均反应速率v(CO2)=___________ 。
②达到平衡时,H2的转化率为___________ 。
(3)工业上也可以用CO和H2为原料制备CH3OH,反应方程式为:CO(g)+2H2(g) CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是
CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是___________ 。
A.反应中CO与CH3OH的物质的量之比为1:1
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗1molCO,同时生成1molCH3OH
D.CH3OH的质量分数在混合气体中保持不变
(1)已知25℃、101kPa时,1g甲烷完全燃烧生成CO和液态水时放出38kJ热量,则该条件下反应的热化学反应方程式
(2)为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量,有效地开发利用CO2,工业上可以用CO2来生产甲醇燃料。在体积为2L的密闭容器中,充入lmolCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)。经测得CH3OH和CO2的物质的量随时间变化如图所示。
CH3OH(g)+H2O(g)。经测得CH3OH和CO2的物质的量随时间变化如图所示。
①从反应开始到平衡,CO2的平均反应速率v(CO2)=
②达到平衡时,H2的转化率为
(3)工业上也可以用CO和H2为原料制备CH3OH,反应方程式为:CO(g)+2H2(g)
 CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是
CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是A.反应中CO与CH3OH的物质的量之比为1:1
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗1molCO,同时生成1molCH3OH
D.CH3OH的质量分数在混合气体中保持不变
您最近一年使用:0次
名校
解题方法
3 . 一定条件下的密闭容器中,发生可逆反应 ,下列情况不能说明该反应达到化学平衡的是
,下列情况不能说明该反应达到化学平衡的是
 ,下列情况不能说明该反应达到化学平衡的是
,下列情况不能说明该反应达到化学平衡的是A. 的质量恒定 的质量恒定 | B. 的质量分数保持不变 的质量分数保持不变 |
| C.正反应和逆反应的速率相等 | D. 、 、 、 、 的物质的量之比为 的物质的量之比为 |
您最近一年使用:0次
2023-04-28更新
|
914次组卷
|
20卷引用:辽宁省大连市第一中学2020-2021学年高一下学期期中(合格性)考试化学试题
辽宁省大连市第一中学2020-2021学年高一下学期期中(合格性)考试化学试题人教2019版必修第二册第六章第二节 化学反应的速率与限度课后习题辽宁省阜新市第二高级中学2019-2020学年高一下学期线上考试化学试题山东省2020年夏季普通高中学业水平合格考试模拟(一)化学试题云南省2021年高二上学期期末普通高中学业水平考试化学(新教材)试题广东省佛山市第四中学2021-2022学年高一下学期3月段考化学试题吉林省吉化第一高级中学校2021-2022学年高一下学期4月期中考试化学试题北京市北京师范大学附属实验中学2021-2022学年高一下学期期中考试化学试题北京师范大学附属实验中学2021-2022学年高一下学期期中考试化学试题云南省富源一中2021-2022学年高一下学期期末考试化学(文科)试题新疆额敏县第二中学2021-2022学年高一下学期期中考试化学试题黑龙江省饶河县高级中学2021-2022学年高一下学期学业水平(合格考)化学试题云南省2022年1月普通高中学业水平考试化学试题广东省茂名市电白区2021-2022学年高一下学期期中(选择性)考试化学试题浙江省宁波市姜山中学2022-2023学年高一下学期3月月考化学试题天津市天津市河西区2022-2023学年高一下学期4月期中考试化学试题广西钦州市浦北县2022-2023学年高一下学期4月期中考试化学试题云南省昆明市第一中学2022-2023学年高一下学期期中考试化学试题四川省甘孜藏族自治州某重点中学2023-2024学年高一下学期4月期中考试化学试题新疆维霍尔果斯市苏港中学2023-2024学年高一下学期4月月考化学试题
名校
解题方法
4 . 在一个不传热的固定容积的密闭容器中,可逆反应mA(g)+nB(g)  pC(g)+qD(g),当m、n、p、q为任意整数时,下列说法一定能说明反应已达到平衡的是
pC(g)+qD(g),当m、n、p、q为任意整数时,下列说法一定能说明反应已达到平衡的是
①体系的温度不再改变
②各组分的浓度相等
③各组分的质量分数不再改变
④反应速率v(A)∶v(B)=m∶n
⑤n·v正(A)=m·v逆(B)
⑥体系气体的平均相对分子质量不再改变
 pC(g)+qD(g),当m、n、p、q为任意整数时,下列说法一定能说明反应已达到平衡的是
pC(g)+qD(g),当m、n、p、q为任意整数时,下列说法一定能说明反应已达到平衡的是①体系的温度不再改变
②各组分的浓度相等
③各组分的质量分数不再改变
④反应速率v(A)∶v(B)=m∶n
⑤n·v正(A)=m·v逆(B)
⑥体系气体的平均相对分子质量不再改变
| A.①③⑤ | B.③⑤⑥ | C.①②⑤ | D.②⑤⑥ |
您最近一年使用:0次
2022-09-16更新
|
203次组卷
|
3卷引用:河北省邯郸市魏县第五中学2021-2022学年高二上学期期中考试化学试题
解题方法
5 . “绿水青山就是金山银山”,运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
(1)汽车是近代重要的交通运输工具,随着汽车量的激增,汽车尾气造成的环境污染也日益严重。汽车尾气中的有害成分主要有CO、NO、SO2、颗粒物和臭氧等。
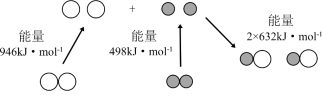
①汽车尾气中NO生成过程中的能量变化如图所示。1 mol N2和1 mol O2完全反应生成NO会_______ (填“吸收”或“放出”)_______ kJ能量。
②一种新型催化剂用于NO和CO的反应:NO+2CO2 CO2+N2为了测定在某种催化剂作用下该反应的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下表:
CO2+N2为了测定在某种催化剂作用下该反应的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下表:
前2 s内的平均反应速率v(N2)=_______ 。(保留小数点后一位)
③在容积固定的绝热容器中发生反应2NO+2CO 2CO2+N2,下列能说明该反应已达到平衡状态的是
2CO2+N2,下列能说明该反应已达到平衡状态的是_______ (填标号)
A.容器内混合气体温度不再变化 B.容器内的气体压强保持不变
C.2v逆(NO)=v正(N2) D.容器内混合气体密度保持不变
(2)煤燃烧排放的烟气中含有SO2和NO2,会形成酸雨,污染大气。
①NaClO2溶液在碱性条件下可对烟气进行脱硫、脱硝,效果非常好。完成下列对烟气脱氮过程的离子方程式:_______
_______ +_______NO+__________=_______Cl-+_______
+_______NO+__________=_______Cl-+_______ +______________。
+______________。
②针对含SO2的工业废气可以采用“钙基固硫法”。例如将生石灰与含硫的煤混合后再燃烧,可以将SO2最终转化为CaSO4,请写出生石灰将SO2转化为CaSO4的反应的化学方程式:_______
③将SO2转化为重要的化工原料H2SO4的原理示意图如图。
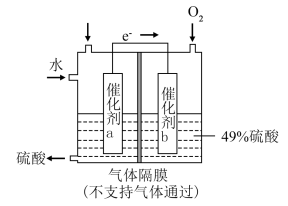
催化剂a表面的电极反应式为_______ 。若得到的硫酸质量分数仍为49%,则理论上参加反应的SO2与加入的H2O的质量比为_______ 。
(1)汽车是近代重要的交通运输工具,随着汽车量的激增,汽车尾气造成的环境污染也日益严重。汽车尾气中的有害成分主要有CO、NO、SO2、颗粒物和臭氧等。
①汽车尾气中NO生成过程中的能量变化如图所示。1 mol N2和1 mol O2完全反应生成NO会

②一种新型催化剂用于NO和CO的反应:NO+2CO2
 CO2+N2为了测定在某种催化剂作用下该反应的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下表:
CO2+N2为了测定在某种催化剂作用下该反应的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/(10-4 mol·L-1) | 10 | 4.5 | 2.5 | 1.5 | 1.0 | 1.0 |
| c(CO)/(10-3 mol·L-1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
前2 s内的平均反应速率v(N2)=
③在容积固定的绝热容器中发生反应2NO+2CO
 2CO2+N2,下列能说明该反应已达到平衡状态的是
2CO2+N2,下列能说明该反应已达到平衡状态的是A.容器内混合气体温度不再变化 B.容器内的气体压强保持不变
C.2v逆(NO)=v正(N2) D.容器内混合气体密度保持不变
(2)煤燃烧排放的烟气中含有SO2和NO2,会形成酸雨,污染大气。
①NaClO2溶液在碱性条件下可对烟气进行脱硫、脱硝,效果非常好。完成下列对烟气脱氮过程的离子方程式:
_______
 +_______NO+__________=_______Cl-+_______
+_______NO+__________=_______Cl-+_______ +______________。
+______________。②针对含SO2的工业废气可以采用“钙基固硫法”。例如将生石灰与含硫的煤混合后再燃烧,可以将SO2最终转化为CaSO4,请写出生石灰将SO2转化为CaSO4的反应的化学方程式:
③将SO2转化为重要的化工原料H2SO4的原理示意图如图。

催化剂a表面的电极反应式为
您最近一年使用:0次
名校
解题方法
6 . 在一容积不变,绝热的密闭容器中发生可逆反应:2X(s) Y(g)+Z(g),以下不能说明该反应达到化学平衡状态的是
Y(g)+Z(g),以下不能说明该反应达到化学平衡状态的是
 Y(g)+Z(g),以下不能说明该反应达到化学平衡状态的是
Y(g)+Z(g),以下不能说明该反应达到化学平衡状态的是| A.混合气体的密度不再变化 | B.反应容器中Y的质量分数不变 |
| C.该反应的化学平衡常数不变 | D.容器中混合气体的平均相对分子质量不变 |
您最近一年使用:0次
2021-10-28更新
|
660次组卷
|
8卷引用:浙江省五校2021-2022学年高三上学期10月第一次联考化学试题
浙江省五校2021-2022学年高三上学期10月第一次联考化学试题吉林省长春市希望高中2021-2022学年高二上学期期中考试化学试题(已下线)解密09 化学反应速率与化学平衡(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密09 化学反应速率与化学平衡(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)湖南省长沙市南雅中学2022-2023学年高二上学期第三次月考化学试题(已下线)考点22 化学平衡状态与化学平衡(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)第二章 章末训练河南省周口市文昌中学2023-2024学年高三上学期12月月考化学试题
名校
7 . CO和NO是汽车尾气中的主要污染物,易引起酸雨、温室效应和光化学烟雾等环境污染问题。随着我国机动车保有量的飞速发展,汽车尾气的有效处理变得迫在眉睫。其中的一种方法为2CO(g)+2NO(g)=N2(g)+2CO2(g),请回答下列问题:
(1)已知该反应为自发反应,则该反应的反应热△H___________ 0(填“>”或“<”或“=”)
(2)已知:N2 (g) + O2(g)=2NO(g) △H= a kJ•mol-1
C(s) + O2 (g)=CO2 (g) △H= b kJ•mol-1
2C(s) + O2 (g)=2CO(g) △H= c kJ•mol-1
则 2CO(g)+2NO(g)=N2 (g)+2CO2 (g) △H=___________ kJ•mol-1 (用含 a、b、c 的表达式表示)。
(3)一定温度下,将 2molCO、4molNO 充入一恒压密闭容器。已知起始压强为 1MPa,到达平衡时, 测得N2的物质的量为 0.5 mol,则:
①该温度此反应用平衡分压代替平衡浓度的平衡常数Kp=___________ (可用分数表示)
②该条件下,可判断此反应到达平衡的标志是___________
A.单位时间内,断裂 2 molC=O 同时形成 1 mol N≡N。
B.混合气体的密度不再改变。
C.混合气体的平均相对分子质量不再改变。
D.CO与NO的转化率比值不再改变。
(4)某研究小组探究催化剂对 CO、NO 转化的影响。将 CO 和 NO 以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中 N2的含量,从而确定尾气脱氮率(即 NO 的转化率),结果如图所示:

①由图可知:要达到最大脱氮率,该反应应采取的最佳实验条件为___________ ,
②高于 200℃,图中曲线 I 脱氮率随温度升高降低的主要原因为___________ 。
(5)已知常温下,Kb(NH3·H2O)=1.8×10-5,Ka1(H2CO3) =4.4×10-7,Ka2(H2CO3) =4.4×10-11。此温度下某氨水的浓度为 2mol/L,则溶液中c(OH-)=___________ mol/L,将脱氮反应后生成CO2通入氨水中使溶液恰好呈中性,则此时 =
=___________ 。(保留小数点后4位数字)
(6)电解NO制备NH4NO3,其工作原理如图所示:

写出阳极反应的电极反应方程式___________ ,为使电解产物全部转化为NH4NO3,需要补充物质A,A是___________ 。
(1)已知该反应为自发反应,则该反应的反应热△H
(2)已知:N2 (g) + O2(g)=2NO(g) △H= a kJ•mol-1
C(s) + O2 (g)=CO2 (g) △H= b kJ•mol-1
2C(s) + O2 (g)=2CO(g) △H= c kJ•mol-1
则 2CO(g)+2NO(g)=N2 (g)+2CO2 (g) △H=
(3)一定温度下,将 2molCO、4molNO 充入一恒压密闭容器。已知起始压强为 1MPa,到达平衡时, 测得N2的物质的量为 0.5 mol,则:
①该温度此反应用平衡分压代替平衡浓度的平衡常数Kp=
②该条件下,可判断此反应到达平衡的标志是
A.单位时间内,断裂 2 molC=O 同时形成 1 mol N≡N。
B.混合气体的密度不再改变。
C.混合气体的平均相对分子质量不再改变。
D.CO与NO的转化率比值不再改变。
(4)某研究小组探究催化剂对 CO、NO 转化的影响。将 CO 和 NO 以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中 N2的含量,从而确定尾气脱氮率(即 NO 的转化率),结果如图所示:

①由图可知:要达到最大脱氮率,该反应应采取的最佳实验条件为
②高于 200℃,图中曲线 I 脱氮率随温度升高降低的主要原因为
(5)已知常温下,Kb(NH3·H2O)=1.8×10-5,Ka1(H2CO3) =4.4×10-7,Ka2(H2CO3) =4.4×10-11。此温度下某氨水的浓度为 2mol/L,则溶液中c(OH-)=
 =
=(6)电解NO制备NH4NO3,其工作原理如图所示:

写出阳极反应的电极反应方程式
您最近一年使用:0次
名校
解题方法
8 . 在绝热的某刚性容器中置入1molF2和3molClF3,发生反应:F2(g)+ClF(g) ClF3(g)。下列说法中能够判断该反应一定处于平衡状态的有
ClF3(g)。下列说法中能够判断该反应一定处于平衡状态的有
 ClF3(g)。下列说法中能够判断该反应一定处于平衡状态的有
ClF3(g)。下列说法中能够判断该反应一定处于平衡状态的有| A.F2(g)与ClF(g)体积之比恒定不变 | B.F2(g)与ClF3(g)速率之比恒定不变 |
| C.混合物中Cl元素质量分数恒定不变 | D.断裂1molF—F键,同时生成3molF—Cl键 |
您最近一年使用:0次
2021-11-05更新
|
374次组卷
|
4卷引用:河北省承德隆化存瑞中学2021-2022学年高三上学期期中考试化学试题
名校
解题方法
9 . 在绝热的某刚性容器中置入1mol 和3mol
和3mol ,发生反应:
,发生反应: 。下列说法中能够判断该反应一定处于平衡状态的有
。下列说法中能够判断该反应一定处于平衡状态的有
 和3mol
和3mol ,发生反应:
,发生反应: 。下列说法中能够判断该反应一定处于平衡状态的有
。下列说法中能够判断该反应一定处于平衡状态的有A.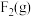 与 与 体积之比恒定不变 体积之比恒定不变 | B.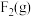 与 与 速率之比恒定不变 速率之比恒定不变 |
| C.混合物中Cl元素质量分数恒定不变 | D.容器中温度恒定不变 |
您最近一年使用:0次
名校
10 . 一定温度下,在2L的密闭容器中,M、N两种气体的物质的量随时间变化的曲线如图所示:

(1)反应的化学方程式为___________ 。
(2)反应达到化学平衡的时间是___________ min,该时间内的平均反应速率v(N)=___________ 。
(3)4min时,正、逆反应速率的大小关系为v正___________ v逆(填“>”“<”或“=”);
(4)一定温度下,将一定量的N2和H2充入固定容积催化剂的密闭容器中进行反应:N2(g)+3H2(g)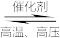 2NH3(g)。
2NH3(g)。
①下列描述能说明该可逆反应达到化学平衡状态的有___________ (填序号)。
A.容器内的压强不变
B.容器内气体的密度不变
C.相同时间内有3mol H-H键断裂,有6mol N-H键形成
D.c(N2):c(H2):c(NH3)=1︰3︰2
E.NH3的质量分数不再改变
②若起始时向容器中充入10mol·L-1的N2和15mol·L-1的H2,10min 时测得容器内NH3的浓度为1.5mol·L-1,10min内用N2表示的反应速率为___________ ;此时H2的转化率为___________ 。
(5)能加快反应速率的措施是___________ (填序号)
①升高温度 ②容器容积不变,充入惰性气体Ar ③容器压强不变,充入惰性气体Ar ④使用催化剂

(1)反应的化学方程式为
(2)反应达到化学平衡的时间是
(3)4min时,正、逆反应速率的大小关系为v正
(4)一定温度下,将一定量的N2和H2充入固定容积催化剂的密闭容器中进行反应:N2(g)+3H2(g)
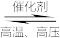 2NH3(g)。
2NH3(g)。①下列描述能说明该可逆反应达到化学平衡状态的有
A.容器内的压强不变
B.容器内气体的密度不变
C.相同时间内有3mol H-H键断裂,有6mol N-H键形成
D.c(N2):c(H2):c(NH3)=1︰3︰2
E.NH3的质量分数不再改变
②若起始时向容器中充入10mol·L-1的N2和15mol·L-1的H2,10min 时测得容器内NH3的浓度为1.5mol·L-1,10min内用N2表示的反应速率为
(5)能加快反应速率的措施是
①升高温度 ②容器容积不变,充入惰性气体Ar ③容器压强不变,充入惰性气体Ar ④使用催化剂
您最近一年使用:0次



