名校
1 . 图是可逆反应A+2B 2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断
2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断
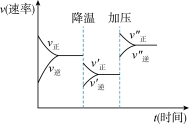
 2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断
2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断
| A.A、B、C、D均为气体 |
| B.若A、 B是气体,则C、 D是液体或固体 |
| C.温度越高,K越大 |
| D.在整个过程中,A的转化率一直增大 |
您最近一年使用:0次
2019-02-14更新
|
468次组卷
|
4卷引用:河北省石家庄市元氏县第四中学2019-2020学年高二上学期期末考试化学试题
11-12高二上·广东佛山·阶段练习
名校
2 . 反应CO+H2O (g)  CO2+H2在800℃达到平衡时分别改变下列条件,K值发生变化的是
CO2+H2在800℃达到平衡时分别改变下列条件,K值发生变化的是
 CO2+H2在800℃达到平衡时分别改变下列条件,K值发生变化的是
CO2+H2在800℃达到平衡时分别改变下列条件,K值发生变化的是| A.将压强减小至原来的一半 | B.将反应温度升高至1000℃ |
| C.添加催化剂 | D.增大水蒸气的浓度 |
您最近一年使用:0次
2019-01-30更新
|
1057次组卷
|
16卷引用:2013-2014学年河北省邯郸市高二上学期期末考试化学试卷
(已下线)2013-2014学年河北省邯郸市高二上学期期末考试化学试卷河北省安平中学2020-2021学年高二上学期第一次月考化学试题(已下线)2011-2012学年广东省佛山市罗村高级中学高二上学期第二阶段考试化学试卷(已下线)2011-2012学年陕西省西安市第一中学高二上学期期末考试化学(理)试卷(已下线)2011-2012学年江苏省盐城中学高二上学期期末考试化学(选修)试卷(已下线)2012-2013学年浙江省杭州市西湖高级中学高二5月月考化学试卷(已下线)2013-2014福建省师大附中高二上学期期末考试化学试卷2014-2015北京市66中高二上学期期中考试化学(理)试卷2015-2016学年福建省连江县尚德中学高二上期中考试化学试卷2015-2016学年陕西省黄陵中学高二上学期期末考试化学试卷黑龙江省齐齐哈尔市第八中学2018-2019学年高二上学期9月月考化学试题甘肃省靖远县第四中学2018-2019学年高二上学期第二次月考化学试题吉林省通化市梅河口市博文学校2019-2020学年高二上学期第一次月考化学试题河南省驻马店市正阳县高级中学2019-2020学年高二上学期第二次月考化学试题安徽省涡阳县育萃中学2020-2021学年高二上学期第一次月考化学试题黑龙江省牡丹江市海林市朝鲜族中学2021-2022学年高二上学期第三次月考化学试题
名校
3 . 某化学研究小组探究外界条件对化学反应mA(g)+nB(g) pC(g)的速率和平衡的影响,图像如下,下列判断正确的是
pC(g)的速率和平衡的影响,图像如下,下列判断正确的是
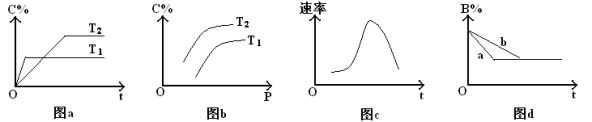
 pC(g)的速率和平衡的影响,图像如下,下列判断正确的是
pC(g)的速率和平衡的影响,图像如下,下列判断正确的是
| A.由图a可知,T1>T2,该反应的逆反应为吸热反应 |
| B.由图b可知,该反应m+n<p |
| C.图c是绝热条件下速率和时间的图像,由此说明该反应吸热 |
| D.图d中,若m+n=p,则曲线a一定增大了压强 |
您最近一年使用:0次
2018-10-31更新
|
1105次组卷
|
11卷引用:河北省唐山市开滦第二中学2019-2020学年高二上学期期中考试化学试题
河北省唐山市开滦第二中学2019-2020学年高二上学期期中考试化学试题重庆市铜梁一中2018-2019学年高二上学期10月月考化学试题吉林省长春市第151中学2019-2020学年高二上学期期中考试化学试题湖南省娄底市双峰县第一中学2020-2021学年高二上学期9月入学考试化学试题辽宁省黑山县黑山中学2020-2021学年高二10月月考化学试题吉林省长春市第一五一中学2020-2021学年高二上学期第一次月考化学试题(希望班)河南省安阳市第一中学2020-2021学年高二上学期第一次阶段考试化学试题吉林公主岭范家屯一中2020-2021学年高二上学期期中考试化学试题辽宁省大连市普兰店区第一中学2020-2021学年高二上学期第二阶段考试化学试题吉林省吉林市永吉县第四中学2021-2022学年高二上学期期中考试化学试题云南省保山市腾冲市第八中学2023-2024学年高二下学期开学化学试题
名校
4 . 对于平衡体系mA(g)+nB(g)⇌pC(g)+qD(g) △H=b kJ·mol-1,下列结论中错误的是
| A.若温度不变,将容器的体积缩小到原来的一半,达到新平衡时A的浓度为原来的2.2倍,则m+n<p+q |
| B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n |
| C.保持其它条件不变,升高温度,D的体积分数增大说明该反应的△H<0。 |
| D.若m+n=p+q,则向含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a mol |
您最近一年使用:0次
2018-07-25更新
|
284次组卷
|
7卷引用:河北省唐山市第一中学2018-2019学年高二上学期10月月考化学试题
解题方法
5 . 碳及其化合物在能源、材料等方面具有广泛的用途。回答下列问题:
(1)碳酸和草酸(H2C2O4)均为二元弱酸,其电离均为分步电离,二者的电离常数如下表:
①向碳酸钠溶液中滴加少量草酸溶液所发生反应的离子方程式为_____________ 。
②浓度均为0.1 mol·L−1的Na2CO3溶液、NaHCO3溶液、Na2C2O4溶液、NaHC2O4溶液,其溶液中H+浓度分别记作c1、c2、c3、c4。则四种溶液中H+浓度由大到小的顺序为________________ 。
(2)常温时,C和CO的标准燃烧热分别为−394.0 kJ·mol−1、−283.0 kJ·mol−1,该条件下C转化为CO的热化学方程式为____________________ 。
(3)氢气和一氧化碳在一定条件下可合成甲醇,反应如下:2H2(g)+CO(g) CH3OH(g) ΔH=Q kJ·mol−1
CH3OH(g) ΔH=Q kJ·mol−1
①该反应在不同温度下的化学平衡常数(K)如下表:
由此可判断Q______ (选填“ >”或“<”)0。
②一定温度下,将6 mol H2和2 mol CO充入体积为2 L的密闭容器中,10 min反应达到平衡状态,此时测得c(CO)=0.2 mol·L−1,该温度下的平衡常数K=____ ,0~10 min内反应速率v(CH3OH)=______ 。
③在两个密闭容器中分别都充入20 mol H2和10 mol CO,测得一氧化碳的平衡转化率随温度(T)、压强(p)的变化如图所示:

若A点对应容器的容积为20 L,则B点对应容器的容积为____ L。
(1)碳酸和草酸(H2C2O4)均为二元弱酸,其电离均为分步电离,二者的电离常数如下表:
| H2CO3 | H2C2O4 | |
| K1 | 4.2×10−7 | 5.4×10−2 |
| K2 | 5.6×10−11 | 5.4×10−5 |
①向碳酸钠溶液中滴加少量草酸溶液所发生反应的离子方程式为
②浓度均为0.1 mol·L−1的Na2CO3溶液、NaHCO3溶液、Na2C2O4溶液、NaHC2O4溶液,其溶液中H+浓度分别记作c1、c2、c3、c4。则四种溶液中H+浓度由大到小的顺序为
(2)常温时,C和CO的标准燃烧热分别为−394.0 kJ·mol−1、−283.0 kJ·mol−1,该条件下C转化为CO的热化学方程式为
(3)氢气和一氧化碳在一定条件下可合成甲醇,反应如下:2H2(g)+CO(g)
 CH3OH(g) ΔH=Q kJ·mol−1
CH3OH(g) ΔH=Q kJ·mol−1①该反应在不同温度下的化学平衡常数(K)如下表:
| 温度/℃ | 250 | 300 | 350 |
| K/L2·mol−2 | 2.041 | 0.270 | 0.012 |
由此可判断Q
②一定温度下,将6 mol H2和2 mol CO充入体积为2 L的密闭容器中,10 min反应达到平衡状态,此时测得c(CO)=0.2 mol·L−1,该温度下的平衡常数K=
③在两个密闭容器中分别都充入20 mol H2和10 mol CO,测得一氧化碳的平衡转化率随温度(T)、压强(p)的变化如图所示:

若A点对应容器的容积为20 L,则B点对应容器的容积为
您最近一年使用:0次
名校
6 . NOx是造成大气污染的主要物质,用还原法将其转化为无污染的物质,对于消除环境污染有重要意义。
(1) 已知:2C(s)+O2(g) 2CO(g) △H1= -221.0 kJ/mol
2CO(g) △H1= -221.0 kJ/mol
N2(g)+O2(g) 2NO (g) △H2= +180.5 kJ/mol
2NO (g) △H2= +180.5 kJ/mol
2NO(g)+2CO(g) 2CO2(g)+N2(g) △H3= -746.0 kJ/mol
2CO2(g)+N2(g) △H3= -746.0 kJ/mol
回答下列问题:
①用焦炭还原NO生成无污染气体的热化学方程式为_______ 。
②在一定温度下,向甲、乙、丙三个恒容密闭容器中加入一定量的NO和足量的焦炭,反应过程中测得各容器中c(NO)(mol/L)随时间(s)的变化如下表。
已知:三个容器的反应温度分别为T甲= 400℃、T乙= 400℃、T丙= a ℃
甲容器中,该反应的平衡常数K=_______ 。丙容器的反应温度a _______ 400℃(填“˃”、“<”或“=”),理由是_______ 。
(2)用NH3催化还原NOx消除氮氧化物的污染。
已知:8NH3(g)+6NO2(g) 7N2(g) +12H2O(l) △H<0。相同条件下,在2 L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间变化如图所示。
7N2(g) +12H2O(l) △H<0。相同条件下,在2 L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间变化如图所示。

①在催化剂A的作用下,0~4 min的v(NH3) =_______ 。
②该反应活化能Ea(A)、Ea(B)、Ea(C)由大到小的顺序是_______ ,理由是_______ 。
③下列说法正确的是_______ (填标号)。
a.使用催化剂A达平衡时,△H值更大
b.升高温度可使容器内气体颜色加深
c.单位时间内形成N-H键与O-H键的数目相等时,说明反应已经达到平衡
d.若在恒容绝热的密闭容器中反应,当平衡常数不变时,说明反应已经达到平衡
(1) 已知:2C(s)+O2(g)
 2CO(g) △H1= -221.0 kJ/mol
2CO(g) △H1= -221.0 kJ/molN2(g)+O2(g)
 2NO (g) △H2= +180.5 kJ/mol
2NO (g) △H2= +180.5 kJ/mol2NO(g)+2CO(g)
 2CO2(g)+N2(g) △H3= -746.0 kJ/mol
2CO2(g)+N2(g) △H3= -746.0 kJ/mol回答下列问题:
①用焦炭还原NO生成无污染气体的热化学方程式为
②在一定温度下,向甲、乙、丙三个恒容密闭容器中加入一定量的NO和足量的焦炭,反应过程中测得各容器中c(NO)(mol/L)随时间(s)的变化如下表。
已知:三个容器的反应温度分别为T甲= 400℃、T乙= 400℃、T丙= a ℃
| 时间 | 0 s | 10 s | 20 s | 30 s | 40 s |
| 甲 | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| 乙 | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
| 丙 | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
甲容器中,该反应的平衡常数K=
(2)用NH3催化还原NOx消除氮氧化物的污染。
已知:8NH3(g)+6NO2(g)
 7N2(g) +12H2O(l) △H<0。相同条件下,在2 L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间变化如图所示。
7N2(g) +12H2O(l) △H<0。相同条件下,在2 L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间变化如图所示。
①在催化剂A的作用下,0~4 min的v(NH3) =
②该反应活化能Ea(A)、Ea(B)、Ea(C)由大到小的顺序是
③下列说法正确的是
a.使用催化剂A达平衡时,△H值更大
b.升高温度可使容器内气体颜色加深
c.单位时间内形成N-H键与O-H键的数目相等时,说明反应已经达到平衡
d.若在恒容绝热的密闭容器中反应,当平衡常数不变时,说明反应已经达到平衡
您最近一年使用:0次
2018-06-06更新
|
1060次组卷
|
2卷引用:【全国百强校】河北省石家庄市第二中学2019届高三下学期4月月考理科综合化学试题
名校
7 . 在一化学平衡状态体系中,发生下列量的变化,其中一定会使平衡发生移动的是( )
| A.体系的压强 | B.反应物的浓度 |
| C.正、逆反应速率 | D.反应物的转化率 |
您最近一年使用:0次
2018-04-17更新
|
261次组卷
|
5卷引用:河北省邯郸市(大名县、永年区、磁县、邯山区)四县2016-2017学年高二下学期期中联考化学试题
名校
8 . 国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:CO2(g) + 4H2(g) CH4(g) + 2H2O(g),若温度从300℃升至400℃,反应重新达到平衡时,H2的体积分数增加。下列关于该过程的判断正确的是
CH4(g) + 2H2O(g),若温度从300℃升至400℃,反应重新达到平衡时,H2的体积分数增加。下列关于该过程的判断正确的是
 CH4(g) + 2H2O(g),若温度从300℃升至400℃,反应重新达到平衡时,H2的体积分数增加。下列关于该过程的判断正确的是
CH4(g) + 2H2O(g),若温度从300℃升至400℃,反应重新达到平衡时,H2的体积分数增加。下列关于该过程的判断正确的是| A.该反应的ΔH < 0 | B.化学平衡常数K增大 |
| C.CO2的转化率增加 | D.正反应速率增大,逆反应速率减小 |
您最近一年使用:0次
2018-01-20更新
|
748次组卷
|
11卷引用:河北省张家口第一中学2019-2020学年高二9月月考化学试题
河北省张家口第一中学2019-2020学年高二9月月考化学试题河北省张家口市宣化区宣化第一中学2020-2021学年高二上学期9月月考化学试题北京市丰台区2018届高三上学期期末考试化学试题(已下线)【中等生百日捷进提升系列-技能方法】专题09 化学反应速率化学平衡类选择题解题方法和策略【全国百强校】北京市北京四中2019届高三上学期期中考试化学试题北京市海淀区101中学2018-2019学年下学期高二期中考试化学试题北京市第十五中学2018-2019学年高三上学期期中考试化学试题广东省肇庆市广宁第一中学2021届高三上学期9月月考化学试题湖北省黄冈市罗田县第一中学2020-2021学年高二10月月考化学试题黑龙江省哈尔滨师范大学青冈实验中学校2020-2021学年高二10月月考化学试题福建省建瓯市芝华中学2020-2021学年高二上学期期中考试化学(选考班)试题
2016高二·全国·课时练习
名校
9 . 对处于化学平衡的体系,由化学平衡与化学反应速率的关系可知
| A.化学反应速率变化时,化学平衡一定发生移动 |
| B.化学平衡发生移动时,化学反应速率一定变化 |
| C.正反应进行的程度大,正反应速率一定大 |
| D.改变压强,化学反应速率一定改变,平衡一定移动 |
您最近一年使用:0次
2017-11-27更新
|
1420次组卷
|
14卷引用:河北省石家庄市康福外国语学校2020-2021学年高二10月月考化学试题
河北省石家庄市康福外国语学校2020-2021学年高二10月月考化学试题(已下线)同步君 人教版 选修4 第2章 第3节 化学平衡状态高中化学人教版 选修四 第二章 化学反应速率和化学平衡 第三节 化学平衡 化学平衡第二课时(化学平衡状态)【全国百强校】内蒙古赤峰二中2017-2018学年高二下学期第二次月考化学试题河南省林州一中分校(林虑中学)2018-2019学年高二上学期8月调研考试化学试题四川省遂宁市2018-2019学年高二下学期期末考试化学试题【懂做原理题】2020届高三化学选修4二轮专题练——化学平衡状态及其判断【精编25题】四川省自贡市田家炳中学2019-2020学年高二下学期开学考试化学试题浙江省宁波市咸祥中学2021-2022学年高二上学期期中考试化学试题(已下线)2.3.1 浓度、压强变化对化学平衡的影响(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)第二节 化学平衡 第3课时 影响化学平衡的因素云南省砚山县第二高级中学2021-2022学年高二下学期期中(4月)考试化学试题第2课时 浓度、压强对化学平衡的影响上海市宝山区上海大学附属中学2022-2023学年高二上学期期中考试化学试题
2017高二·全国·课时练习
名校
10 . 下列变化一定会引起平衡移动的是
①反应速率的变化 ②浓度的变化 ③各组分百分含量的变化 ④平均相对分子质量的变化 ⑤颜色的变化 ⑥混合气体密度的变化 ⑦转化率的变化 ⑧温度的变化
①反应速率的变化 ②浓度的变化 ③各组分百分含量的变化 ④平均相对分子质量的变化 ⑤颜色的变化 ⑥混合气体密度的变化 ⑦转化率的变化 ⑧温度的变化
| A.①②⑥⑦⑧ | B.②④⑤⑥⑧ |
| C.②④⑤⑥⑦ | D.③④⑦⑧ |
您最近一年使用:0次
2017-11-23更新
|
1101次组卷
|
11卷引用:河北省石家庄市第二中学2019-2020高一下学期期末考试模拟化学试题(一)
河北省石家庄市第二中学2019-2020高一下学期期末考试模拟化学试题(一)(已下线)2.3.2 影响化学平衡状态的因素安徽省江淮名校2017-2018学年高二期中考试化学试题高中化学人教版 选修四 第二章 化学反应速率和化学平衡 第三节 化学平衡 化学平衡第二课时(化学平衡状态)(已下线)2018年9月16日 《每日一题》人教选修4-每周一测(已下线)2019年9月15日 《每日一题》选修4—— 每周一测山西省应县第一中学校2019-2020学年高二上学期第一次月考化学试题江西省上饶市横峰中学、铅山一中、弋阳一中2020-2021学年高二上学期开学联考化学试题(课改班)甘肃省武威第一中学2020-2021学年高二上学期期中考试化学试题辽宁省丹东市凤城市第一中学2021-2022学年高二上学期10月份月考化学试题陕西省西安市西航一中2021-2022学年高二下学期第一次月考试题



