解题方法
1 . 丙烯是一种重要的化工原料,工业上丙烷制丙烯的相关反应如下:
ⅰ.
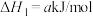
ⅱ.

ⅲ.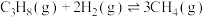
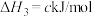
回答下列问题:
Ⅰ.单独投料(副反应抑制法)。
(1)反应: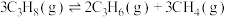

_________  。
。
(2) 时,单独加入
时,单独加入 至
至 后达到平衡,体系中部分组分(仅考虑表内转化)的体积分数
后达到平衡,体系中部分组分(仅考虑表内转化)的体积分数 见下表。
见下表。
①若只考虑体系中反应ⅱ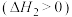 ,以下操作有利于减小
,以下操作有利于减小 平衡转化率的是
平衡转化率的是___________ (填字母)。
A.通入少量 B.使用高选择性催化剂 C.降温 D.减压
B.使用高选择性催化剂 C.降温 D.减压
② 内
内 消耗的平均速率:反应ⅰ
消耗的平均速率:反应ⅰ_________ 反应ⅱ(填“<”、“>”或“=”)。
(3)一定温度下,向 恒容密闭容器中通入
恒容密闭容器中通入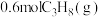 ,压强为
,压强为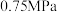 ,若只考虑反应ⅰ、ⅱ,反应后测得各组分的平衡压强(即组分的物质的量分数
,若只考虑反应ⅰ、ⅱ,反应后测得各组分的平衡压强(即组分的物质的量分数 总压)为
总压)为 、
、 ,则该温度下,用物质的量浓度表示反应Ⅰ的平衡常数
,则该温度下,用物质的量浓度表示反应Ⅰ的平衡常数
___________ 。
Ⅱ.共进料投料(耦合反应法)。
工业上也常采用 与
与 共进料投料,通过发生耦合反应制丙烯,反应如下:
共进料投料,通过发生耦合反应制丙烯,反应如下:
(4) 为用压强表示的反应平衡常数,一定温度下:
为用压强表示的反应平衡常数,一定温度下:
ⅰ.
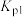
ⅳ.
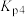
则体系中反应

___________ (用含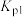 、
、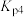 的式子表示)。
的式子表示)。
(5)实际工艺生产中按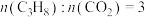 进料,平衡体系中部分组分的体积分数与温度的关系如图所示,综合反应分析:
进料,平衡体系中部分组分的体积分数与温度的关系如图所示,综合反应分析:________ (填“吸热”或“放热”)反应,在________ (填“高温”或“低温”)下进行自发反应。
②生产中温度须不低于 ,原因是
,原因是___________ 。
ⅰ.

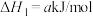
ⅱ.


ⅲ.
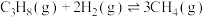
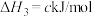
回答下列问题:
Ⅰ.单独投料(副反应抑制法)。
(1)反应:
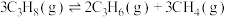

 。
。(2)
 时,单独加入
时,单独加入 至
至 后达到平衡,体系中部分组分(仅考虑表内转化)的体积分数
后达到平衡,体系中部分组分(仅考虑表内转化)的体积分数 见下表。
见下表。| 物质 |  |  |  |  |
体积分数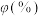 | 18 | 20 | 47 | 0 |
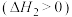 ,以下操作有利于减小
,以下操作有利于减小 平衡转化率的是
平衡转化率的是A.通入少量
 B.使用高选择性催化剂 C.降温 D.减压
B.使用高选择性催化剂 C.降温 D.减压②
 内
内 消耗的平均速率:反应ⅰ
消耗的平均速率:反应ⅰ(3)一定温度下,向
 恒容密闭容器中通入
恒容密闭容器中通入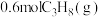 ,压强为
,压强为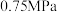 ,若只考虑反应ⅰ、ⅱ,反应后测得各组分的平衡压强(即组分的物质的量分数
,若只考虑反应ⅰ、ⅱ,反应后测得各组分的平衡压强(即组分的物质的量分数 总压)为
总压)为 、
、 ,则该温度下,用物质的量浓度表示反应Ⅰ的平衡常数
,则该温度下,用物质的量浓度表示反应Ⅰ的平衡常数
Ⅱ.共进料投料(耦合反应法)。
工业上也常采用
 与
与 共进料投料,通过发生耦合反应制丙烯,反应如下:
共进料投料,通过发生耦合反应制丙烯,反应如下:
(4)
 为用压强表示的反应平衡常数,一定温度下:
为用压强表示的反应平衡常数,一定温度下:ⅰ.

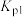
ⅳ.

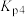
则体系中反应


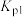 、
、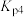 的式子表示)。
的式子表示)。(5)实际工艺生产中按
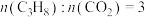 进料,平衡体系中部分组分的体积分数与温度的关系如图所示,综合反应分析:
进料,平衡体系中部分组分的体积分数与温度的关系如图所示,综合反应分析: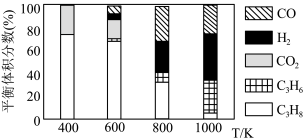
②生产中温度须不低于
 ,原因是
,原因是
您最近一年使用:0次
2 . 氯化亚铜( )广泛应用于冶金工业,也用作催化剂和杀菌剂。以硫化铜精矿为原料生产
)广泛应用于冶金工业,也用作催化剂和杀菌剂。以硫化铜精矿为原料生产 的工艺如下:
的工艺如下: 难溶于醇和水,溶于
难溶于醇和水,溶于 较大的体系
较大的体系 ,潮湿空气中易水解氧化。
,潮湿空气中易水解氧化。
(1)步骤1是“氧化酸浸”的过程,该过程生成蓝色溶液和浅黄色沉淀,化学方程式是___________ 。
(2)步骤2是溶解过程,溶解时反应的离子方程式___________ 。
(3)步骤3为主反应, 的沉淀率与加入的
的沉淀率与加入的 的量关系如图所示。
的量关系如图所示。___________ ;
②比较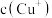 相对大小:A点
相对大小:A点___________ C点(填“>”、“<”或“=”);
③提高C点状态混合物中 沉淀率的措施是
沉淀率的措施是___________ ;
(4)步骤4进行的实验操作是___________ ;
(5)洗涤过程中不能用硝酸代替硫酸进行“酸洗”,理由是___________ 。用乙醇洗涤的目的是___________ 。
(6)产品纯度测定:称取 产品a g于锥形瓶中,加入足量的酸性
产品a g于锥形瓶中,加入足量的酸性 溶液使其充分溶解,然后用
溶液使其充分溶解,然后用
 标准溶液滴定
标准溶液滴定 ,消耗
,消耗 溶液b mL。(本实验中
溶液b mL。(本实验中 的被还原为
的被还原为 ,不与产品中杂质和
,不与产品中杂质和 反应)。
反应)。
① 溶于
溶于 溶液的离子方程式是
溶液的离子方程式是___________ 。
②产品中 (摩尔质量为99g/mol)的质量分数为
(摩尔质量为99g/mol)的质量分数为___________ 。
 )广泛应用于冶金工业,也用作催化剂和杀菌剂。以硫化铜精矿为原料生产
)广泛应用于冶金工业,也用作催化剂和杀菌剂。以硫化铜精矿为原料生产 的工艺如下:
的工艺如下:
 难溶于醇和水,溶于
难溶于醇和水,溶于 较大的体系
较大的体系 ,潮湿空气中易水解氧化。
,潮湿空气中易水解氧化。(1)步骤1是“氧化酸浸”的过程,该过程生成蓝色溶液和浅黄色沉淀,化学方程式是
(2)步骤2是溶解过程,溶解时反应的离子方程式
(3)步骤3为主反应,
 的沉淀率与加入的
的沉淀率与加入的 的量关系如图所示。
的量关系如图所示。
②比较
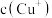 相对大小:A点
相对大小:A点③提高C点状态混合物中
 沉淀率的措施是
沉淀率的措施是(4)步骤4进行的实验操作是
(5)洗涤过程中不能用硝酸代替硫酸进行“酸洗”,理由是
(6)产品纯度测定:称取
 产品a g于锥形瓶中,加入足量的酸性
产品a g于锥形瓶中,加入足量的酸性 溶液使其充分溶解,然后用
溶液使其充分溶解,然后用
 标准溶液滴定
标准溶液滴定 ,消耗
,消耗 溶液b mL。(本实验中
溶液b mL。(本实验中 的被还原为
的被还原为 ,不与产品中杂质和
,不与产品中杂质和 反应)。
反应)。①
 溶于
溶于 溶液的离子方程式是
溶液的离子方程式是②产品中
 (摩尔质量为99g/mol)的质量分数为
(摩尔质量为99g/mol)的质量分数为
您最近一年使用:0次
2023-05-31更新
|
709次组卷
|
7卷引用:陕西省西安工业大学附属中学2023-2024学年高三下学期第七次适应性考试理综试题-高中化学
3 . 铬是硬度最高的金属,具有良好的抗腐蚀性的耐磨性,常用于制造不锈钢和仪器仪表的金属表面镀铬,用途十分广泛。
(1)铬的常见的氧化——三氧化二铬( ),既能与KOH溶液反应生成
),既能与KOH溶液反应生成 ,又能与硫酸反应生成
,又能与硫酸反应生成 。
。 是
是___________ (填“酸性”“碱性”或“两性”)氧化物, 与过量KOH溶液反应的离子方程式为
与过量KOH溶液反应的离子方程式为___________ 。
(2)已知: ,Cr(Ⅲ)体现还原性生成
,Cr(Ⅲ)体现还原性生成 或
或 。在碱性介质中Cr(Ⅲ)有较强的还原性,可使
。在碱性介质中Cr(Ⅲ)有较强的还原性,可使 —淀粉溶液褪色,反应过程中铬元素由
—淀粉溶液褪色,反应过程中铬元素由___________ 转化为___________ (填离子符号);在酸性介质中Cr(Ⅲ)还原性较差,可与强氧化剂反应,可将 还原为
还原为 ,其反应的离子方程式为
,其反应的离子方程式为___________ 。
(3) 中铬元素的化合价为
中铬元素的化合价为___________ ;将 溶液滴加到淀粉——KI溶液中,溶液变蓝;可使
溶液滴加到淀粉——KI溶液中,溶液变蓝;可使 、
、 和
和 在不同酸碱性条件下氧化性的大小关系是
在不同酸碱性条件下氧化性的大小关系是___________ 。
(1)铬的常见的氧化——三氧化二铬(
 ),既能与KOH溶液反应生成
),既能与KOH溶液反应生成 ,又能与硫酸反应生成
,又能与硫酸反应生成 。
。 是
是 与过量KOH溶液反应的离子方程式为
与过量KOH溶液反应的离子方程式为(2)已知:
 ,Cr(Ⅲ)体现还原性生成
,Cr(Ⅲ)体现还原性生成 或
或 。在碱性介质中Cr(Ⅲ)有较强的还原性,可使
。在碱性介质中Cr(Ⅲ)有较强的还原性,可使 —淀粉溶液褪色,反应过程中铬元素由
—淀粉溶液褪色,反应过程中铬元素由 还原为
还原为 ,其反应的离子方程式为
,其反应的离子方程式为(3)
 中铬元素的化合价为
中铬元素的化合价为 溶液滴加到淀粉——KI溶液中,溶液变蓝;可使
溶液滴加到淀粉——KI溶液中,溶液变蓝;可使 、
、 和
和 在不同酸碱性条件下氧化性的大小关系是
在不同酸碱性条件下氧化性的大小关系是
您最近一年使用:0次
名校
解题方法
4 . 工业上常用 碱性溶液吸收工业废气中的
碱性溶液吸收工业废气中的 .为了提高吸收效率,常用
.为了提高吸收效率,常用 作为催化剂,在反应过程中产生的四价镍和氧原子具有极强的氧化能力,可加快对
作为催化剂,在反应过程中产生的四价镍和氧原子具有极强的氧化能力,可加快对 的吸收,该催化过程如图所示:
的吸收,该催化过程如图所示:
 碱性溶液吸收工业废气中的
碱性溶液吸收工业废气中的 .为了提高吸收效率,常用
.为了提高吸收效率,常用 作为催化剂,在反应过程中产生的四价镍和氧原子具有极强的氧化能力,可加快对
作为催化剂,在反应过程中产生的四价镍和氧原子具有极强的氧化能力,可加快对 的吸收,该催化过程如图所示:
的吸收,该催化过程如图所示: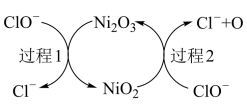
A.过程1中,氧化剂与还原剂的物质的量之比是 |
B.过程2的离子方程式是: |
C.吸收反应的总方程式是: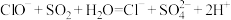 |
D.用 代替 代替 脱硫效果更好 脱硫效果更好 |
您最近一年使用:0次
2021-05-21更新
|
549次组卷
|
10卷引用:陕西省西安市周至县第六中学2023-2024学年高三上学期11月期中化学试题
陕西省西安市周至县第六中学2023-2024学年高三上学期11月期中化学试题山东省潍坊市四县市(安丘,诸城,五莲,兰山)2021届高考模拟化学试题(已下线)第05讲 氧化还原反应(练) — 2022年高考化学一轮复习讲练测(新教材新高考)新疆石河子第一中学2021-2022学年高三上学期8月月考(A卷)化学试题陕西省西安市长安区第一中学2021-2022学年高二下学期期中考试化学试题山东省济宁邹城市第二中学2022-2023学年高三9月月考化学试题安徽省滁州市定远县炉桥中学2020-2021学年高一上学期第一次质量检测化学试题福建省仙游第一中学2021-2022学年高一上学期期末考试化学试题山东省莱州市第一中学2022-2023学年高二下学期6月月考化学试题江西省南昌十九中2022-2023学年高一下学期5月月考化学试卷
解题方法
5 . NO、NO2是大气污染物,但只要合理利用,NO、NO2也是重要的资源。回答下列问题:
(1)氨的合成。已知:N2和H2生成NH3的反应为: N2(g)+
N2(g)+ H2(g)
H2(g) NH3(g) ΔH=-46.2kJ·mol-1
NH3(g) ΔH=-46.2kJ·mol-1
在Fe催化剂作用下的反应历程为(※表示吸附态):
化学吸附:N2(g)→2N※;H2(g) 2H※;
2H※;
表面反应:N※+H※ NH※;NH※+H※
NH※;NH※+H※ NH2※;NH2※+H※
NH2※;NH2※+H※ NH3※;
NH3※;
脱附:NH3※ NH3(g)
NH3(g)
其中N2的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。则利于提高合成氨平衡产率的条件有( )
A.低温 B.高温 C.低压 D.高压 E.催化剂
(2)NH3还原法可将NO还原为N2进行脱除。已知:
①4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH1=-1530kJ·mol-1
②N2(g)+O2(g)=2NO(g) ΔH2=+180kJ·mol-1
写出NH3还原NO的热化学方程式__ 。
(3)亚硝酰氯(ClNO)是合成有机物的中间体。将一定量的NO与Cl2充入一密闭容器中,发生反应:2NO(g)+Cl2(g) 2ClNO(g) △H<0。平衡后,改变外界条件X,测得NO的转化率α(NO)随X的变化如图所示,则条件X可能是
2ClNO(g) △H<0。平衡后,改变外界条件X,测得NO的转化率α(NO)随X的变化如图所示,则条件X可能是__ (填字母代号)。

a.温度 b.压强 c.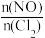 d.与催化剂的接触面积
d.与催化剂的接触面积
(4)在密闭容器中充入4molCO和5molNO发生反应2NO(g)+2CO(g) N2(g)+2CO2(g) △H=-746.5kJ•mol-1,如图甲为平衡时NO的体积分数与温度、压强的关系曲线图。
N2(g)+2CO2(g) △H=-746.5kJ•mol-1,如图甲为平衡时NO的体积分数与温度、压强的关系曲线图。
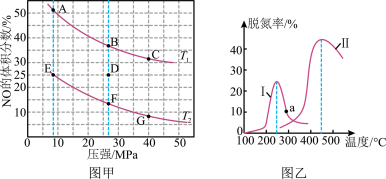
①温度T1__ T2(填“>”或“<”)。
②若反应在D点达到平衡,此时对反应进行升温且同时扩大容器体积使平衡压强减小,则重新达到平衡时,D点应向图中A~G点中的__ 点移动。
③探究催化剂对CO、NO转化的影响。某研究小组将NO和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NO含量,从而确定尾气脱氮率(即NO的转化率),结果如图乙所示。温度低于200℃时,图中曲线I脱氮率随温度升高而变化不大的主要原因为__ ;a点__ (填“是”或“不是”)对应温度下的平衡脱氮率,说明其理由__ 。
(1)氨的合成。已知:N2和H2生成NH3的反应为:
 N2(g)+
N2(g)+ H2(g)
H2(g) NH3(g) ΔH=-46.2kJ·mol-1
NH3(g) ΔH=-46.2kJ·mol-1在Fe催化剂作用下的反应历程为(※表示吸附态):
化学吸附:N2(g)→2N※;H2(g)
 2H※;
2H※;表面反应:N※+H※
 NH※;NH※+H※
NH※;NH※+H※ NH2※;NH2※+H※
NH2※;NH2※+H※ NH3※;
NH3※;脱附:NH3※
 NH3(g)
NH3(g)其中N2的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。则利于提高合成氨平衡产率的条件有
A.低温 B.高温 C.低压 D.高压 E.催化剂
(2)NH3还原法可将NO还原为N2进行脱除。已知:
①4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH1=-1530kJ·mol-1
②N2(g)+O2(g)=2NO(g) ΔH2=+180kJ·mol-1
写出NH3还原NO的热化学方程式
(3)亚硝酰氯(ClNO)是合成有机物的中间体。将一定量的NO与Cl2充入一密闭容器中,发生反应:2NO(g)+Cl2(g)
 2ClNO(g) △H<0。平衡后,改变外界条件X,测得NO的转化率α(NO)随X的变化如图所示,则条件X可能是
2ClNO(g) △H<0。平衡后,改变外界条件X,测得NO的转化率α(NO)随X的变化如图所示,则条件X可能是
a.温度 b.压强 c.
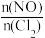 d.与催化剂的接触面积
d.与催化剂的接触面积(4)在密闭容器中充入4molCO和5molNO发生反应2NO(g)+2CO(g)
 N2(g)+2CO2(g) △H=-746.5kJ•mol-1,如图甲为平衡时NO的体积分数与温度、压强的关系曲线图。
N2(g)+2CO2(g) △H=-746.5kJ•mol-1,如图甲为平衡时NO的体积分数与温度、压强的关系曲线图。
①温度T1
②若反应在D点达到平衡,此时对反应进行升温且同时扩大容器体积使平衡压强减小,则重新达到平衡时,D点应向图中A~G点中的
③探究催化剂对CO、NO转化的影响。某研究小组将NO和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NO含量,从而确定尾气脱氮率(即NO的转化率),结果如图乙所示。温度低于200℃时,图中曲线I脱氮率随温度升高而变化不大的主要原因为
您最近一年使用:0次
名校
6 . 冬季是雾霾天气高发的季节,其中汽车尾气和燃煤尾气是造成雾霾的原因之一。
(1)使用甲醇汽油可以减少汽车尾气对环境的污染。工业上在200℃和10MPa的条件下可用甲烷和氧气通过铜制管道反应制得甲醇,已知一定条件下,CH4和CH3OH的燃烧热分别784kJ/mol和628kJ/mol则2CH4(g)+O2(g)=2CH3OH(g) △H=___ 。
(2)二甲醚也是清洁能源。用合成气在催化剂存在下制备二甲醚的反应原理为:2CO(g)+4H2(g)⇌CH3OCH3(g) +H2O(g) △H<0。
①某温度下,将2.0molCO(g)和6.0molH2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如图所示,关于温度和压强的关系判断正确的是____ 。

A.P3>P2,T3>T2
B.P1>P3,T1>T3
C.P1>P4,T2>T3
D.P2>P4,T4>T2
②在恒容密闭容器里按体积比为1:3充入一氧化碳和氢 气,一定条件下反应达到平衡状态.当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是___ 。
A.氢气的转化率减小 B.逆反应速率先增大后减小
C.化学平衡常数K值增大 D.反应物的体积百分含量增大
(3)汽车尾气净化的主要原理为:2NO(g)+2CO(g)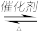 2CO2(g) +N2(g)
2CO2(g) +N2(g)
①200K、pPa时,在一个容积为2L的恒温密闭容器中充入1.5molNO和2.0molCO,开始反应至2min时测得CO转化率为30%,则用N2表示的平均反应速率为υ(N2)=___ ;反应达到平衡状态时,测得二氧化碳为0.8mol,则平衡时的压强为起始压强的__ 倍(保留两位小数)。
②该反应在低温下能自发进行,该反应的ΔH__ 0(填“>”、“<”)
③在某一绝热、恒容的密闭容器中充入一定量的NO、CO发生上述反应,测得正反应的速率随时间变化的曲线如图所示(已知:t2-t1=t3-t2)则下列说法不正确的是__ (填编号)

A.反应在c点未达到平衡状态
B.反应速率a点小于b点
C.反应物浓度a点大于b点
D.NO的转化率:t1~t2 > t2~t3
(1)使用甲醇汽油可以减少汽车尾气对环境的污染。工业上在200℃和10MPa的条件下可用甲烷和氧气通过铜制管道反应制得甲醇,已知一定条件下,CH4和CH3OH的燃烧热分别784kJ/mol和628kJ/mol则2CH4(g)+O2(g)=2CH3OH(g) △H=
(2)二甲醚也是清洁能源。用合成气在催化剂存在下制备二甲醚的反应原理为:2CO(g)+4H2(g)⇌CH3OCH3(g) +H2O(g) △H<0。
①某温度下,将2.0molCO(g)和6.0molH2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如图所示,关于温度和压强的关系判断正确的是

A.P3>P2,T3>T2
B.P1>P3,T1>T3
C.P1>P4,T2>T3
D.P2>P4,T4>T2
②在恒容密闭容器里按体积比为1:3充入一氧化碳和氢 气,一定条件下反应达到平衡状态.当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是
A.氢气的转化率减小 B.逆反应速率先增大后减小
C.化学平衡常数K值增大 D.反应物的体积百分含量增大
(3)汽车尾气净化的主要原理为:2NO(g)+2CO(g)
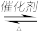 2CO2(g) +N2(g)
2CO2(g) +N2(g)①200K、pPa时,在一个容积为2L的恒温密闭容器中充入1.5molNO和2.0molCO,开始反应至2min时测得CO转化率为30%,则用N2表示的平均反应速率为υ(N2)=
②该反应在低温下能自发进行,该反应的ΔH
③在某一绝热、恒容的密闭容器中充入一定量的NO、CO发生上述反应,测得正反应的速率随时间变化的曲线如图所示(已知:t2-t1=t3-t2)则下列说法不正确的是

A.反应在c点未达到平衡状态
B.反应速率a点小于b点
C.反应物浓度a点大于b点
D.NO的转化率:t1~t2 > t2~t3
您最近一年使用:0次
2019-12-10更新
|
195次组卷
|
2卷引用:陕西省宝鸡中学、西安三中等五校2020届高三上学期第一次联考化学试题
7 . 某温度下,在容积固定的密闭容器中,发生可逆反应A(g)+2B(g) 2C(g),平衡时,各物质的浓度比为c(A):c(B):c(C)=1:1:2保持温度不变,以1:1:2的体积比再充入A、B、C,则下列叙述正确的是()
2C(g),平衡时,各物质的浓度比为c(A):c(B):c(C)=1:1:2保持温度不变,以1:1:2的体积比再充入A、B、C,则下列叙述正确的是()
 2C(g),平衡时,各物质的浓度比为c(A):c(B):c(C)=1:1:2保持温度不变,以1:1:2的体积比再充入A、B、C,则下列叙述正确的是()
2C(g),平衡时,各物质的浓度比为c(A):c(B):c(C)=1:1:2保持温度不变,以1:1:2的体积比再充入A、B、C,则下列叙述正确的是()| A.刚充入时反应速率:v(正)减小,v(逆)增大 |
| B.达到新的平衡时:反应混合物中A.B的物质的量分数不变 |
| C.达到新的平衡时:c(A):c(B):c(C)仍为1:1:2 |
| D.达到新的平衡过程中:体系压强先增大,后减小 |
您最近一年使用:0次
8 . Ⅰ.铁及其化合物之间的相互转化可用下式表示:
Fe2+ Fe3+
Fe3+
 (高铁酸根离子)
(高铁酸根离子)
回答下列有关问题:
(1)Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,实现上述①的转化,要求产物纯净。可选用的试剂是_________ (选填序号);
a.Cl2 b.Fe c.HNO3 d.H2O2
(2)上述转化得到的硫酸铁可用于电化浸出黄铜矿精矿工艺。精矿在阳极浸出的反应比较复杂,其中有一主要反应:CuFeS2+4Fe3+=Cu2++5Fe2++2S。
则下列说法正确的是_________________ (选填序号);
a.从物质分类的角度看,黄铜矿属于合金
b.反应中,所有铁元素均被还原
c.反应中,CuFeS2既作氧化剂又作还原剂
d.当转移1mol电子时,有46 g CuFeS2参加反应
(3)下述反应中,若FeSO4和O2的系数比为2:1,试配平下列方程式:
( ) FeSO4+( ) K2O2
( ) K2FeO4+( ) K2O+( ) K2SO4+( ) O2↑
 FeSO4+
FeSO4+ K2O2
K2O2
 K2FeO4+
K2FeO4+ K2O+
K2O+ K2SO4+
K2SO4+ O2↑
O2↑
(4)高铁酸钾(K2FeO4)是一种新型、高效的绿色水处理剂,在水中发生反应生成氢氧化铁胶体。高铁酸钾作为水处理剂发挥的作用是_______ 、_________ 。
Ⅱ.在100℃时,将0.100 mol的四氧化二氮气体充入1 L恒容抽真空的密闭容器中,发生反应:N2O4 2NO2,隔一定时间对该容器内的物质浓度进行分析得到下表数据:
2NO2,隔一定时间对该容器内的物质浓度进行分析得到下表数据:
(5)该反应的平衡常数表达式为__________ ;从表中数据分析:c1___ c2;(填“>”、“<”或“=”).
(6)在下图中画出并标明此反应中N2O4和NO2的浓度随时间变化的曲线____ .

(7)在上述条件下,从反应开始至达到化学平衡时,N2O4的平均反应速率为________ mol/(L·s).
(8)达平衡后下列条件的改变可使NO2气体浓度增大的是________ .
A.增大容器的容积 B.再充入一定量的N2O4
C.分离出一定量的NO2 D.再充入一定量的He
(9)若起始时充入NO2气体0.080 mol,则达到平衡时NO2气体的转化率为________ .
Fe2+
 Fe3+
Fe3+
 (高铁酸根离子)
(高铁酸根离子)回答下列有关问题:
(1)Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,实现上述①的转化,要求产物纯净。可选用的试剂是
a.Cl2 b.Fe c.HNO3 d.H2O2
(2)上述转化得到的硫酸铁可用于电化浸出黄铜矿精矿工艺。精矿在阳极浸出的反应比较复杂,其中有一主要反应:CuFeS2+4Fe3+=Cu2++5Fe2++2S。
则下列说法正确的是
a.从物质分类的角度看,黄铜矿属于合金
b.反应中,所有铁元素均被还原
c.反应中,CuFeS2既作氧化剂又作还原剂
d.当转移1mol电子时,有46 g CuFeS2参加反应
(3)下述反应中,若FeSO4和O2的系数比为2:1,试配平下列方程式:

 FeSO4+
FeSO4+ K2O2
K2O2
 K2FeO4+
K2FeO4+ K2O+
K2O+ K2SO4+
K2SO4+ O2↑
O2↑(4)高铁酸钾(K2FeO4)是一种新型、高效的绿色水处理剂,在水中发生反应生成氢氧化铁胶体。高铁酸钾作为水处理剂发挥的作用是
Ⅱ.在100℃时,将0.100 mol的四氧化二氮气体充入1 L恒容抽真空的密闭容器中,发生反应:N2O4
 2NO2,隔一定时间对该容器内的物质浓度进行分析得到下表数据:
2NO2,隔一定时间对该容器内的物质浓度进行分析得到下表数据:| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| c(N2O4)/mol/L | 0.100 | c1 | 0.050 | c3 | c4 |
| c(NO2)/mol/L | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
(6)在下图中画出并标明此反应中N2O4和NO2的浓度随时间变化的曲线

(7)在上述条件下,从反应开始至达到化学平衡时,N2O4的平均反应速率为
(8)达平衡后下列条件的改变可使NO2气体浓度增大的是
A.增大容器的容积 B.再充入一定量的N2O4
C.分离出一定量的NO2 D.再充入一定量的He
(9)若起始时充入NO2气体0.080 mol,则达到平衡时NO2气体的转化率为
您最近一年使用:0次



